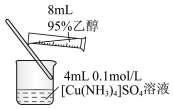
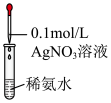
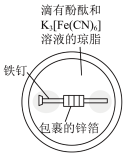
1 . 下列实验装置或操作不能达到实验目的的是
|
|
A.检验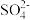 是否沉淀完全 是否沉淀完全 | B.析出晶体[Cu(NH3)4]SO4·H2O |
|
|
| C.配制银氨溶液 | D.牺牲阳极法保护铁 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
2 . 下列实验设计不能达到实验目的的是
| 选项 | 实验目的 | 实验设计 |
| A |  在水溶液中存在平衡 在水溶液中存在平衡 | 向1mL  的 的 溶液中加入1mL浓KI溶液,振荡试管,观察颜色变化 溶液中加入1mL浓KI溶液,振荡试管,观察颜色变化 |
| B | 比较AgCl和AgI的 | 向2mL 0.1 的NaCl溶液中滴加两滴等浓度的 的NaCl溶液中滴加两滴等浓度的 溶液,再滴加4滴等浓度KI溶液,观察现象 溶液,再滴加4滴等浓度KI溶液,观察现象 |
| C | 检验某卤代烃中的是否含有氯元素 | 取卤代烃少许与NaOH乙醇溶液共热后,加入稀硝酸酸化,再加入 溶液,观察是否有白色沉淀生成 溶液,观察是否有白色沉淀生成 |
| D | 比较配位键 和 和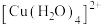 的稳定性 的稳定性 | 向 溶液中加入少量NaCl固体,振荡,观察溶液颜色变化 溶液中加入少量NaCl固体,振荡,观察溶液颜色变化 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
3 . 某小组同学向 溶液中匀速滴加氨水,实验数据及现象记录如下:
溶液中匀速滴加氨水,实验数据及现象记录如下:
经检测,蓝绿色沉淀为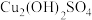 。下列说法正确的是
。下列说法正确的是
 溶液中匀速滴加氨水,实验数据及现象记录如下:
溶液中匀速滴加氨水,实验数据及现象记录如下:时间/s | 0~20 | 20~94 | 94~144 | 144~430 |
pH | 从5.2升高至5.9 | 从5.9升高至6.8 | 从6.8升高至9.5 | 从9.5升高至11.2 |
现象 | 无明显现象 | 产生蓝绿色沉淀,并逐渐增多 | 无明显变化 | 蓝绿色沉淀溶解,溶液变为深蓝色 |
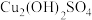 。下列说法正确的是
。下列说法正确的是A.0s时, 是因为 是因为 |
B.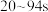 ,主要反应的离子方程式为 ,主要反应的离子方程式为 |
| C.从94s到144s,混合液中水的电离程度增大 |
D.从144s到430s,pH升高与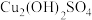 转化为 转化为 的反应有关 的反应有关 |
您最近一年使用:0次
7日内更新
|
145次组卷
|
2卷引用:北京市海淀区2023-2024学年高三下学期期末练习(二模)化学试题
4 . 实验装置为实验提供必要条件和测量手段。如图装置不能达到实验目的的是
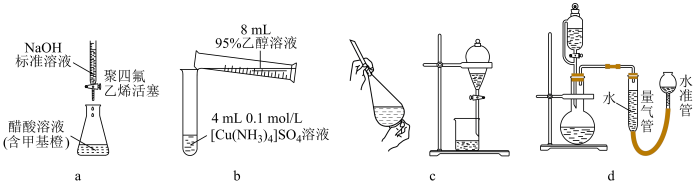
| A.图a测定醋酸溶液的浓度 |
| B.图b制备[Cu(NH3)4]SO4•H2O晶体 |
| C.图c用NaOH溶液除去溴苯中的溴单质 |
| D.图d测定一定质量的Na2O2和Na2O混合物中Na2O2的含量 |
您最近一年使用:0次
7日内更新
|
427次组卷
|
2卷引用:辽宁省重点高中协作校2024届高三下学期第二次模拟考试化学试题
5 . 下列关于物质的结构与性质或应用的描述中错误的是
| A.葡萄糖可用于玻璃等材料表面化学覆银,因为葡萄糖具有还原性 |
B.AgCl溶于氨水,是由于AgCl与 反应生成了可溶性配合物 反应生成了可溶性配合物 |
C. 比 比 的热稳定性强,因为氨分子间存在氢键 的热稳定性强,因为氨分子间存在氢键 |
D.利用 除去HCl气体中混有的 除去HCl气体中混有的 ,可从 ,可从 和 和 都是非极性分子的角度解释 都是非极性分子的角度解释 |
您最近一年使用:0次
名校
6 . 硫酸四氨合铜晶体{[Cu(NH3)4]SO4∙H2O}在工业上用途广泛,常温下该物质在空气中不稳定,受热时易发生分解。现以铜粉、3mol/L的硫酸、浓氨水、10%NaOH溶液、95%的乙醇溶液、0.500mol/L稀盐酸、0.500mol/L的NaOH溶液来合成硫酸四氨合铜晶体并测定其纯度。(已知:CuSO4在水中的溶解度随温度的升高而增大。)
I.CuSO4溶液的制备
①称取4g铜粉,在A仪器中灼烧10分钟并不断搅拌,放置冷却。
②在蒸发皿中加入30mL 3mol/L的硫酸,将A中固体慢慢放入其中,加热并不断搅拌。
③趁热过滤得蓝色溶液。
(1)A仪器的名称为___________ 。
(2)第③步中,趁热过滤的目的是___________ 。
Ⅱ.晶体的制备
将上述制备的CuSO4溶液按如图所示进行操作___________ 。
(4)析出晶体时采用加入乙醇的方法,请结合物质结构与性质知识解释乙醇的作用:___________ ,此处不采用浓缩结晶的原因是___________ 。
Ⅲ.氨含量的测定
精确称取w g晶体,加适量水溶解,注入如图所示的三颈烧瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,并用蒸馏水冲洗导管内壁,用V1 mL 0.5mol/L的盐酸标准溶液完全吸收。取下接收瓶,用0.5mol/L NaOH标准溶液滴定过剩的HCl,到终点时消耗V2 mL NaOH溶液。___________ 。
(6)为了减少误差,用NaOH标准溶液滴定过剩的HCl溶液时最好使用___________ (填“酚酞”或“甲基橙”)作指示剂。
(7)样品中氨的质量分数的表达式为___________ (用含w、V1、V2的代数式表式)。
(8)下列实验操作可能使氨含量的测定结果偏高的是___________(填标号)。
I.CuSO4溶液的制备
①称取4g铜粉,在A仪器中灼烧10分钟并不断搅拌,放置冷却。
②在蒸发皿中加入30mL 3mol/L的硫酸,将A中固体慢慢放入其中,加热并不断搅拌。
③趁热过滤得蓝色溶液。
(1)A仪器的名称为
(2)第③步中,趁热过滤的目的是
Ⅱ.晶体的制备
将上述制备的CuSO4溶液按如图所示进行操作

(4)析出晶体时采用加入乙醇的方法,请结合物质结构与性质知识解释乙醇的作用:
Ⅲ.氨含量的测定
精确称取w g晶体,加适量水溶解,注入如图所示的三颈烧瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,并用蒸馏水冲洗导管内壁,用V1 mL 0.5mol/L的盐酸标准溶液完全吸收。取下接收瓶,用0.5mol/L NaOH标准溶液滴定过剩的HCl,到终点时消耗V2 mL NaOH溶液。

(6)为了减少误差,用NaOH标准溶液滴定过剩的HCl溶液时最好使用
(7)样品中氨的质量分数的表达式为
(8)下列实验操作可能使氨含量的测定结果偏高的是___________(填标号)。
| A.滴定时未用NaOH标准溶液润洗滴定管 |
| B.读数时,滴定前平视,滴定后俯视 |
| C.将样品液中的氨全部蒸出后,未用蒸馏水冲洗导管内壁 |
| D.取下接收瓶前,未用蒸馏水冲洗插入接收瓶中的导管外壁 |
您最近一年使用:0次
7 . 砷化镓是一种高性能半导体材料,被广泛应用于光电子器件等领域。砷化镓立方晶胞(晶胞参数为 )如图1。下列说法正确的是
)如图1。下列说法正确的是
 )如图1。下列说法正确的是
)如图1。下列说法正确的是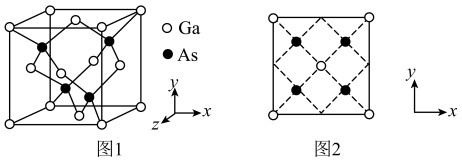
A. 的配位数为2 的配位数为2 | B.该晶胞沿z轴方向的平面投影如图2 |
| C.晶体中配位键占共价键总数的25% | D.晶胞中砷原子与镓原子间的最短距离为 |
您最近一年使用:0次
7日内更新
|
446次组卷
|
4卷引用:2024届黑龙江省哈尔滨师范大学附属中学高三下学期三模化学试题
名校
解题方法
8 . 化学与人类生产、生活息息相关。下列叙述错误的是
| A.18—冠—6分子可识别K+,因此可增大KI在苯中的溶解度 |
| B.向硫酸四氨合铜溶液中加入乙醇会析出深蓝色晶体,因为乙醇的极性比水小 |
| C.壁虎能在天花板上爬行,是因为它的细毛与墙体之间有范德华力 |
| D.“杯酚”可分离C60和C70,体现了超分子的“自组装”特性 |
您最近一年使用:0次
9 . 下列关于超分子和配合物的叙述错误的是
A.配合物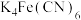 配离子的中心离子配位数是6 配离子的中心离子配位数是6 |
B.配合物 中存在离子键、共价键、配位键,若加入足量 中存在离子键、共价键、配位键,若加入足量 溶液,所有 溶液,所有 均被完全沉淀 均被完全沉淀 |
C.超分子“杯酚”具有分子识别的特性,利用此特性可分离 和 和 |
| D.人体细胞和细胞器的双分子膜体现了超分子的自组装特征 |
您最近一年使用:0次
10 . NA表示阿伏加德罗常数的值,配合物Na2[Fe(CN)5(NO)]可用于离子检验。下列说法不正确的是
| A.该配合物中存在离子键、配位键、极性键、非极性键 |
| B.配离子为[Fe(CN)5(NO)]2-,中心离子为Fe3+,配位数为6,配位原子为C和N |
| C.1mol该配合物中σ键数目为6NA |
| D.该配合物为离子化合物,易电离,1mol配合物电离共得到3NA个阴、阳离子 |
您最近一年使用:0次