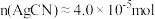解题方法
1 . 某实验小组以粗镍(含少量 和
和 杂质)为原料制备
杂质)为原料制备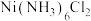 ,并测定相关组分的含量,制备流程示意图如下:
,并测定相关组分的含量,制备流程示意图如下: 为绿色难溶物;
为绿色难溶物;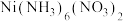 、
、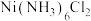 均为可溶于水的蓝紫色晶体,碱性条件下稳定存在,下列说法不正确的是
均为可溶于水的蓝紫色晶体,碱性条件下稳定存在,下列说法不正确的是
 和
和 杂质)为原料制备
杂质)为原料制备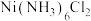 ,并测定相关组分的含量,制备流程示意图如下:
,并测定相关组分的含量,制备流程示意图如下:
 为绿色难溶物;
为绿色难溶物;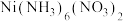 、
、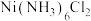 均为可溶于水的蓝紫色晶体,碱性条件下稳定存在,下列说法不正确的是
均为可溶于水的蓝紫色晶体,碱性条件下稳定存在,下列说法不正确的是A.试剂X的作用是调节 除去 除去 和 和 杂质,则试剂X可为 杂质,则试剂X可为 |
B. 过程的转化离子方程式为 过程的转化离子方程式为 |
C.实验配制3.0 稀硝酸250 稀硝酸250 需要的玻璃仪器有烧杯、量筒、玻璃棒、250 需要的玻璃仪器有烧杯、量筒、玻璃棒、250 容量瓶 容量瓶 |
| D.步骤c、d中为防止氨水分解及降低固体溶解度需0~10℃冷水浴控温,则温度计应在水浴中 |
您最近一年使用:0次
名校
2 . 硫酸四氨合铜晶体{[Cu(NH3)4]SO4∙H2O}在工业上用途广泛,常温下该物质在空气中不稳定,受热时易发生分解。现以铜粉、3mol/L的硫酸、浓氨水、10%NaOH溶液、95%的乙醇溶液、0.500mol/L稀盐酸、0.500mol/L的NaOH溶液来合成硫酸四氨合铜晶体并测定其纯度。(已知:CuSO4在水中的溶解度随温度的升高而增大。)
I.CuSO4溶液的制备
①称取4g铜粉,在A仪器中灼烧10分钟并不断搅拌,放置冷却。
②在蒸发皿中加入30mL 3mol/L的硫酸,将A中固体慢慢放入其中,加热并不断搅拌。
③趁热过滤得蓝色溶液。
(1)A仪器的名称为___________ 。
(2)第③步中,趁热过滤的目的是___________ 。
Ⅱ.晶体的制备
将上述制备的CuSO4溶液按如图所示进行操作___________ 。
(4)析出晶体时采用加入乙醇的方法,请结合物质结构与性质知识解释乙醇的作用:___________ ,此处不采用浓缩结晶的原因是___________ 。
Ⅲ.氨含量的测定
精确称取w g晶体,加适量水溶解,注入如图所示的三颈烧瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,并用蒸馏水冲洗导管内壁,用V1 mL 0.5mol/L的盐酸标准溶液完全吸收。取下接收瓶,用0.5mol/L NaOH标准溶液滴定过剩的HCl,到终点时消耗V2 mL NaOH溶液。___________ 。
(6)为了减少误差,用NaOH标准溶液滴定过剩的HCl溶液时最好使用___________ (填“酚酞”或“甲基橙”)作指示剂。
(7)样品中氨的质量分数的表达式为___________ (用含w、V1、V2的代数式表式)。
(8)下列实验操作可能使氨含量的测定结果偏高的是___________(填标号)。
I.CuSO4溶液的制备
①称取4g铜粉,在A仪器中灼烧10分钟并不断搅拌,放置冷却。
②在蒸发皿中加入30mL 3mol/L的硫酸,将A中固体慢慢放入其中,加热并不断搅拌。
③趁热过滤得蓝色溶液。
(1)A仪器的名称为
(2)第③步中,趁热过滤的目的是
Ⅱ.晶体的制备
将上述制备的CuSO4溶液按如图所示进行操作

(4)析出晶体时采用加入乙醇的方法,请结合物质结构与性质知识解释乙醇的作用:
Ⅲ.氨含量的测定
精确称取w g晶体,加适量水溶解,注入如图所示的三颈烧瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,并用蒸馏水冲洗导管内壁,用V1 mL 0.5mol/L的盐酸标准溶液完全吸收。取下接收瓶,用0.5mol/L NaOH标准溶液滴定过剩的HCl,到终点时消耗V2 mL NaOH溶液。

(6)为了减少误差,用NaOH标准溶液滴定过剩的HCl溶液时最好使用
(7)样品中氨的质量分数的表达式为
(8)下列实验操作可能使氨含量的测定结果偏高的是___________(填标号)。
| A.滴定时未用NaOH标准溶液润洗滴定管 |
| B.读数时,滴定前平视,滴定后俯视 |
| C.将样品液中的氨全部蒸出后,未用蒸馏水冲洗导管内壁 |
| D.取下接收瓶前,未用蒸馏水冲洗插入接收瓶中的导管外壁 |
您最近一年使用:0次
2024-06-02更新
|
120次组卷
|
2卷引用:福建省福州市八县市一中2024届高三下学期模拟联考化学试题
名校
解题方法
3 . 探究配制不同金属离子—氨配体溶液的差异性,实验操作及现象如下:
资料:①饱和氨水的浓度约为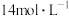
② 为浅青色沉淀
为浅青色沉淀
③ 溶液为红色,在活性炭催化下转化为橙黄色的
溶液为红色,在活性炭催化下转化为橙黄色的 溶液
溶液
(1)实验i-a中生成蓝色沉淀的离子方程式为___________ 。
(2)有研究认为蓝色沉淀中还有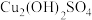 成分,其可以溶于稀酸。检验蓝色沉淀中不止含
成分,其可以溶于稀酸。检验蓝色沉淀中不止含 的实验操作为:将蓝色沉淀过滤,充分洗涤后,
的实验操作为:将蓝色沉淀过滤,充分洗涤后,___________ 。(填后续操作和现象)
(3)对比实验i-a和实验i-b,从平衡移动角度,结合化学用语解释 对
对 生成有一定促进作用的原因
生成有一定促进作用的原因___________ 。
(4)对比实验i-a和实验i-c中再加入过量氨水前的反应,推测 对
对 生成有一定促进作用。设计下图所示实验:在1、2试管内分别完成对实验i-a的重复,再分别加入不同试剂。实验现象证实了预测。
生成有一定促进作用。设计下图所示实验:在1、2试管内分别完成对实验i-a的重复,再分别加入不同试剂。实验现象证实了预测。___________ ,c=___________ 。
②实验现象是___________ 。
(5)从平衡移动角度,结合化学用语,解释 对
对 生成有一定促进作用的原因
生成有一定促进作用的原因___________ 。
(6)针对实验ii未能成功配制 溶液,结合以上分析,提出改进方案:
溶液,结合以上分析,提出改进方案:
①在实验ii-a的基础上继续加入___________ ,即可成功配制。
②验证配制成功的操作及实验现象是:取①的上层红色清液,加入少许活性炭振荡试管,溶液转为橙黄色,反应的离子方程式为:___________ 。
(7)综合以上分析,配制不同金属离子—氨配体溶液的难易程度存在差异性,推测可能与以下因素有关:配位数、___________ 。
| 实验序号 | 操作 | 现象 | |
实验i: 的配制 的配制 | 实验i-a | 在试管内混合 溶液和 溶液和 溶液,再加入过量的 溶液,再加入过量的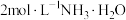 | 产生蓝色沉淀,加入 后沉淀少部分溶解,溶液变浑浊,静置后上层为深蓝色溶液。 后沉淀少部分溶解,溶液变浑浊,静置后上层为深蓝色溶液。 |
| 实验i-b | 在试管内混合 溶液和 溶液和 溶液,再加入过量的 溶液,再加入过量的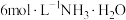 | 产生蓝色沉淀,加入 后沉淀大部分溶解,溶液变浑浊,静置后上层为深蓝色溶液。 后沉淀大部分溶解,溶液变浑浊,静置后上层为深蓝色溶液。 | |
| 实验i-c | 在试管内混合 溶液和 溶液和 溶液,再加入过量的 溶液,再加入过量的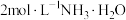 | 产生蓝色沉淀,加入 后沉淀完全溶解,得到澄清的深蓝色溶液。 后沉淀完全溶解,得到澄清的深蓝色溶液。 | |
实验ii: 的配制 的配制 | 实验ii-a | 在试管内混合 溶液和过量 溶液和过量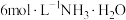 | 得到浅青色沉淀,沉淀未见明显溶解。 |
| 实验ii-b | 在试管内混合 溶液和过量 溶液和过量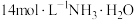 | 得到浅青色沉淀,沉淀未见明显溶解。 | |
实验iii: 的配制 的配制 | 实验iii | 在试管内混合 溶液和 溶液和 溶液,再加入过量的 溶液,再加入过量的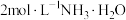 | 产生白色沉淀,加入 后沉淀完全溶解,得到无色溶液。 后沉淀完全溶解,得到无色溶液。 |
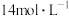
②
 为浅青色沉淀
为浅青色沉淀③
 溶液为红色,在活性炭催化下转化为橙黄色的
溶液为红色,在活性炭催化下转化为橙黄色的 溶液
溶液(1)实验i-a中生成蓝色沉淀的离子方程式为
(2)有研究认为蓝色沉淀中还有
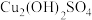 成分,其可以溶于稀酸。检验蓝色沉淀中不止含
成分,其可以溶于稀酸。检验蓝色沉淀中不止含 的实验操作为:将蓝色沉淀过滤,充分洗涤后,
的实验操作为:将蓝色沉淀过滤,充分洗涤后,(3)对比实验i-a和实验i-b,从平衡移动角度,结合化学用语解释
 对
对 生成有一定促进作用的原因
生成有一定促进作用的原因(4)对比实验i-a和实验i-c中再加入过量氨水前的反应,推测
 对
对 生成有一定促进作用。设计下图所示实验:在1、2试管内分别完成对实验i-a的重复,再分别加入不同试剂。实验现象证实了预测。
生成有一定促进作用。设计下图所示实验:在1、2试管内分别完成对实验i-a的重复,再分别加入不同试剂。实验现象证实了预测。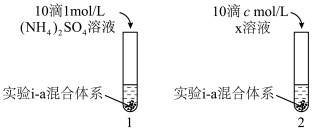
②实验现象是
(5)从平衡移动角度,结合化学用语,解释
 对
对 生成有一定促进作用的原因
生成有一定促进作用的原因(6)针对实验ii未能成功配制
 溶液,结合以上分析,提出改进方案:
溶液,结合以上分析,提出改进方案:①在实验ii-a的基础上继续加入
②验证配制成功的操作及实验现象是:取①的上层红色清液,加入少许活性炭振荡试管,溶液转为橙黄色,反应的离子方程式为:
(7)综合以上分析,配制不同金属离子—氨配体溶液的难易程度存在差异性,推测可能与以下因素有关:配位数、
您最近一年使用:0次
2024-05-31更新
|
256次组卷
|
3卷引用:北京市昌平区2023-2024学年高三下学期二模化学试题
名校
4 . 探究配制不同金属离子—氨配体溶液的差异性,实验操作及现象如下:
资料:①Co(OH)2为浅青色沉淀
②[Co(NH3)6]2+溶液为红色,在活性炭催化下转化为橙黄色的[Co(NH3)6]3+溶液
(1)实验i-a中生成蓝色沉淀的离子方程式为___________ 。
(2)研究认为实验i-a中蓝色沉淀中还有Cu2(OH)2SO4成分,其可以溶于稀酸。检验蓝色沉淀中不止含Cu(OH)2的实验操作为:将蓝色沉淀过滤,充分洗涤后,___________ 。(填后续操作和现象)
(3)对比实验i-a和实验i-c中再加入过量氨水前的现象,推测NH4+对[Cu(NH3)4]2+生成有一定促进作用。设计如图所示实验:在1、2试管内分别完成对实验i-a的重复,再分别加入不同试剂。实验现象证实了预测,则x的化学式是___________ ,c=___________ 。___________ 。
(5)针对实验ii未能成功配制[Co(NH3)6]2+溶液,结合以上分析,提出改进方案:
①在实验ii-a的基础上继续加入___________ ,即可成功配制。
②验证配制成功的操作及实验现象是:___________ ;反应的离子方程式为:___________ 。
| 实验序号 | 操作 | 现象 | |
| 实验i:[Cu(NH3)4]2+的配制 | 实验i-a | 在试管内混合CuSO4溶液和NaOH溶液,再加入过量的2mol/LNH3·H2O | 产生蓝色沉淀,加入NH3·H2O后沉淀少部分溶解,溶液变浑浊,静置后上层为深蓝色溶液。 |
| 实验i-b | 在试管内混合CuSO4溶液和NaOH溶液,再加入过量的6mol/LNH3·H2O | 产生蓝色沉淀,加入NH3·H2O后沉淀大部分溶解,溶液变浑浊,静置后上层为深蓝色溶液。 | |
| 实验i-c | 在试管内混合CuSO4溶液和NH3·H2O溶液,再加入过量的2mol/LNH3·H2O | 产生蓝色沉淀,加入NH3·H2O后沉淀完全溶解,得到澄清的深蓝色溶液。 | |
| 实验ii:[Co(NH3)6]2+的配制 | 实验ii-a | 在试管内混合CoCl2溶液和过量6mol/LNH3·H2O | 得到浅青色沉淀,沉淀未见明显溶解。 |
| 实验ii-b | 在试管内混合CoCl2溶液和过量14mol/LNH3·H2O | 得到浅青色沉淀,沉淀未见明显溶解。 | |
②[Co(NH3)6]2+溶液为红色,在活性炭催化下转化为橙黄色的[Co(NH3)6]3+溶液
(1)实验i-a中生成蓝色沉淀的离子方程式为
(2)研究认为实验i-a中蓝色沉淀中还有Cu2(OH)2SO4成分,其可以溶于稀酸。检验蓝色沉淀中不止含Cu(OH)2的实验操作为:将蓝色沉淀过滤,充分洗涤后,
(3)对比实验i-a和实验i-c中再加入过量氨水前的现象,推测NH4+对[Cu(NH3)4]2+生成有一定促进作用。设计如图所示实验:在1、2试管内分别完成对实验i-a的重复,再分别加入不同试剂。实验现象证实了预测,则x的化学式是
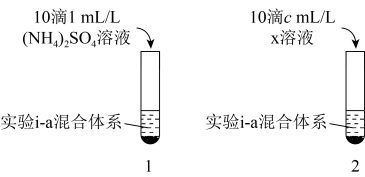
(5)针对实验ii未能成功配制[Co(NH3)6]2+溶液,结合以上分析,提出改进方案:
①在实验ii-a的基础上继续加入
②验证配制成功的操作及实验现象是:
您最近一年使用:0次
5 . 卤素单质及其化合物在科研和工农业生产中有着广泛的应用。回答下列问题:
(1)氟原子激发态的电子排布式有________ ,其中能量较高的是________ 。(填标号)
A. B.
B. C.
C.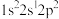 D.
D.
(2)基态Br原子的核外电子排布式为________ 。
(3) 中提供电子对形成配位键的原子是
中提供电子对形成配位键的原子是________ ,中心离子的配位数为________ 。
(4)Kr是第四周期的稀有气体元素,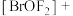 的中心原子Br的杂化轨道类型为
的中心原子Br的杂化轨道类型为________ 。
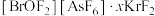 晶体中的微粒间作用力有
晶体中的微粒间作用力有________ (填标号)。
a.氢键 b.离子键 c.极性共价键 d.非极性共价键
(5)固态氟化氢中存在 形式,画出
形式,画出 的链状结构
的链状结构________ 。
(6)四氟乙烯 和聚四氟乙烯中C的杂化轨道类型分别为
和聚四氟乙烯中C的杂化轨道类型分别为________ 和________ ;聚四氟乙烯的化学稳定性高于聚乙烯,从化学键的角度解释原因________ 。
(1)氟原子激发态的电子排布式有
A.
 B.
B. C.
C.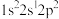 D.
D.
(2)基态Br原子的核外电子排布式为
(3)
 中提供电子对形成配位键的原子是
中提供电子对形成配位键的原子是(4)Kr是第四周期的稀有气体元素,
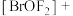 的中心原子Br的杂化轨道类型为
的中心原子Br的杂化轨道类型为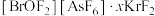 晶体中的微粒间作用力有
晶体中的微粒间作用力有a.氢键 b.离子键 c.极性共价键 d.非极性共价键
(5)固态氟化氢中存在
 形式,画出
形式,画出 的链状结构
的链状结构(6)四氟乙烯
 和聚四氟乙烯中C的杂化轨道类型分别为
和聚四氟乙烯中C的杂化轨道类型分别为
您最近一年使用:0次
名校
解题方法
6 . 某学习小组为探究化合物 [化学式为
[化学式为 ]的性质,设计并完成如下实验:
]的性质,设计并完成如下实验:
I.取少量固体 ,加入稀盐酸,固体溶解,有无色气体逸出,且生成蓝色溶液。
,加入稀盐酸,固体溶解,有无色气体逸出,且生成蓝色溶液。
Ⅱ.取 固体
固体 ,按如图装置进行实验(夹持装置略,装置
,按如图装置进行实验(夹持装置略,装置 和
和 中为常见药品):
中为常见药品):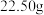 残渣
残渣 ,装置c增重
,装置c增重 ;
;
Ⅲ.将Ⅱ中的残渣B加入到水中,部分溶解,离心分离出 红色固体
红色固体 (单一成分),向溶解液中继续加水至
(单一成分),向溶解液中继续加水至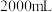 得到溶液
得到溶液 ;
;
IV.测定溶液 的
的 ,再取
,再取 溶液
溶液 加入足量的稀硫酸,得到
加入足量的稀硫酸,得到 白色沉淀
白色沉淀 。
。
V.将红色固体 溶于稀硝酸得到蓝色溶液,加入过量的氨水生成深蓝色溶液
溶于稀硝酸得到蓝色溶液,加入过量的氨水生成深蓝色溶液 。
。
回答下列问题:
(1)步骤Ⅱ中:
①装置 用石英管,而不用普通玻璃管的原因是
用石英管,而不用普通玻璃管的原因是___________ ,装置 中的前段和后段分别盛有一种试剂,有检测气体产物中某一成分的作用,装置
中的前段和后段分别盛有一种试剂,有检测气体产物中某一成分的作用,装置 中盛放药品的方法是
中盛放药品的方法是___________ ;装置 的作用是
的作用是___________ 。
②停止加热后的实验操作是___________ 。
(2)步骤Ⅲ中向溶解液继续加水至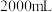 得到溶液
得到溶液 时,一定未用到下列仪器中的
时,一定未用到下列仪器中的___________ (填名称)。 的
的 的实验操作是
的实验操作是___________ ;溶液 是
是___________ (填“单一溶质”或“混合溶质”),理由是___________ 。
(4)步骤V中红色固体 溶于稀硝酸发生反应的离子方程式是
溶于稀硝酸发生反应的离子方程式是___________ 。
(5) 中的z:w=
中的z:w=___________ 。
 [化学式为
[化学式为 ]的性质,设计并完成如下实验:
]的性质,设计并完成如下实验:I.取少量固体
 ,加入稀盐酸,固体溶解,有无色气体逸出,且生成蓝色溶液。
,加入稀盐酸,固体溶解,有无色气体逸出,且生成蓝色溶液。Ⅱ.取
 固体
固体 ,按如图装置进行实验(夹持装置略,装置
,按如图装置进行实验(夹持装置略,装置 和
和 中为常见药品):
中为常见药品):
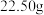 残渣
残渣 ,装置c增重
,装置c增重 ;
;Ⅲ.将Ⅱ中的残渣B加入到水中,部分溶解,离心分离出
 红色固体
红色固体 (单一成分),向溶解液中继续加水至
(单一成分),向溶解液中继续加水至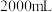 得到溶液
得到溶液 ;
;IV.测定溶液
 的
的 ,再取
,再取 溶液
溶液 加入足量的稀硫酸,得到
加入足量的稀硫酸,得到 白色沉淀
白色沉淀 。
。V.将红色固体
 溶于稀硝酸得到蓝色溶液,加入过量的氨水生成深蓝色溶液
溶于稀硝酸得到蓝色溶液,加入过量的氨水生成深蓝色溶液 。
。回答下列问题:
(1)步骤Ⅱ中:
①装置
 用石英管,而不用普通玻璃管的原因是
用石英管,而不用普通玻璃管的原因是 中的前段和后段分别盛有一种试剂,有检测气体产物中某一成分的作用,装置
中的前段和后段分别盛有一种试剂,有检测气体产物中某一成分的作用,装置 中盛放药品的方法是
中盛放药品的方法是 的作用是
的作用是②停止加热后的实验操作是
(2)步骤Ⅲ中向溶解液继续加水至
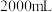 得到溶液
得到溶液 时,一定未用到下列仪器中的
时,一定未用到下列仪器中的
 的
的 的实验操作是
的实验操作是 是
是(4)步骤V中红色固体
 溶于稀硝酸发生反应的离子方程式是
溶于稀硝酸发生反应的离子方程式是(5)
 中的z:w=
中的z:w=
您最近一年使用:0次
名校
解题方法
7 . 某实验小组探究 的制取、性质及其应用。按要求回答下列问题。已知:①
的制取、性质及其应用。按要求回答下列问题。已知:① 是难溶于水的白色固体 ②
是难溶于水的白色固体 ② (无色)。
(无色)。
【实验i】探究 的制取(如下图所示装置,夹持装置略)
的制取(如下图所示装置,夹持装置略) 的
的 溶液
溶液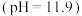 中通入
中通入 一段时间,至
一段时间,至 中溶液的
中溶液的 为7时向其中滴加一定量
为7时向其中滴加一定量 溶液,产生白色沉淀,过滤、洗涤、干燥,得到
溶液,产生白色沉淀,过滤、洗涤、干燥,得到 固体。
固体。
(1)试剂a是_______ 。
(2)向 溶液中通入
溶液中通入 的目的可能是
的目的可能是_______ 。
(3) 为7时滴加一定量
为7时滴加一定量 溶液产生白色沉淀的离子方程式为
溶液产生白色沉淀的离子方程式为_______ 。
(4)同学甲在 中出现白色沉淀之后继续通
中出现白色沉淀之后继续通 ,你认为同学甲的操作合理与否,并说明理由
,你认为同学甲的操作合理与否,并说明理由_______ 。
【实验ⅱ和实验ⅲ】探究 的性质
的性质_______ 。
(6)对比实验ⅱ和实验ⅲ,可以得出的实验结论为_______ 。
【实验ⅳ】探究的应用
(7)将 溶于乳酸
溶于乳酸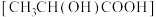 中制得可溶性的乳酸亚铁补血剂。同学乙用酸性
中制得可溶性的乳酸亚铁补血剂。同学乙用酸性 溶液测定该补血剂中亚铁含量,再计算乳酸亚铁的质量分数,发现乳酸亚铁的质量分数总是大于
溶液测定该补血剂中亚铁含量,再计算乳酸亚铁的质量分数,发现乳酸亚铁的质量分数总是大于 (操作误差略),其原因是
(操作误差略),其原因是_______ 。
 的制取、性质及其应用。按要求回答下列问题。已知:①
的制取、性质及其应用。按要求回答下列问题。已知:① 是难溶于水的白色固体 ②
是难溶于水的白色固体 ② (无色)。
(无色)。【实验i】探究
 的制取(如下图所示装置,夹持装置略)
的制取(如下图所示装置,夹持装置略)
 的
的 溶液
溶液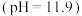 中通入
中通入 一段时间,至
一段时间,至 中溶液的
中溶液的 为7时向其中滴加一定量
为7时向其中滴加一定量 溶液,产生白色沉淀,过滤、洗涤、干燥,得到
溶液,产生白色沉淀,过滤、洗涤、干燥,得到 固体。
固体。(1)试剂a是
(2)向
 溶液中通入
溶液中通入 的目的可能是
的目的可能是(3)
 为7时滴加一定量
为7时滴加一定量 溶液产生白色沉淀的离子方程式为
溶液产生白色沉淀的离子方程式为(4)同学甲在
 中出现白色沉淀之后继续通
中出现白色沉淀之后继续通 ,你认为同学甲的操作合理与否,并说明理由
,你认为同学甲的操作合理与否,并说明理由【实验ⅱ和实验ⅲ】探究
 的性质
的性质
(6)对比实验ⅱ和实验ⅲ,可以得出的实验结论为
【实验ⅳ】探究的应用
(7)将
 溶于乳酸
溶于乳酸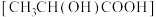 中制得可溶性的乳酸亚铁补血剂。同学乙用酸性
中制得可溶性的乳酸亚铁补血剂。同学乙用酸性 溶液测定该补血剂中亚铁含量,再计算乳酸亚铁的质量分数,发现乳酸亚铁的质量分数总是大于
溶液测定该补血剂中亚铁含量,再计算乳酸亚铁的质量分数,发现乳酸亚铁的质量分数总是大于 (操作误差略),其原因是
(操作误差略),其原因是
您最近一年使用:0次
8 . 用过量的盐酸和 溶液的混合液作为浸取剂,浸取黄铜矿(
溶液的混合液作为浸取剂,浸取黄铜矿( )的流程示意图如下。
)的流程示意图如下。
 溶液的混合液作为浸取剂,浸取黄铜矿(
溶液的混合液作为浸取剂,浸取黄铜矿( )的流程示意图如下。
)的流程示意图如下。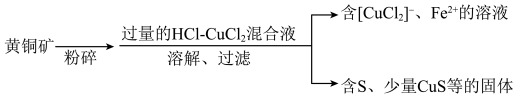
A.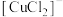 的中心离子是 的中心离子是 ,配体是 ,配体是 |
B.参与反应的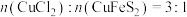 |
C.浸取剂中的 有助于 有助于 固体的溶解 固体的溶解 |
D.用浓盐酸和 溶液的混合液也可能使黄铜矿溶解 溶液的混合液也可能使黄铜矿溶解 |
您最近一年使用:0次
解题方法
9 . 下列离子方程式书写不正确 的是
A.氢氧化钠溶液与过量的碳酸氢钙溶液反应: |
B.向含溶质a mol的FeBr2溶液中通入b mol Cl2,充分反应,当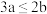 时,反应的离子方程式为: 时,反应的离子方程式为: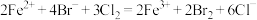 |
C.向NaHSO3溶液中滴入酸化的 溶液产生白色沉淀: 溶液产生白色沉淀: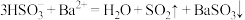 |
D.将CuCl溶于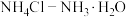 的混合液中,久置后得到深蓝色溶液: 的混合液中,久置后得到深蓝色溶液: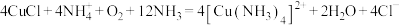 |
您最近一年使用:0次

 中
中 配位数
配位数 ,将浓度均为
,将浓度均为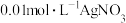 和
和 溶液按不同体积比混合,其用量和溶液浑浊度的关系如图,已知:
溶液按不同体积比混合,其用量和溶液浑浊度的关系如图,已知: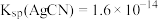 。
。

 中
中
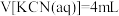 时,
时,
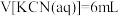 时,
时,