1 .  是一系列化合物,向含
是一系列化合物,向含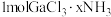 的溶液中加入足量
的溶液中加入足量 溶液,有难溶于硝酸的白色沉淀生成;过滤后,充分加热滤液,有4mol氨气逸出,且又有上述沉淀生成,两次沉淀的物质的量之比为1∶2,能准确表示
溶液,有难溶于硝酸的白色沉淀生成;过滤后,充分加热滤液,有4mol氨气逸出,且又有上述沉淀生成,两次沉淀的物质的量之比为1∶2,能准确表示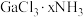 结构的化学式为
结构的化学式为_______ 。
 是一系列化合物,向含
是一系列化合物,向含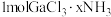 的溶液中加入足量
的溶液中加入足量 溶液,有难溶于硝酸的白色沉淀生成;过滤后,充分加热滤液,有4mol氨气逸出,且又有上述沉淀生成,两次沉淀的物质的量之比为1∶2,能准确表示
溶液,有难溶于硝酸的白色沉淀生成;过滤后,充分加热滤液,有4mol氨气逸出,且又有上述沉淀生成,两次沉淀的物质的量之比为1∶2,能准确表示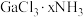 结构的化学式为
结构的化学式为
您最近一年使用:0次
2 . 冠醚是一种超分子,它能否适配碱金属离子与其空腔直径和离子直径有关,二苯并-18-冠-6与 形成的整合离子的结构如图所示。下列说法错误的是
形成的整合离子的结构如图所示。下列说法错误的是
 形成的整合离子的结构如图所示。下列说法错误的是
形成的整合离子的结构如图所示。下列说法错误的是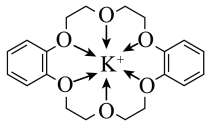
A.二苯并-18-冠-6与 形成的整合离子具有自组装的特征 形成的整合离子具有自组装的特征 |
B.二苯并-18-冠-6不能适配 |
| C.该冠醚分子中碳原子的杂化方式只有1种 |
| D.该螯合离子中存在配位键,共价键等化学键 |
您最近一年使用:0次
3 . 铜及其化合物在生产和生活中有着广泛的应用。
(1)Cu在元素周期表中的位置为______ 。
(2)基态铜原子有______ 种运动状态不同的电子。
(3)原子核外电子的两种自旋状态分别用+ 和-
和- 表示,称为电子的自旋磁量子数,基态铜原子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数,基态铜原子自旋磁量子数的代数和为______ 。
(4)Cu+比Cu2+更稳定的原因是_______ 。
Cu2+能与多种物质形成配合物,为研究配合物的形成及性质,某小组进行如表实验。
(5)步骤I中反应的离子方程式为________ ;_______ 。
(6)H-N-H键角大小:[Cu(NH3)4]2+_______ NH3(填“>”、“=”或“<”),其原因是_______ 。
(7)该实验能说明,Cu2+与NH3的结合能力_______ (填“大于”“小于”或“等于”)Cu2+与OH-的结合能力。
(8)Cu2+能与乙二胺(H2NCH2CH2NH2)形成[Cu(H2NCH2CH2NH2)2]2+离子,结构如图,关于该配离子的说法正确的是______ 。
(1)Cu在元素周期表中的位置为
(2)基态铜原子有
(3)原子核外电子的两种自旋状态分别用+
 和-
和- 表示,称为电子的自旋磁量子数,基态铜原子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数,基态铜原子自旋磁量子数的代数和为(4)Cu+比Cu2+更稳定的原因是
Cu2+能与多种物质形成配合物,为研究配合物的形成及性质,某小组进行如表实验。
| 序号 | 实验步骤 | 实验现象或结论 |
| I | 向CuSO4溶液中逐滴加入氨水至过量 | 产生蓝色沉淀,随后溶解并得到深蓝色的溶液 |
| Ⅱ | 再加入无水乙醇 | 得到深蓝色晶体 |
| Ⅲ | 测定深蓝色晶体的结构 | 晶体的化学式为[Cu(NH3)4]SO4 H2O H2O |
| Ⅳ | 将深蓝色晶体洗净后溶于水配成溶液,再加入稀NaOH溶液 | 无蓝色沉淀生成 |
(5)步骤I中反应的离子方程式为
(6)H-N-H键角大小:[Cu(NH3)4]2+
(7)该实验能说明,Cu2+与NH3的结合能力
(8)Cu2+能与乙二胺(H2NCH2CH2NH2)形成[Cu(H2NCH2CH2NH2)2]2+离子,结构如图,关于该配离子的说法正确的是
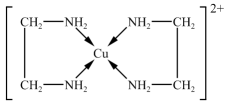
| A.该离子的配位数是4 |
| B.该离子的配体数是4 |
| C.形成配离子前后,Cu的化合价不变 |
| D.该离子中含有离子键、非极性键与极性键 |
您最近一年使用:0次
4 . 乙二胺(H2NCH2CH2NH2)能与Mg2+、Cu2+等形成稳定环状离子,其中Cu2+与乙二胺形成的化合物稳定性更高。下列说法错误的是
| A.铜的第二电离能小于锌的第二电离能 |
| B.乙二胺中2个N原子均可与Cu2+形成配位键 |
| C.Cu2+与乙二胺形成的化合物稳定性更高是因为Cu2+半径大,配体之间的斥力小 |
| D.基态Mg原子中,电子占据的最高能层具有的原子轨道为9 |
您最近一年使用:0次
名校
解题方法
5 . 二氧化碳的捕集和资源化利用是缓解温室效应的重要战略方向。
(1)CO2可用于制取纯碱。纯碱溶液呈碱性的原因是___________ (用离子方程式表示),溶液中离子浓度由大到小的顺序为___________ 。
(2)我国在二氧化碳催化加氢合成甲醇上取得了突破性进展,有关反应如下:
反应ⅰ:
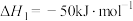
反应ⅱ:
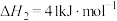
①CO(g)和H2(g)合成甲醇的热化学方程式为___________ ;该反应达平衡后,若升高温度,平衡___________ 移动。
A.正向 B.逆向
②甲醇燃料电池工作原理如下图,下列有关叙述正确的是___________ 。
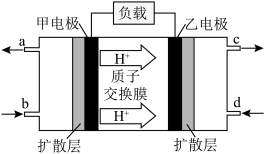
A.a导出的气体是O2
B.电池工作时,电子由甲电极经外电路流向乙电极
C.乙电极的反应式为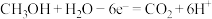
D.当外电路通过0.6 mol电子时,理论上消耗甲醇1.6 g
(3)将1 mol CO2和3 mol H2充入一恒容密闭容器中,同时发生了反应ⅰ和反应ⅱ,测得CO2的平衡转化率随温度、压强变化的情况如图所示。
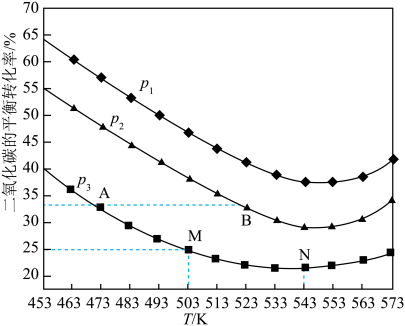
①压强p1、p2、p3由小到大的顺序为___________ 。
②A点、M点的化学反应速率大小: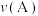
___________ 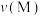 。
。
A.小于 B.等于 C.大于
③温度高于543 K时,CO2平衡转化率随温度的升高而增大的原因是___________ 。
④图中M点对应的温度下,平衡体系中CH3OH的物质的量为0.15 mol,则CO的选择性为___________ 。(CO的选择性 )。
)。
(4)CO2可合成有机试剂DMF,用含金属铱(Ir)的化合物催化,反应机理如下图(其中L表示配体)。下列说法正确的是___________。

(5)催化CO2加氢合成乙酸在减少碳排放的同时还可以生产重要的化工原料。已知电离度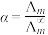 ,
, 为一定浓度下电解质的摩尔电导率,
为一定浓度下电解质的摩尔电导率,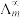 为无限稀释时溶液的摩尔电导率,
为无限稀释时溶液的摩尔电导率,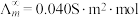 (
(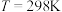 )。实验测得
)。实验测得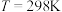 时,
时, 乙酸的
乙酸的 。该条件下测定的乙酸的电离度为
。该条件下测定的乙酸的电离度为___________ %;乙酸的电离平衡常数 为
为___________ (计算结果保留2位有效数字)。
(1)CO2可用于制取纯碱。纯碱溶液呈碱性的原因是
(2)我国在二氧化碳催化加氢合成甲醇上取得了突破性进展,有关反应如下:
反应ⅰ:

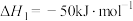
反应ⅱ:

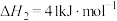
①CO(g)和H2(g)合成甲醇的热化学方程式为
A.正向 B.逆向
②甲醇燃料电池工作原理如下图,下列有关叙述正确的是

A.a导出的气体是O2
B.电池工作时,电子由甲电极经外电路流向乙电极
C.乙电极的反应式为
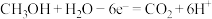
D.当外电路通过0.6 mol电子时,理论上消耗甲醇1.6 g
(3)将1 mol CO2和3 mol H2充入一恒容密闭容器中,同时发生了反应ⅰ和反应ⅱ,测得CO2的平衡转化率随温度、压强变化的情况如图所示。

①压强p1、p2、p3由小到大的顺序为
②A点、M点的化学反应速率大小:
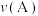
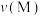 。
。A.小于 B.等于 C.大于
③温度高于543 K时,CO2平衡转化率随温度的升高而增大的原因是
④图中M点对应的温度下,平衡体系中CH3OH的物质的量为0.15 mol,则CO的选择性为
 )。
)。(4)CO2可合成有机试剂DMF,用含金属铱(Ir)的化合物催化,反应机理如下图(其中L表示配体)。下列说法正确的是___________。

| A.CO2在反应中断裂极性键 |
B.总反应方程式为H2+ +CO2 +CO2 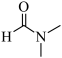 +H2O +H2O |
| C.配合物C中的配位键由Ir提供孤电子对 |
| D.最后一步生成DMF的反应类型为氧化反应 |
(5)催化CO2加氢合成乙酸在减少碳排放的同时还可以生产重要的化工原料。已知电离度
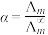 ,
, 为一定浓度下电解质的摩尔电导率,
为一定浓度下电解质的摩尔电导率,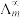 为无限稀释时溶液的摩尔电导率,
为无限稀释时溶液的摩尔电导率,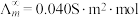 (
(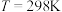 )。实验测得
)。实验测得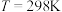 时,
时, 乙酸的
乙酸的 。该条件下测定的乙酸的电离度为
。该条件下测定的乙酸的电离度为 为
为
您最近一年使用:0次
解题方法
6 . 镍能形成多种配合物如正四面体形的 和平面正方形的
和平面正方形的 、正八面体形的
、正八面体形的 等,下列说法正确的是
等,下列说法正确的是
 和平面正方形的
和平面正方形的 、正八面体形的
、正八面体形的 等,下列说法正确的是
等,下列说法正确的是A. 中的配位原子是氧原子 中的配位原子是氧原子 |
B. 中Ni、C、N不可能处在同一直线上 中Ni、C、N不可能处在同一直线上 |
C. 中 中 键角比107.3°小 键角比107.3°小 |
D. 和 和 中均有d轨道参与杂化 中均有d轨道参与杂化 |
您最近一年使用:0次
23-24高二下·全国·课前预习
解题方法
7 . 配位化合物
(1)配合物的概念:把金属离子或原子(称为中心离子或原子)与某些分子或离子(称为配体或配位体)以_______ 结合形成的化合物称为配位化合物,简称_______ ,如[Cu(NH3)4]SO4、[Ag(NH3)2]OH、NH4Cl等。
(2)配合物的形成
上述实验现象产生的原因主要是配离子的形成,以配离子[Cu(NH3)4]2+为例,NH3分子中氮原子的_______ 进入Cu2+的空轨道,Cu2+与NH3分子中的氮原子通过共用氮原子提供的_______ 形成配位键,配离子[Cu(NH3)4]2+可表示为_______ 。
(3)配合物的组成
配合物[Cu(NH3)4]SO4其组成如图所示:

①中心原子是提供_______ 接受孤电子对的原子,中心原子一般都是带正电荷的阳离子(此时又叫中心离子),_______ 离子最常见的有Fe3+、Ag+、Cu2+、Zn2+等。
②配体是提供______ 的阴离子或分子,如Cl-、NH3、H2O等。配体中直接同中心原子配位的原子叫做配位原子。配位原子必须是含有孤电子对的原子,如NH3中的N原子,H2O中的O原子等。
③配位数是直接与中心原子形成的_______ 的数目,如[Fe(CN)6]4-中配位数为_______ 。
(1)配合物的概念:把金属离子或原子(称为中心离子或原子)与某些分子或离子(称为配体或配位体)以
(2)配合物的形成
| 实验操作 | 实验现象及有关离子方程式 |
 | 滴加氨水后,试管中首先出现 |
 | 溶液变 |
 | 白色的AgCl沉淀消失,得到澄清的无色溶液,有关化学方程式: |
(3)配合物的组成
配合物[Cu(NH3)4]SO4其组成如图所示:

①中心原子是提供
②配体是提供
③配位数是直接与中心原子形成的
您最近一年使用:0次
8 . 下列物质不属于配合物的是
A. | B. | C. | D.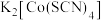 |
您最近一年使用:0次
名校
解题方法
9 . 下列方程式正确的是
A. 的电离方程式: 的电离方程式: |
B.电解饱和食盐水制氢气和氯气:2Cl-+2H+ Cl2↑+H2↑ Cl2↑+H2↑ |
C.铜丝插入热的浓硫酸中:Cu+H2SO4 CuSO4+H2↑ CuSO4+H2↑ |
D.石灰石被醋酸溶解: |
您最近一年使用:0次
2024-02-19更新
|
117次组卷
|
3卷引用:河北正定中学本部2023-2024学年高二上学期期末考试化学试题
解题方法
10 . 下列操作、现象和结论均正确的是
| 选项 | 操作 | 现象 | 结论 |
| A | 向   溶液中加入 溶液中加入   溶液,萃取分液后,向水层滴入KSCN溶液 溶液,萃取分液后,向水层滴入KSCN溶液 | 水层呈现红色 | 说明 与 与 的反应有一定限度 的反应有一定限度 |
| B | 用标准液盐酸滴定未知浓度的氨水,用酚酞作指示剂 | 滴入最后半滴标准液,指示剂变为无色,且在半分钟内不恢复 | 可测定氨水的浓度 |
| C | 室温下,用pH试纸测定浓度均为 的NaClO溶液和NaF溶液的pH 的NaClO溶液和NaF溶液的pH | NaF溶液pH小于NaClO溶液 | HF酸性强于HClO |
| D | 向盛有硫酸铜溶液的试管中滴加氨水 | 先生成难溶物,后又溶解得到深蓝色透明溶液 | 稳定性:[Cu(NH3)4]2+>Cu(OH)2 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-02-01更新
|
79次组卷
|
2卷引用:山东省德州市2023-2024学年高二上学期期末考试化学试题



