1 . 某兴趣小组探究镁跟碱性银氨溶液反应。实验步骤及现象如下。
Ⅰ.将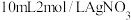 溶液和10mL6mol/L的氨水在锥形瓶中混合,测得pH=12。
溶液和10mL6mol/L的氨水在锥形瓶中混合,测得pH=12。
Ⅱ.加入1g去掉氧化层的镁条,十几秒后有许多气泡生成,用集气瓶排水集气,气体体积先增大后减小然后不变。同时锥形瓶中有灰白色沉淀生成。
Ⅲ.取出镁条过滤洗涤得到灰白色固体。
Ⅳ.取少量灰白色固体于试管中加入稀 ,沉淀全部溶解,并有无色的气体生成,且在试管口部气体变成红棕色,将其溶解后的溶液加入稀盐酸,产生大量白色沉淀。
,沉淀全部溶解,并有无色的气体生成,且在试管口部气体变成红棕色,将其溶解后的溶液加入稀盐酸,产生大量白色沉淀。
回答下列问题:
(1)步骤Ⅱ产生不溶于水的气体是________ ,易溶于水的气体是________ ,该气体使湿润的红色石蕊试纸变蓝色,生成该气体的反应的离子方程式为:________ 。
(2)步骤Ⅳ的现象证明灰白色固体一定含有________ 。证明灰白色固体中有 ,需要的试剂有稀盐酸和
,需要的试剂有稀盐酸和________ 。
(3)向水中加入1g去掉氧化层的镁条,几乎看不见气泡产生。镁跟碱性银氨溶液反应能迅速产生气泡的原因:________ 。
(4)向pH相同的氢氧化钠溶液中加入1g去掉氧化层的镁条,看不见气泡产生,其原因是:________ 。
Ⅰ.将
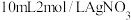 溶液和10mL6mol/L的氨水在锥形瓶中混合,测得pH=12。
溶液和10mL6mol/L的氨水在锥形瓶中混合,测得pH=12。Ⅱ.加入1g去掉氧化层的镁条,十几秒后有许多气泡生成,用集气瓶排水集气,气体体积先增大后减小然后不变。同时锥形瓶中有灰白色沉淀生成。
Ⅲ.取出镁条过滤洗涤得到灰白色固体。
Ⅳ.取少量灰白色固体于试管中加入稀
 ,沉淀全部溶解,并有无色的气体生成,且在试管口部气体变成红棕色,将其溶解后的溶液加入稀盐酸,产生大量白色沉淀。
,沉淀全部溶解,并有无色的气体生成,且在试管口部气体变成红棕色,将其溶解后的溶液加入稀盐酸,产生大量白色沉淀。回答下列问题:
(1)步骤Ⅱ产生不溶于水的气体是
(2)步骤Ⅳ的现象证明灰白色固体一定含有
 ,需要的试剂有稀盐酸和
,需要的试剂有稀盐酸和(3)向水中加入1g去掉氧化层的镁条,几乎看不见气泡产生。镁跟碱性银氨溶液反应能迅速产生气泡的原因:
(4)向pH相同的氢氧化钠溶液中加入1g去掉氧化层的镁条,看不见气泡产生,其原因是:
您最近一年使用:0次
2024-04-04更新
|
226次组卷
|
2卷引用:湖北省2024届高三十一校第二次联考化学试题
解题方法
2 . 下列操作、现象和结论均正确的是
| 选项 | 操作 | 现象 | 结论 |
| A | 向   溶液中加入 溶液中加入   溶液,萃取分液后,向水层滴入KSCN溶液 溶液,萃取分液后,向水层滴入KSCN溶液 | 水层呈现红色 | 说明 与 与 的反应有一定限度 的反应有一定限度 |
| B | 用标准液盐酸滴定未知浓度的氨水,用酚酞作指示剂 | 滴入最后半滴标准液,指示剂变为无色,且在半分钟内不恢复 | 可测定氨水的浓度 |
| C | 室温下,用pH试纸测定浓度均为 的NaClO溶液和NaF溶液的pH 的NaClO溶液和NaF溶液的pH | NaF溶液pH小于NaClO溶液 | HF酸性强于HClO |
| D | 向盛有硫酸铜溶液的试管中滴加氨水 | 先生成难溶物,后又溶解得到深蓝色透明溶液 | 稳定性:[Cu(NH3)4]2+>Cu(OH)2 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-02-01更新
|
83次组卷
|
2卷引用:山东省德州市2023-2024学年高二上学期期末考试化学试题
名校
3 . 某实验小组为探究 配合物的性质,进行如下实验:
配合物的性质,进行如下实验: 为浅紫色,
为浅紫色,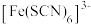 为红色,
为红色,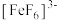 为无色。
为无色。
下列说法正确的是
 配合物的性质,进行如下实验:
配合物的性质,进行如下实验:
 为浅紫色,
为浅紫色,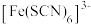 为红色,
为红色,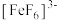 为无色。
为无色。下列说法正确的是
A. 与 与 形成配位键时, 形成配位键时, 提供孤电子对 提供孤电子对 |
B. 和 和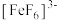 中共价键数目之比为 中共价键数目之比为 |
C.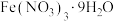 溶于水后溶液呈黄色而不是浅紫色,是因为 溶于水后溶液呈黄色而不是浅紫色,是因为 转化成了 转化成了 沉淀 沉淀 |
D.上述实验说明 与 与 配位键强度弱于 配位键强度弱于 与 与 配位键强度 配位键强度 |
您最近一年使用:0次
2024-01-09更新
|
617次组卷
|
4卷引用:湖南省株洲市2023-2024学年高三上学期教学质量统一检测化学试卷
湖南省株洲市2023-2024学年高三上学期教学质量统一检测化学试卷湖南省株洲市2024届高三上学期教学质量统一检测化学试题(已下线)专题04 物质结构与性质 元素推断-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)贵州省贵阳市第一中学2023-2024学年高二下学期期中考试化学试题
名校
解题方法
4 . 下列实验操作、现象和涉及的离子方程式均正确的是
选项 | 操作 | 现象 | 离子方程式 |
A | 向明矾溶液中加入过量氨水 | 最后得无色溶液 |  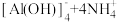 |
B | 将少量 通入到 通入到 溶液中 溶液中 | 产生白色沉淀 | 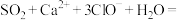  |
C | 向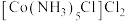 溶液中加入少量 溶液中加入少量 溶液 溶液 | 产生白色沉淀 | 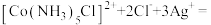 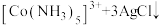 |
D | 向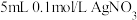 溶液中滴加5滴 溶液中滴加5滴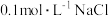 溶液,然后再滴加5滴 溶液,然后再滴加5滴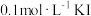 溶液 溶液 | 先产生白色沉淀,后变成黄色沉淀 |  |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-01-09更新
|
718次组卷
|
4卷引用:湖南省株洲市2023-2024学年高三上学期教学质量统一检测化学试卷
湖南省株洲市2023-2024学年高三上学期教学质量统一检测化学试卷湖南省株洲市2024届高三上学期教学质量统一检测化学试题(已下线)专题03 化学实验基础-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)2024届吉林省通化市梅河口市第五中学高三下学期一模化学试题
名校
5 . 将 与过量氨水、氯化铵、双氧水混合发生反应,可生成
与过量氨水、氯化铵、双氧水混合发生反应,可生成 或
或 。下列说法正确的是
。下列说法正确的是
 与过量氨水、氯化铵、双氧水混合发生反应,可生成
与过量氨水、氯化铵、双氧水混合发生反应,可生成 或
或 。下列说法正确的是
。下列说法正确的是A.沸点: |
B. 的配位数:5 的配位数:5 |
C. 的VSEPR模型为四面体,分子构型也为四面体 的VSEPR模型为四面体,分子构型也为四面体 |
D.等物质的量的 和 和 分别与足量 分别与足量 溶液反应生成沉淀的物质的量相等 溶液反应生成沉淀的物质的量相等 |
您最近一年使用:0次
名校
解题方法
6 . 下列离子方程式与所给事实不相符的是
A.用K3[Fe(CN)6]检验FeSO4中的Fe2+离子: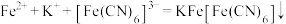 |
B.一元弱酸次磷酸(H3PO2)与足量的KOH溶液反应: |
C.向ZnS白色悬浊液中滴入CuSO4溶液生成黑色CuS沉淀: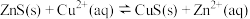 |
D.向明矾[KAl(SO4)2]溶液中滴加Ba(OH)2溶液,恰好使 沉淀完全: 沉淀完全: |
您最近一年使用:0次
2023-12-31更新
|
498次组卷
|
3卷引用:河北省石家庄市部分重点高中2023-2024学年高三上学期12月期末化学试题
2024高三·全国·专题练习
7 . 闭环循环有利于提高资源利用率和实现绿色化学的目标。利用氨法浸取可实现废弃物铜包钢的有效分离,同时得到的 可用于催化、医药、冶金等重要领域。工艺流程如下:
可用于催化、医药、冶金等重要领域。工艺流程如下: 。
。
回答下列问题:
(1)首次浸取所用深蓝色溶液①由铜毛丝、足量液氨、空气和盐酸反应得到,其主要成分为_______ (填化学式)。
(2)滤渣的主要成分为_______ (填化学式)。
(3)浸取工序的产物为 ,该工序发生反应的化学方程式为
,该工序发生反应的化学方程式为_______ 。浸取后滤液的一半经氧化工序可得深蓝色溶液①,氧化工序发生反应的离子方程式为_______ 。
(4)浸取工序宜在 之间进行,当环境温度较低时,浸取液再生后不需额外加热即可进行浸取的原因是
之间进行,当环境温度较低时,浸取液再生后不需额外加热即可进行浸取的原因是_______ 。
(5)补全中和工序中主反应的离子方程式
_______ +_______ 。
(6)真空干燥的目的为_______ 。
 可用于催化、医药、冶金等重要领域。工艺流程如下:
可用于催化、医药、冶金等重要领域。工艺流程如下: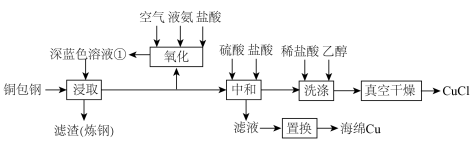
 。
。回答下列问题:
(1)首次浸取所用深蓝色溶液①由铜毛丝、足量液氨、空气和盐酸反应得到,其主要成分为
(2)滤渣的主要成分为
(3)浸取工序的产物为
 ,该工序发生反应的化学方程式为
,该工序发生反应的化学方程式为(4)浸取工序宜在
 之间进行,当环境温度较低时,浸取液再生后不需额外加热即可进行浸取的原因是
之间进行,当环境温度较低时,浸取液再生后不需额外加热即可进行浸取的原因是(5)补全中和工序中主反应的离子方程式

(6)真空干燥的目的为
您最近一年使用:0次
2023-11-29更新
|
3903次组卷
|
4卷引用:2023年河北省高考化学试卷
2023年河北省高考化学试卷(已下线)题型06 化工微流程-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)北京市首都师范大学附属中学2023-2024学年高三下学期开学练习化学试题(已下线)T16-工业流程题
名校
解题方法
8 . 乙酰丙酮是“一种有酯气味的无色透明液体,常用作溶剂、有机合成中间体、金属络合剂等。它有两种主要互变异构体A、B,与Be2+、Mg2+、Cu2+、Zn2+等形成配合物C.回答下列有关问题:

(1)基态Cu2+的价电子排布式为_______ ,Be和Mg第一电离能较大的是_______ 原子。
(2)A中C原子杂化轨道类型为_______ ;按VSEPR理论预测B中∠HCC约为_______ 、_______ (填角度);B在碱性条件下断裂极性最大的键是_______ ,具有分子内氢键的是_______ (填“A”或“B”)。
(3)C中σ键与π键数目之比为_______ 。
(4)乙酰丙酮易溶于醇、氯仿、丙酮等多数有机溶剂,理由是_______ 。
(5)Cu2+处于[Cu(NH3)4]2+的中心,若将配离子[Cu(NH3)4]2+中的2个NH3换为CN-,则有2种结构,则Cu2+是否为sp3杂化_______ (填“是”或“否”),理由为_______ 。
(6)金属铜的某些参数如下:
根据上述数据,计算Cu的原子半径为_______ pm(列出计算表达式,设NA是阿伏加德罗常数的值)。

(1)基态Cu2+的价电子排布式为
(2)A中C原子杂化轨道类型为
(3)C中σ键与π键数目之比为
(4)乙酰丙酮易溶于醇、氯仿、丙酮等多数有机溶剂,理由是
(5)Cu2+处于[Cu(NH3)4]2+的中心,若将配离子[Cu(NH3)4]2+中的2个NH3换为CN-,则有2种结构,则Cu2+是否为sp3杂化
(6)金属铜的某些参数如下:
| 金属 | 堆积类型 | 密度/(g·cm-3) | 相对原子质量 |
| Cu | 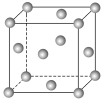 | ρ | 64 |
您最近一年使用:0次
解题方法
9 . 微颗粒的氧化锌作为一种纳米材料开始在相关领域发挥作用,利用锌焙砂 主要成分为
主要成分为 ,含
,含 及铅、铜、镉的氧化物
及铅、铜、镉的氧化物 生产高纯氧化锌的工业流程如图所示,回答下列问题:
生产高纯氧化锌的工业流程如图所示,回答下列问题:

已知: 微溶于水而生成亚砷酸
微溶于水而生成亚砷酸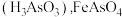 和
和 难溶于水。
难溶于水。
(1)基态 原子核外价层电子轨道表达式为
原子核外价层电子轨道表达式为______ , 中
中 的化合价为
的化合价为______ 。
(2)“浸出”过程中 足量,则生成的主要配离子的化学式为
足量,则生成的主要配离子的化学式为______ ;增大浸出率可采取的措施是______  写出两条
写出两条 。
。
(3)“除砷”过程中, 作氧化剂
作氧化剂 溶液呈酸性
溶液呈酸性 ,发生反应的离子方程式为
,发生反应的离子方程式为______ 。
(4)“除重金属”过程中加入 后
后 在溶液中的残留浓度为
在溶液中的残留浓度为 ,此时
,此时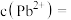
______ 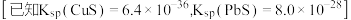 。
。
(5)“沉锌”前锌元素以 存在,写出“沉锌”的化学方程式
存在,写出“沉锌”的化学方程式______ 。
(6)流程中可循环利用的物质有 、
、______ 、______  填化学式
填化学式 。
。
 主要成分为
主要成分为 ,含
,含 及铅、铜、镉的氧化物
及铅、铜、镉的氧化物 生产高纯氧化锌的工业流程如图所示,回答下列问题:
生产高纯氧化锌的工业流程如图所示,回答下列问题:
已知:
 微溶于水而生成亚砷酸
微溶于水而生成亚砷酸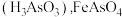 和
和 难溶于水。
难溶于水。(1)基态
 原子核外价层电子轨道表达式为
原子核外价层电子轨道表达式为 中
中 的化合价为
的化合价为(2)“浸出”过程中
 足量,则生成的主要配离子的化学式为
足量,则生成的主要配离子的化学式为 写出两条
写出两条 。
。(3)“除砷”过程中,
 作氧化剂
作氧化剂 溶液呈酸性
溶液呈酸性 ,发生反应的离子方程式为
,发生反应的离子方程式为(4)“除重金属”过程中加入
 后
后 在溶液中的残留浓度为
在溶液中的残留浓度为 ,此时
,此时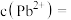
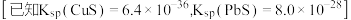 。
。(5)“沉锌”前锌元素以
 存在,写出“沉锌”的化学方程式
存在,写出“沉锌”的化学方程式(6)流程中可循环利用的物质有
 、
、 填化学式
填化学式 。
。
您最近一年使用:0次
10 . 铁氰化钾 是一种络合物,易溶于水,水溶液带有黄绿色,常用于检验
是一种络合物,易溶于水,水溶液带有黄绿色,常用于检验 。某小组拟设计实验制备铁氰化钾并探究其性质。
。某小组拟设计实验制备铁氰化钾并探究其性质。
实验(一)制备铁氰化钾。以亚铁氰化钾为原料采用氧化法制备铁氰化钾,装置如图所示。
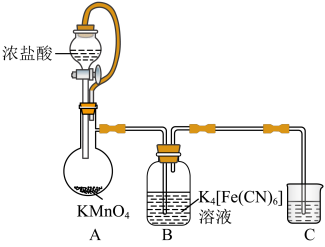
(1)装置A中橡胶管的作用是___________ 。装置C中试剂可能是___________ 。
(2)装置B中化学方程式为___________ 。
(3)从装置B中分离产品,可采用___________ 、降温结晶、___________ 、洗涤、干燥一系列操作。
实验(二)探究 性质。
性质。
【资料显示】
配合物在水中能完全电离出外界和内界,例如: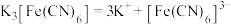 。
。
【提出问题】
 能否电离?
能否电离?
【提出猜想】
猜想1:不能电离;猜想2:能部分电离(存在电离平衡);猜想3:___________。
【设计实验】
(4)猜想3的横线上应填___________ ,综合上述实验分析,可知:猜想___________ 成立。
(5)用方程式和必要的文字分析实验②现象:___________ ,写出产生蓝色沉淀的离子方程式:___________ 。
 是一种络合物,易溶于水,水溶液带有黄绿色,常用于检验
是一种络合物,易溶于水,水溶液带有黄绿色,常用于检验 。某小组拟设计实验制备铁氰化钾并探究其性质。
。某小组拟设计实验制备铁氰化钾并探究其性质。实验(一)制备铁氰化钾。以亚铁氰化钾为原料采用氧化法制备铁氰化钾,装置如图所示。

(1)装置A中橡胶管的作用是
(2)装置B中化学方程式为
(3)从装置B中分离产品,可采用
实验(二)探究
 性质。
性质。【资料显示】
配合物在水中能完全电离出外界和内界,例如:
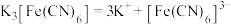 。
。【提出问题】
 能否电离?
能否电离?【提出猜想】
猜想1:不能电离;猜想2:能部分电离(存在电离平衡);猜想3:___________。
【设计实验】
| 实验 | 实验操作及现象 |
| ① | 向浓度均为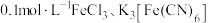 的混合溶液中插入一根无锈铁丝,立即产生蓝色沉淀 的混合溶液中插入一根无锈铁丝,立即产生蓝色沉淀 |
| ② | 向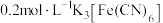 溶液插入一根无锈铁丝(与①相同),一段时间后,溶液产生蓝色 溶液插入一根无锈铁丝(与①相同),一段时间后,溶液产生蓝色 |
(4)猜想3的横线上应填
(5)用方程式和必要的文字分析实验②现象:
您最近一年使用:0次



