名校
1 . VA族的氮、磷、砷(As)等元素的化合物在科研和生产中有许多重要用途,请回答下列问题。
(1)砷的基态原子的电子排布式为___________________ 。
(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,N、P、As原子的第一电离能由大到小的顺序为______________ 。
(3)NH3的沸点比PH3高,原因是___________ ;PO43-离子的立体构型为___________ 。
(4)AsH3是无色稍有大蒜气味的气体,在AsH3中As原子的杂化轨道类型为______________ 。
(5)H3AsO4和H3AsO3是砷的两种含氧酸,请根据结构与性质的关系,解释H3AsO4比H3AsO3 酸性强的原因_____________________ 。
(6)磷的一种单质白磷(P4)属于分子晶体,其晶胞结构如下图。已知最近两个白磷分子间的距离为 a pm(1pm=10-12m),阿伏伽德罗常数的值为NA,则该晶体的密度为__________________ g/cm3(只要求列算式,不必计算)。
(1)砷的基态原子的电子排布式为
(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,N、P、As原子的第一电离能由大到小的顺序为
(3)NH3的沸点比PH3高,原因是
(4)AsH3是无色稍有大蒜气味的气体,在AsH3中As原子的杂化轨道类型为
(5)H3AsO4和H3AsO3是砷的两种含氧酸,请根据结构与性质的关系,解释H3AsO4比H3AsO3 酸性强的原因
(6)磷的一种单质白磷(P4)属于分子晶体,其晶胞结构如下图。已知最近两个白磷分子间的距离为 a pm(1pm=10-12m),阿伏伽德罗常数的值为NA,则该晶体的密度为

您最近一年使用:0次
2019-01-19更新
|
611次组卷
|
2卷引用:【全国百强校】西藏自治区拉萨中学2019届高三上学期第五次月考理科综合化学试题
2 . A、B、C、D、E、F六种元素均位于周期表的前四周期,且原子序数依次增大。元素A是原子半径最小的元素;B元素基态原子的核外电子分占四个原子轨道(能级);D元素原子的已成对电子总数是未成对电子总数的3倍;E与D处于同一主族;F位于ds区,且原子的最外层只有1个电子。
(1)E+离子的电子排布式是_____________ 。
(2)B、C、D元素的第一电离能由大到小的顺序是_________________ 。
(3)B、C元素的某些氢化物的分子中均含有18个电子,则B的这种氢化物的化学式是___________ ;B、C的这些氢化物的沸点相差较大的主要原因是______________ 。
(4)A、B、D可形成分子式为A2BD的某化合物,则该化合物分子中B原子的轨道杂化类型是_____________ ;1 mol该分子中含有π键的数目是___________ 。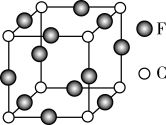
(5)C、F两元素形成的某化合物的晶胞结构如图所示,则该化合物的化学式是_______________ ,C原子的配位数是______________ 。
(1)E+离子的电子排布式是
(2)B、C、D元素的第一电离能由大到小的顺序是
(3)B、C元素的某些氢化物的分子中均含有18个电子,则B的这种氢化物的化学式是
(4)A、B、D可形成分子式为A2BD的某化合物,则该化合物分子中B原子的轨道杂化类型是

(5)C、F两元素形成的某化合物的晶胞结构如图所示,则该化合物的化学式是
您最近一年使用:0次
2017-02-17更新
|
486次组卷
|
2卷引用:2017届西藏拉萨中学高三上期末理综化学卷



