解题方法
1 . I.氮及其化合物与人类生产、生活息息相关。回答下列问题:
(1)固氮酶有铁蛋白和钒铁蛋白两种,它们不仅能够催化N2还原成NH3,还能将环境底物乙炔催化还原成乙烯。
①V2+基态时核外电子排布式为_______ 。
②C、N、O三种元素第一电离能从大到小的顺序是_______ 。
③下列说法正确的有_______ 。
A.C2H2、C2H4都是非极性分子 B.碳负离子 呈三角锥形
呈三角锥形
C.NO+电子式为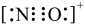 D.NH3沸点比N2高,主要是因为前者是极性分子
D.NH3沸点比N2高,主要是因为前者是极性分子
(2)NaN3可用于汽车安全气囊。写出两种与 互为等电子体的分子或离子
互为等电子体的分子或离子_______ 。
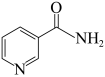
(3)烟酰胺是一种含氮有机物,结构简式如图所示,烟酰胺分子中氮原子的杂化轨道类型有_______ ,1mol该分子中含σ键的数目为_______ 。
Ⅱ.氯化钠是生活中的常用调味品,也是结构化学中研究离子晶体时常用的代表物,其晶胞结构如图所示。

(4)已知在氯化钠晶体中Na+的半径为a pm,Cl-的半径为b pm,它们在晶体中是紧密接触的,则在氯化钠晶体中的空间利用率为_______ (用含a、b的式子表示)。
(5)纳米材料的表面原子占总原子数的比例很大,这是它有许多特殊性质的原因。假设某氯化钠颗粒形状为立方体,边长为氯化钠晶胞的10倍,则该氯化钠颗粒中表面原子占总原子数的百分比为_______ 。
(1)固氮酶有铁蛋白和钒铁蛋白两种,它们不仅能够催化N2还原成NH3,还能将环境底物乙炔催化还原成乙烯。
①V2+基态时核外电子排布式为
②C、N、O三种元素第一电离能从大到小的顺序是
③下列说法正确的有
A.C2H2、C2H4都是非极性分子 B.碳负离子
 呈三角锥形
呈三角锥形C.NO+电子式为
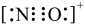 D.NH3沸点比N2高,主要是因为前者是极性分子
D.NH3沸点比N2高,主要是因为前者是极性分子(2)NaN3可用于汽车安全气囊。写出两种与
 互为等电子体的分子或离子
互为等电子体的分子或离子(3)烟酰胺是一种含氮有机物,结构简式如图所示,烟酰胺分子中氮原子的杂化轨道类型有

Ⅱ.氯化钠是生活中的常用调味品,也是结构化学中研究离子晶体时常用的代表物,其晶胞结构如图所示。

(4)已知在氯化钠晶体中Na+的半径为a pm,Cl-的半径为b pm,它们在晶体中是紧密接触的,则在氯化钠晶体中的空间利用率为
(5)纳米材料的表面原子占总原子数的比例很大,这是它有许多特殊性质的原因。假设某氯化钠颗粒形状为立方体,边长为氯化钠晶胞的10倍,则该氯化钠颗粒中表面原子占总原子数的百分比为
您最近半年使用:0次
解题方法
2 . 根据题意回答下列问题
(1)利用价层电子对互斥理论预测分子的构型或VSEPR模型
① 的分子的构型
的分子的构型___________ ;
② 模型
模型___________ 。
(2)水的沸点比氨气___________ (填“低”或“高”),原因是___________ 。
(3)当0原子的价层电子排布为 该电子排布图违背了
该电子排布图违背了___________ ;当P原子的价电子排布式由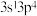 转变为
转变为 时,产生
时,产生___________ 光谱。
(4)硫酸亚铁不稳定在空气放置一段时间后生成硫酸铁,铁离子稳定的原因___________ 。
(1)利用价层电子对互斥理论预测分子的构型或VSEPR模型
①
 的分子的构型
的分子的构型②
 模型
模型(2)水的沸点比氨气
(3)当0原子的价层电子排布为
 该电子排布图违背了
该电子排布图违背了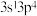 转变为
转变为 时,产生
时,产生(4)硫酸亚铁不稳定在空气放置一段时间后生成硫酸铁,铁离子稳定的原因
您最近半年使用:0次
3 . 下列有机物中,沸点最高的是
| A.乙烷 | B.甲醇 | C.乙醇 | D.乙二醇 |
您最近半年使用:0次
名校
4 . 下列说法错误的是
| A.乙烷室温下能与浓盐酸发生取代反应 |
| B.乙烯可以用作生产食品包装材料—聚乙烯的原料 |
| C.乙醇室温下在水中的溶解度大于溴乙烷 |
| D.交通警察检查司机是否醉驾时,利用了乙醇可以被酸性重铬酸钾直接氧化成乙酸的化学性质。 |
您最近半年使用:0次
5 . PH3是一种无色剧毒气体,其分子结构和NH3相似,但P-H键键能比N-H键键能低。下列判断错误的是
| A.PH3分子呈三角锥形 |
| B.PH3分子是极性分子 |
| C.PH3沸点低于NH3沸点,因为P-H键键能低 |
| D.PH3分子稳定性低于NH3分子,因为N-H键键能高 |
您最近半年使用:0次
2021-04-21更新
|
2162次组卷
|
44卷引用:西藏拉萨市八校2018-2019学年高二下学期期末联考化学试题
西藏拉萨市八校2018-2019学年高二下学期期末联考化学试题(已下线)2011-2012学年云南省玉溪一中高二下学期期末考试化学试卷(已下线)2012-2013学年福建省师大附中高二下学期期末考试化学试卷(已下线)2014高考化学名师知识点精编 选修3物质结构与性质练习卷2014-2015黑龙江省哈尔滨六中高二上期末化学试卷2014-2015学年浙江省台州中学高二下第一次统练化学试卷2015-2016学年湖北沙市中学高二下第一次半月考化学试卷2015-2016学年山西省太原五中高二下3月周练化学试卷2015-2016学年山西大学附中高二5月模块诊断化学试卷2015-2016学年贵州省思南中学高二下学期期末化学卷河北省蠡县中学2016-2017学年高二6月月考化学试题河北省廊坊市第一中学2016-2017学年高二下学期6月月考化学试题福建省莆田第六中学2017-2018学年高二6月月考化学试题B贵州省织金县一中2018-2019学年高二上学期12月份考试化学试题【全国百强校】新疆维吾尔自治区兵团第二师华山中学2018-2019学年高二下学期第一次调研化学试题【全国百强校】湖北省沙市中学2018-2019学年高二下学期期中考试化学试题新疆维吾尔自治区北京大学附属中学新疆分校2018-2019学年高二下学期期中考试化学试题河北省邢台市第二中学2018-2019学年高二下学期第四次月考化学试题上海市同济中学2016届高三上学期期中考试化学试题2020届高考化学二轮复习物质结构与性质专题练习云南省元阳县第三中学2019-2020学年高二上学期期末考试化学试题天津市静海区第一中学2020届高三3月统练化学试题2012年上海市高考化学试题上海市封浜高级中学2014-2015学年高三上学期期中考试化学试题山西省运城市永济涑北中学2019-2020学年高二下学期3月月考化学试题第2章 化学键与分子间作用力 易错疑难集训(三)——A学习区 夯实基础(鲁科版选修3)河北省新乐市第一中学2018--2019学年高二下学期第二次月考化学试题湖北省利川市第五中学2019年-2020学年高二下学期期末考试化学试题甘肃省兰州市第一中学2020-2021学年高二下学期4月月考化学试题黑龙江省哈尔滨市阿城区龙涤中学2020-2021学年高二4月月考化学试题湖北省十堰市2021届高三下学期4月调研考试化学试题宁夏青铜峡市高级中学2020-2021学年高二下学期期中考试化学试题福建省连城一中2020-2021学年高二下学期第二次月考化学试题(已下线)第十二章能力提升检测卷(精练)-2022年一轮复习讲练测上海市上海中学2016—2017学年高一上学期期末考试化学试题2021年海南高考化学试题变式题1-10广东省江门市新会陈经纶中学2021-2022学年高二下学期期中考试化学试题上海市南洋模范中学2022届高三等级考模拟训练七化学试题新疆精河县高级中学2021-2022学年高二下学期期中考试化学试题河南省鄢陵县第一高级中学2021-2022学年高二下学期第三次考试化学试题(已下线)【知识图鉴】单元讲练测选择性必修2第二章02练基础山东省平邑县第一中学2022-2023学年高二下学期第一次月考化学试题广东省江门市开平市第二中学2021-2022学年高二下学期第7次段考化学试题广东省深圳市观澜中学2022-2023学年高二下学期月考(物质结构)化学试题
6 . 已知A,B,C,D,E是元素周期表中1~36号元素,其原子序数依次增大,且A,B,C,D为主族元素.A与另外四种元素既不在同一周期,也不在同一主族.B和C同主族,D和E同周期;元素E是周期表中的第7列元素,D的最外层电子数与最内层电子数相同,D跟B可形成离子化合物,其晶胞结构(其中B原子在晶胞内部)如图。
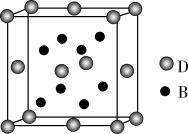
请回答下列问题:
(1)C-的电子排布式为___ ;E元素原子的价电子排布式为___ 。
(2)元素B与氮元素可以形成化合物NB3,其中N﹣B键的化学键类型为___ ,根据价层电子对互斥理论可以判断NB3的空间构型为___ ,NB3分子中N原子的杂化方式为杂化___ 。
(3)A,B形成的化合物AB的相对分子质量比A,C形成的化合物AC的相对分子质量小,但AB的沸点比AC高,其原因是___ 。
(4)从晶胞图可以得出:D与B形成的离子化合物的化学式为___ 。
(5)含有D元素的化合物焰色反应为___ 色。

请回答下列问题:
(1)C-的电子排布式为
(2)元素B与氮元素可以形成化合物NB3,其中N﹣B键的化学键类型为
(3)A,B形成的化合物AB的相对分子质量比A,C形成的化合物AC的相对分子质量小,但AB的沸点比AC高,其原因是
(4)从晶胞图可以得出:D与B形成的离子化合物的化学式为
(5)含有D元素的化合物焰色反应为
您最近半年使用:0次
7 . 国家卫健委公布的新型冠状病毒肺炎诊疗方案指出,乙醚、75%乙醇、含氯消毒剂、过氧乙酸(CH3COOOH)、氯仿等均可有效灭活病毒。对于上述化学药品,下列说法错误的是
| A.CH3CH2OH能与水互溶 |
| B.NaClO通过氧化灭活病毒 |
| C.过氧乙酸相对分子质量为76 |
| D.氯仿的化学名称是四氯化碳 |
您最近半年使用:0次
2020-07-08更新
|
19480次组卷
|
65卷引用:西藏自治区拉萨那曲第二高级中学2020-2021学年高二下学期期末考试化学试题
西藏自治区拉萨那曲第二高级中学2020-2021学年高二下学期期末考试化学试题2020年全国统一考试化学试题(新课标Ⅰ)贵州省铜仁市伟才学校2019-2020学年高一下学期期末考试化学(理)试题甘肃省会宁县第四中学2019-2020学年高二下学期期末考试化学试题(已下线)专题12 有机化合物-2020年高考真题和模拟题化学分项汇编江苏省扬州市扬州中学2021届高三开学检测化学试题辽宁省大连市辽宁师范大学附属中学2019-2020学年高一下学期期末考试化学试题河南省三门峡市第一高级中学2021届高三8月开学考试化学试题(已下线)小题必刷18 氯及其化合物——2021年高考化学一轮复习小题必刷(通用版)山东省泰安市第一实验学校2021届高三10月月考化学试题上海市七宝中学2021届高三上学期期中考试化学试题(已下线)热点1 化学与STSE-2021年高考化学专练【热点·重点·难点】江西省南昌市新建区第二中学2019-2020学年高二下学期期终考试化学试题(已下线)热点1 化学与STSE-2021年高考化学【热点·重点·难点】专练(山东专用)黑龙江省哈尔滨市第三十二中学2021届高三上学期期末考试化学试题 人教版2019必修第二册 第七章 第三~四节综合拔高练(已下线)专题09 常见有机物及其应用——备战2021年高考化学纠错笔记(已下线)小题02 化学与社会生产生活环境(STSE)——备战2021年高考化学经典小题考前必刷(全国通用)上海市行知中学2021届高三下学期3月月考化学试题(已下线)【苏州新东方】2020年10月江苏省苏州市高新区第一中学高二化学独立作业新疆乌鲁木齐市第八中学2020-2021学年高一下学期第一阶段考试化学试题(已下线)押全国卷理综第7题 化学与社会生产生活-备战2021年高考化学临考题号押题(课标全国卷)吉林省长春外国语学校2020-2021学年高一下学期期中考试化学(理科)试题河南省安阳市洹北中学2020-2021学年高二下学期第一次月考化学试题贵州省遵义市务川县汇佳中学2020-2021学年高二下学期第三次月考化学试题(苏教版2019)必修第二册专题8 有机化合物的获得与应用 C 高考挑战区山西省太原市2020-2021学年高一下学期期末考试化学试题内蒙古巴彦淖尔市乌拉特前旗第一中学2020-2021学年高二下学期期末考试化学试题(已下线)课时01 化学与生产、生活和环境-2022年高考化学一轮复习小题多维练(全国通用)内蒙古集宁新世纪中学2020-2021学年高二下学期期末考试化学试题(已下线)考向11 氯及其化合物-备战2022年高考化学一轮复习考点微专题吉林省抚松县泉阳镇抚松县第六中学2021-2022学年高二上学期化学与生活知识竞赛化学试题吉林省吉林市第二中学2020-2021学年高二下学期期中考试化学试卷江苏省常州市武进区礼嘉中学2021-2022学年高二上学期第一阶段教学质量调研化学试卷题(已下线)专题讲座(七) STSE与 化学可持续发展(讲) — 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)考向30 烃的含氧衍生物-备战2022年高考化学一轮复习考点微专题(已下线)专题01 化学与STSE—2022年高考化学二轮复习讲练测-练习陕西省渭滨中学2021-2022学年高一上学期期中考试化学试题2020年全国卷Ⅰ理综化学高考真题变式题云南省峨山彝族自治县第一中学2021-2022学年高二上学期12月月考化学试题吉林省长春市实验中学2021-2022学年高二下学期4月月考化学试题(已下线)押全国卷理综第7题 化学与社会生产生活及传统文化-备战2022年高考化学临考题号押题(课标全国卷)(已下线)回归教材重难点01 化学与STSE与传统文化-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)查补易混易错点01 物质的组成、性质、分类及化学用语-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)专题01STSE化学用语-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题01STSE化学用语-五年(2018~2022)高考真题汇编(全国卷)(已下线)第01练 化学与科技社会生产生活、传统文化-2022年【暑假分层作业】高二化学(2023届一轮复习通用)山东省菏泽市鄄城县第一中学2021-2022学年高二下学期第二次月考化学试题黑龙江省双鸭山市集贤县一中、四中等2021-2022学年高二下学期期末考试化学试题专题4 生活中常用的有机物——烃的含氧衍生物 第一~二单元综合拔高练青海省西宁市七校2021-2022年高二下学期期末联考化学试题广东省揭阳华侨高级中学2021-2022学年高三上学期第三次阶段考试化学试题四川省邻水实验学校2021-2022学年高二下学期第二次月考理综化学试题云南省富源县第一中学2021-2022学年高二下学期3月月考化学试题黑龙江省双鸭山市饶河县高级中学2021-2022学年高二下学期期中考试化学试题(已下线)专题01 物质的组成与分类 传统文化-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第一部分 二轮专题突破 专题19 有机选择题题型分析(已下线)题型47 新型消毒剂的制备及用途江苏省苏州市苏州高新区第一中学2022-2023学年高一下学期5月月考化学试题4.1.1醇的性质和应用 课中广东省肇庆市第一中学2020--2021学年高二下学期期中考试化学试题河南省南阳市第一中学校2022-2023学年高二下学期4月月考化学试题(已下线)实验05 探究氯气的性质-【同步实验课】2023-2024学年高一化学教材实验大盘点(人教版2019必修第一册)云南省开远市第一中学校2023-2024学年高二上学期10月月考化学试题宁夏石嘴山市平罗中学2023-2024学年高二上学期第三次月考化学试题
名校
解题方法
8 . 数依次增大的四种元素A、B、C、D分别处于第一至第四周期,自然界中存在多种A的化合物,B原子核外电子有6种不同的运动状态,B与C可形成正四面体形分子,D的基态原子的最外能层只有一个电子,其他能层均已充满电子。请回答下列问题:
(1)这四种元素中电负性最大的元素,其基态原子的价电子排布图为___________________ ,第一电离能最小的元素是__________ (填元素符号)。
(2)C所在主族的前四种元素分别与A形成的化合物,沸点由高到低的顺序是___________ (填化学式)。
(3)B元素可形成多种单质,一种晶体结构如图一所示,其原子的杂化类型为__________ ;另一种的晶胞如图二所示,该晶胞的空间利用率为__________ 。( =1.732)
=1.732)

(4)D元素形成的单质,其晶体的堆积模型为__________ ,D的醋酸盐晶体局部结构如图三,该晶体中含有的化学键是__________ (填选项序号)。
①极性键 ②非极性键 ③配位键 ④金属键
(5)向D的硫酸盐溶液中滴加过量氨水,观察到的现象是______________________________ 。
请写出上述过程的离子方程式:___________________________ ,__________________________ 。
(1)这四种元素中电负性最大的元素,其基态原子的价电子排布图为
(2)C所在主族的前四种元素分别与A形成的化合物,沸点由高到低的顺序是
(3)B元素可形成多种单质,一种晶体结构如图一所示,其原子的杂化类型为
 =1.732)
=1.732)
(4)D元素形成的单质,其晶体的堆积模型为
①极性键 ②非极性键 ③配位键 ④金属键
(5)向D的硫酸盐溶液中滴加过量氨水,观察到的现象是
请写出上述过程的离子方程式:
您最近半年使用:0次
2019-04-09更新
|
135次组卷
|
3卷引用:西藏自治区拉萨市那曲第二高级中学2020届高三全真模拟联考理综化学试题
名校
9 . VA族的氮、磷、砷(As)等元素的化合物在科研和生产中有许多重要用途,请回答下列问题。
(1)砷的基态原子的电子排布式为___________________ 。
(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,N、P、As原子的第一电离能由大到小的顺序为______________ 。
(3)NH3的沸点比PH3高,原因是___________ ;PO43-离子的立体构型为___________ 。
(4)AsH3是无色稍有大蒜气味的气体,在AsH3中As原子的杂化轨道类型为______________ 。
(5)H3AsO4和H3AsO3是砷的两种含氧酸,请根据结构与性质的关系,解释H3AsO4比H3AsO3 酸性强的原因_____________________ 。
(6)磷的一种单质白磷(P4)属于分子晶体,其晶胞结构如下图。已知最近两个白磷分子间的距离为 a pm(1pm=10-12m),阿伏伽德罗常数的值为NA,则该晶体的密度为__________________ g/cm3(只要求列算式,不必计算)。
(1)砷的基态原子的电子排布式为
(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,N、P、As原子的第一电离能由大到小的顺序为
(3)NH3的沸点比PH3高,原因是
(4)AsH3是无色稍有大蒜气味的气体,在AsH3中As原子的杂化轨道类型为
(5)H3AsO4和H3AsO3是砷的两种含氧酸,请根据结构与性质的关系,解释H3AsO4比H3AsO3 酸性强的原因
(6)磷的一种单质白磷(P4)属于分子晶体,其晶胞结构如下图。已知最近两个白磷分子间的距离为 a pm(1pm=10-12m),阿伏伽德罗常数的值为NA,则该晶体的密度为

您最近半年使用:0次
2019-01-19更新
|
611次组卷
|
2卷引用:【全国百强校】西藏自治区拉萨中学2019届高三上学期第五次月考理科综合化学试题
10 . A、B、C、D、E、F六种元素均位于周期表的前四周期,且原子序数依次增大。元素A是原子半径最小的元素;B元素基态原子的核外电子分占四个原子轨道(能级);D元素原子的已成对电子总数是未成对电子总数的3倍;E与D处于同一主族;F位于ds区,且原子的最外层只有1个电子。
(1)E+离子的电子排布式是_____________ 。
(2)B、C、D元素的第一电离能由大到小的顺序是_________________ 。
(3)B、C元素的某些氢化物的分子中均含有18个电子,则B的这种氢化物的化学式是___________ ;B、C的这些氢化物的沸点相差较大的主要原因是______________ 。
(4)A、B、D可形成分子式为A2BD的某化合物,则该化合物分子中B原子的轨道杂化类型是_____________ ;1 mol该分子中含有π键的数目是___________ 。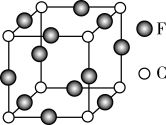
(5)C、F两元素形成的某化合物的晶胞结构如图所示,则该化合物的化学式是_______________ ,C原子的配位数是______________ 。
(1)E+离子的电子排布式是
(2)B、C、D元素的第一电离能由大到小的顺序是
(3)B、C元素的某些氢化物的分子中均含有18个电子,则B的这种氢化物的化学式是
(4)A、B、D可形成分子式为A2BD的某化合物,则该化合物分子中B原子的轨道杂化类型是

(5)C、F两元素形成的某化合物的晶胞结构如图所示,则该化合物的化学式是
您最近半年使用:0次
2017-02-17更新
|
485次组卷
|
2卷引用:2017届西藏拉萨中学高三上期末理综化学卷



