2024·浙江·模拟预测
1 . 根据实验目的设计方案并进行实验,观察到相关现象,其中实验操作、现象得出的结论正确的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | 常温下,将50 mL苯与50 mL CH3COOH混合 | 所得混合溶液的体积为 | 混合过程中削弱了CH3COOH分子间的氢键,且苯与CH3COOH分子间的作用弱于氢键 |
| B | 向待测液中滴加NaOH浓溶液,微热,再将湿润的红色石蕊试纸靠近试管口 | 红色石蕊试纸变蓝 | 待测液一定是铵盐溶液 |
| C | 在两支盛有少许铁的氧化物粉末的试管中分别加入稀硫酸,然后分别滴入酸性KMnO4溶液、KSCN溶液 | 滴入的酸性KMnO4溶液褪色;滴入KSCN溶液后变为红色 | 铁的氧化物粉末为Fe3O4 |
| D | 在待测液中滴加浓盐酸,将产生的气体通入品红溶液中 | 品红溶液褪色 | 待测液中含 或 或 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
名校
2 . 解释下列现象的原因不正确的是
| 选项 | 现象 | 原因 |
| A |  的沸点高于 的沸点高于 |  分子间有氢键, 分子间有氢键, 没有 没有 |
| B | 常温常压下, 为气态, 为气态, 为液态 为液态 |  的相对分子质量大于 的相对分子质量大于 , , 分子间的范德华力更强 分子间的范德华力更强 |
| C |  在 在 中溶解度高于在水中溶解度 中溶解度高于在水中溶解度 |  是非极性分子, 是非极性分子, 是非极性分子,“相似相溶” 是非极性分子,“相似相溶” |
| D | HF的稳定性比HCl好 | H-F键的键能比H-Cl键的键能大 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
名校
3 . 下列关于物质的结构或性质以及解释均正确的是
| 选项 | 物质的结构与性质 | 解释 |
| A | 键角: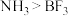 |  中 中 的孤电子对数比 的孤电子对数比 中 中 的孤电子对数多 的孤电子对数多 |
| B | 酸性: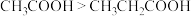 | 烃基(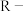 )越长推电子效应越大,使羧基中羟基的极性越小,羧酸的酸性越弱 )越长推电子效应越大,使羧基中羟基的极性越小,羧酸的酸性越弱 |
 |  的熔点比干冰高 的熔点比干冰高 |  比 比 相对分子量大,分子间作用力大 相对分子量大,分子间作用力大 |
 | 稳定性: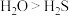 |  分子间存在氢键 分子间存在氢键 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
4 . X、Y、Z、M和W五种短周期主族元素,原子序数依次增大,X元素最高化合价=|最低化合价|,Y在周期表中电负性最大,W与M、X相邻,基态Z的价电子层上只有1个电子,下列说法不正确的是
| A.单核离子半径:M<Z<Y |
| B.W与O原子可形成以平面三角形为结构单元的长链阴离子 |
| C.简单气态氢化物的沸点:Y>W>X |
| D.最高价氧化物中离子键成分百分数:Z>M>X |
您最近半年使用:0次
2024-04-26更新
|
210次组卷
|
2卷引用:浙江省金华市十校2023-2024学年高三下学期4月模拟考试化学试题
名校
解题方法
5 . 下列说法正确的是
A. 常用作呼吸面具或潜水艇中的供氧剂 常用作呼吸面具或潜水艇中的供氧剂 |
B. 在医疗上可用作消化系统X射线检查的内服药剂,俗称“钡餐” 在医疗上可用作消化系统X射线检查的内服药剂,俗称“钡餐” |
| C.液氨分子间存在氢键,汽化时要吸收大量的热,常用作制冷剂 |
| D.胶体中分散质粒子直径为1-100nm,常利用明矾在水中形成胶体来净水和消毒 |
您最近半年使用:0次
6 . 氮、磷、铁及其化合物在工农业生产、生活和科研中有着广泛的应用。回答下列问题:
(1)基态 的价层电子轨道表示式为
的价层电子轨道表示式为______ 。
(2) 、
、 、
、 等易形成配合物,
等易形成配合物, 的空间结构名称为
的空间结构名称为______ 。
(3)已知 的结构有两种,这两种分子结构中除氢外各原子均满足八电子稳定结构(无配位键),请画出沸点高的分子的结构式
的结构有两种,这两种分子结构中除氢外各原子均满足八电子稳定结构(无配位键),请画出沸点高的分子的结构式______ 。
(4)下列关于 、
、 及其化合物结构与性质的论述正确的是______。
及其化合物结构与性质的论述正确的是______。
(5) 与
与 形成的某化合物晶体的晶胞如图,该化合物的化学式为
形成的某化合物晶体的晶胞如图,该化合物的化学式为______ 。 键,可记为
键,可记为 (右下角“6”表示6个原子,右上角“6”表示6个共用电子),杂环化合物咪唑结构如图,其分子中的大
(右下角“6”表示6个原子,右上角“6”表示6个共用电子),杂环化合物咪唑结构如图,其分子中的大 键可表示为
键可表示为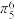 ,则其结合质子能力更强的氮原子是
,则其结合质子能力更强的氮原子是______ (填“①”或“②”),其原因是______ 。
(1)基态
 的价层电子轨道表示式为
的价层电子轨道表示式为(2)
 、
、 、
、 等易形成配合物,
等易形成配合物, 的空间结构名称为
的空间结构名称为(3)已知
 的结构有两种,这两种分子结构中除氢外各原子均满足八电子稳定结构(无配位键),请画出沸点高的分子的结构式
的结构有两种,这两种分子结构中除氢外各原子均满足八电子稳定结构(无配位键),请画出沸点高的分子的结构式(4)下列关于
 、
、 及其化合物结构与性质的论述正确的是______。
及其化合物结构与性质的论述正确的是______。A. 与 与 均为正四面体型的分子晶体,都难以分解和氧化 均为正四面体型的分子晶体,都难以分解和氧化 |
B. 的电负性比 的电负性比 的大,可推断 的大,可推断 分子的极性比 分子的极性比 的大 的大 |
C. 和 和 分子的 分子的 模型为四面体形, 模型为四面体形, 中键角 中键角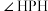 大于 大于 中 中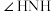 |
D.研究发现固态 中含有 中含有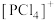 和 和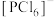 ,而 ,而 中则含有 中则含有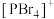 和 和 ,存在差异的原因是 ,存在差异的原因是 半径大 半径大 |
(5)
 与
与 形成的某化合物晶体的晶胞如图,该化合物的化学式为
形成的某化合物晶体的晶胞如图,该化合物的化学式为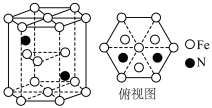
 键,可记为
键,可记为 (右下角“6”表示6个原子,右上角“6”表示6个共用电子),杂环化合物咪唑结构如图,其分子中的大
(右下角“6”表示6个原子,右上角“6”表示6个共用电子),杂环化合物咪唑结构如图,其分子中的大 键可表示为
键可表示为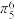 ,则其结合质子能力更强的氮原子是
,则其结合质子能力更强的氮原子是
您最近半年使用:0次
7 . 回答下列问题
(1)钦铝合金是制造航空航天及武器装备热端部件的理想材料。
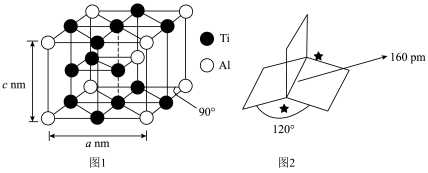
①基态 原子的价电子的轨道表示式
原子的价电子的轨道表示式__________ 。
②下列说法正确的是__________ 。
A.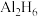 分子中既存在共价键又存在离子键
分子中既存在共价键又存在离子键
B.化学键中离子键成分的百分数: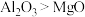
C.第一电离能:
D.测定接近沸点的水蒸气的相对分子质量,测量值偏大的理由是存在相当量的水分子因氢键而相互缔合
③该合金的化学式是__________ ,密度为__________  。
。
(2)碳和氧是构建化合物的常见元素。
某烃结构如图,结合图2所示信息,分析带星号碳的杂化方式为__________ ;带星号碳碳之间的键长比一般碳碳单键的键长要长,请从碳成键轨道的成分角度分析其原因__________ 。
(1)钦铝合金是制造航空航天及武器装备热端部件的理想材料。

①基态
 原子的价电子的轨道表示式
原子的价电子的轨道表示式②下列说法正确的是
A.
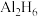 分子中既存在共价键又存在离子键
分子中既存在共价键又存在离子键B.化学键中离子键成分的百分数:
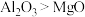
C.第一电离能:

D.测定接近沸点的水蒸气的相对分子质量,测量值偏大的理由是存在相当量的水分子因氢键而相互缔合
③该合金的化学式是
 。
。(2)碳和氧是构建化合物的常见元素。
某烃结构如图,结合图2所示信息,分析带星号碳的杂化方式为
您最近半年使用:0次
2024-04-18更新
|
124次组卷
|
2卷引用:浙江绍兴市2023-2024学年高三下学期选考科目适应性考试化学试题
解题方法
8 . 化合物 可用作电极材料,其中X、Y、Z为原子序数依次增大的短周期元素,X、Y同周期,Y原子的电子总数与Z原子的L层电子数相等。基态W原子的价层电子排布式为
可用作电极材料,其中X、Y、Z为原子序数依次增大的短周期元素,X、Y同周期,Y原子的电子总数与Z原子的L层电子数相等。基态W原子的价层电子排布式为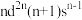 。该电极材料所含阴离子的结构如图所示。下列说法
。该电极材料所含阴离子的结构如图所示。下列说法不正确 的是
 可用作电极材料,其中X、Y、Z为原子序数依次增大的短周期元素,X、Y同周期,Y原子的电子总数与Z原子的L层电子数相等。基态W原子的价层电子排布式为
可用作电极材料,其中X、Y、Z为原子序数依次增大的短周期元素,X、Y同周期,Y原子的电子总数与Z原子的L层电子数相等。基态W原子的价层电子排布式为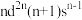 。该电极材料所含阴离子的结构如图所示。下列说法
。该电极材料所含阴离子的结构如图所示。下列说法
A.简单离子半径: |
B.简单氢化物的熔沸点: |
| C.X单质在Y单质中燃烧,其产物中含有非极性共价键 |
| D.W原子有15种空间运动状态不同的电子 |
您最近半年使用:0次
名校
9 . 已知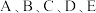 是原子序数依次增大的前四周期元素。
是原子序数依次增大的前四周期元素。 的核外电子总数与其周期数相同,
的核外电子总数与其周期数相同, 与
与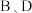 相邻且
相邻且 的原子序数是
的原子序数是 的两倍,基态
的两倍,基态 的轨道全部充满。下列说法正确的是
的轨道全部充满。下列说法正确的是
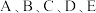 是原子序数依次增大的前四周期元素。
是原子序数依次增大的前四周期元素。 的核外电子总数与其周期数相同,
的核外电子总数与其周期数相同, 与
与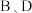 相邻且
相邻且 的原子序数是
的原子序数是 的两倍,基态
的两倍,基态 的轨道全部充满。下列说法正确的是
的轨道全部充满。下列说法正确的是A.简单氢化物的沸点: |
B.第一电离能: |
| C.A、B、C三种元素只形成共价化合物 |
| D.B的简单氢化物的水溶液能溶解E的最高价氧化物对应的水化物 |
您最近半年使用:0次
名校
解题方法
10 . 韩国首尔大学的科学家将水置于一个足够强的电场中,在20℃时,水分子瞬间凝固形成“暖冰”。下列关于“暖冰”的说法正确的是
| A.暖冰中水分子对称性由C2轴变为C∞ |
| B.在电场作用下,水分子间更易形成氢键,因而可以制得“暖冰” |
| C.暖冰中水分子的氧原子的杂化方式为sp3,氢键键能可达到250kJ/mol |
| D.水凝固形成20℃时的“暖冰”氢键键长有变化 |
您最近半年使用:0次



