1 . 同一短周期元素 、
、 、
、 、
、 的原子序数依次增大,其中
的原子序数依次增大,其中 被认为目前形成化合物种类最多的元素,四种元素形成的某种化合物如图所示。下列说法错误的是
被认为目前形成化合物种类最多的元素,四种元素形成的某种化合物如图所示。下列说法错误的是
 、
、 、
、 、
、 的原子序数依次增大,其中
的原子序数依次增大,其中 被认为目前形成化合物种类最多的元素,四种元素形成的某种化合物如图所示。下列说法错误的是
被认为目前形成化合物种类最多的元素,四种元素形成的某种化合物如图所示。下列说法错误的是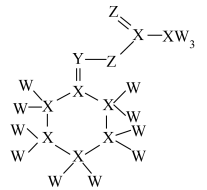
A.简单离子半径: |
B.元素的第一电离能: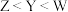 |
| C.分子中各原子最外层均满足8电子稳定结构 |
D.W的氢化物分子间形成了直线形氢键,故简单氢化物的沸点: |
您最近一年使用:0次
名校
2 . 1869年,俄国化学家门捷列夫提出了元素周期律,并在此基础上发表了第一张元素周期表。为了纪念元素周期表诞生150年,联合国将2019年定为“国际化学元素周期表年”,并认为元素周期表是“科学共同的语言”。
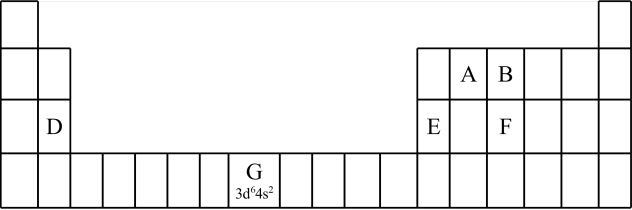
(1)认识元素周期表的结构:___________ 区。
②2017年5月9日我国发布了113号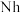 、115号
、115号 、117号
、117号 、118号
、118号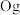 四种元素,则下列说法正确的是
四种元素,则下列说法正确的是___________ (填字母序号)。
a.113号元素在周期表中的位置是第七周期 族
族
b.117号元素 位于金属与非金属分界线上,属于准金属,可能是半导体
位于金属与非金属分界线上,属于准金属,可能是半导体
c.这四种元素都是主族元素
d.最高价氧化物的水化物的碱性:
(2)认识原子结构与元素周期表的关系:见表中元素 的信息,其中 “
的信息,其中 “ ”称为该元素原子的
”称为该元素原子的___________ ,该元素 能层上具有
能层上具有___________ 种不同运动状态的电子。
(3)认识元素周期律及其应用:
①第三周期元素的第一电离能:D_______ E(填“>” “<”或“=”)。
②气态氢化物的沸点:B_____ F (填“>”“<”或“=”),理由是___________ 。B的另一种氢化物可以作为火箭推进剂的燃料之一,其电子式为___________ 。
(1)认识元素周期表的结构:
②2017年5月9日我国发布了113号
 、115号
、115号 、117号
、117号 、118号
、118号 四种元素,则下列说法正确的是
四种元素,则下列说法正确的是a.113号元素在周期表中的位置是第七周期
 族
族b.117号元素
 位于金属与非金属分界线上,属于准金属,可能是半导体
位于金属与非金属分界线上,属于准金属,可能是半导体c.这四种元素都是主族元素
d.最高价氧化物的水化物的碱性:

(2)认识原子结构与元素周期表的关系:见表中元素
 的信息,其中 “
的信息,其中 “ ”称为该元素原子的
”称为该元素原子的 能层上具有
能层上具有(3)认识元素周期律及其应用:
①第三周期元素的第一电离能:D
②气态氢化物的沸点:B
您最近一年使用:0次
2024-04-26更新
|
54次组卷
|
2卷引用:安徽省淮南第二中学2023-2024学年高二下学期期中测试化学试题
名校
3 . 石墨烯是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,破坏平面结构转化为如图所示的氧化石墨烯。下列说法正确的是
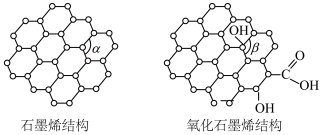
| A.石墨烯是一种新型化合物 |
B.石墨烯中,碳原子与 键数目之比为1:3 键数目之比为1:3 |
C.键角大小: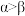 |
| D.在水中的溶解度:石墨烯>氧化石墨烯 |
您最近一年使用:0次
2024-02-02更新
|
782次组卷
|
6卷引用:安徽省合肥市第七中学2023-2024学年高二下学期第一次段考化学试卷
4 . 化合物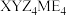 可作肥料,所含的5种元素位于主族,在每个短周期均有分布,仅有Y和M同族。Y的基态原子价层p轨道半充满,X的基态原子价层电子排布式为
可作肥料,所含的5种元素位于主族,在每个短周期均有分布,仅有Y和M同族。Y的基态原子价层p轨道半充满,X的基态原子价层电子排布式为 ,X与M同周期,E在地壳中含量最多。下列说法正确的是
,X与M同周期,E在地壳中含量最多。下列说法正确的是
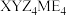 可作肥料,所含的5种元素位于主族,在每个短周期均有分布,仅有Y和M同族。Y的基态原子价层p轨道半充满,X的基态原子价层电子排布式为
可作肥料,所含的5种元素位于主族,在每个短周期均有分布,仅有Y和M同族。Y的基态原子价层p轨道半充满,X的基态原子价层电子排布式为 ,X与M同周期,E在地壳中含量最多。下列说法正确的是
,X与M同周期,E在地壳中含量最多。下列说法正确的是A.元素电负性: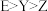 | B.氢化物沸点: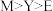 |
C.第一电离能: | D.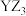 和 和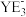 的空间结构均为三角锥形 的空间结构均为三角锥形 |
您最近一年使用:0次
2023-07-04更新
|
8329次组卷
|
16卷引用:安徽省合肥市第七中学2023-2024学年高二下学期第一次段考化学试卷
安徽省合肥市第七中学2023-2024学年高二下学期第一次段考化学试卷 2023年高考广东卷化学真题(已下线)2023年广东卷高考真题变式题(选择题11-16)(已下线)第19讲元素周期律与元素周期表江西省宜春市宜丰中学2023-2024学年高三上学期开学考试化学试题(已下线)考点18 元素周期律与元素周期表(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)广东省江门市第一中学2023-2024学年高二上学期第一次段考化学试题(已下线)选择题1-5陕西师范大学附属中学2023-2024学年高二上学期期中考试化学试题(已下线)题型20 物质结构与性质基础-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)重庆市第七中学校2023-2024学年高三上学期月考(12月)化学试题河北省石家庄二中教育集团2023-2024学年高二年级上学期期末考试化学试题四川省南充市阆中中学校2023-2024学年高二下学期3月月考化学试卷福建省南安市侨光中学2023-2024学年高二下学期4月月考化学试题甘肃省白银市靖远县第四中学2023-2024学年高二下学期4月月考化学试题广东省乐昌市第二中学2023-2024学年高三下学期保温测试(5月模拟)化学试题
名校
5 . 绿矾(FeSO4·7H2O)结构如图所示,下列说法正确的是

| A.中心离子Fe2+核外电子有7种空间运动状态 |
B. 中键角∠OSO小于H2O中键角∠HOH 中键角∠OSO小于H2O中键角∠HOH |
C.此结构中H2O与Fe2+、H2O与 之间的作用力相同 之间的作用力相同 |
| D.FeSO4·7H2O失水后可转为FeSO4·6H2O,此过程只破坏了氢键 |
您最近一年使用:0次
6 . X、Y、Z、W是原子序数依次增大的短周期元素,X、Z可以构成[ZX4]+,W与Z同周期。化合物A有顺式和反式两种同分异构体,结构如下图。

| A.简单离子半径W>Z>Y |
| B.根据结构可以推测顺式结构能溶于水,反式结构难溶于水 |
| C.第一电离能W>Z>Y |
| D.化合物A不存在配位键 |
您最近一年使用:0次
名校
解题方法
7 . 我国科学家研发的全球首套千吨级太阳能燃料合成项目被形象地称为“液态阳光”计划。该项目通过太阳能发电电解水制氢,再采用高选择性催化剂将二氧化碳加氢合成甲醇。回答下列问题:
(1)太阳能电池板主要材料为单晶硅或多晶硅。Si的价电子层的电子排布式为______ ;单晶硅的晶体类型为______ 。
SiCl4可发生水解反应,机理如图:
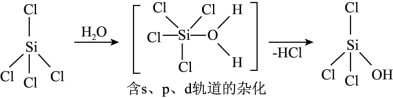
含s、p、d轨道的杂化类型有:①dsp2、②sp3d、③sp3d2,中间体SiCl4(H2O)中Si采取的杂化类型为______ (填标号)。
(2)甲醇的沸点(64.7℃)介于水(100℃)和甲硫醇(CH3SH,7.6℃)之间,其原因是_____ 。
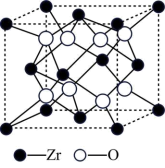
(3)我国科学家发明了高选择性的二氧化碳加氢合成甲醇的催化剂,其组成为ZnO/ZrO2固溶体。四方ZrO2晶胞如图所示。Zr4+离子在晶胞中的配位数是_____ ,晶胞参数为apm、apm、cpm,该晶体密度为_____ g•cm-3(写出表达式)。在ZrO2中掺杂少量ZnO后形成的催化剂,化学式可表示为ZnxZr1-xOy,则y=_____ (用x表达)。
(1)太阳能电池板主要材料为单晶硅或多晶硅。Si的价电子层的电子排布式为
SiCl4可发生水解反应,机理如图:

含s、p、d轨道的杂化类型有:①dsp2、②sp3d、③sp3d2,中间体SiCl4(H2O)中Si采取的杂化类型为
(2)甲醇的沸点(64.7℃)介于水(100℃)和甲硫醇(CH3SH,7.6℃)之间,其原因是
(3)我国科学家发明了高选择性的二氧化碳加氢合成甲醇的催化剂,其组成为ZnO/ZrO2固溶体。四方ZrO2晶胞如图所示。Zr4+离子在晶胞中的配位数是

您最近一年使用:0次
8 . 有机化学家科里编制了世界上第一个具有计算机辅助有机合成路线设计程序,获得1990年诺贝尔化学奖。以下是科里提出的长叶烯的部分合成路线:
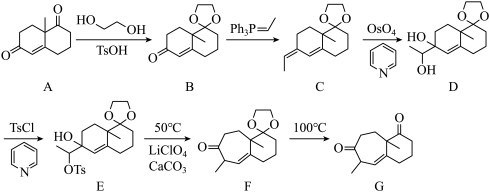
回答下列问题:
(1)A→ B的目的是_______________________________ 。
(2)B→C 的反应类型是_____________________ ,C的分子式为_____________ 。
(3)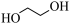 可以与水以任意比例互溶,原因是
可以与水以任意比例互溶,原因是_________________________ 。
(4) A、B 、C分子中均含有共轭结构,下列可用于检测共轭体系的是_____________ 。
a.紫外一可见光谱 b. 红外光谱 c.核磁共振氢谱 d.质谱
(5)同时满足下列条件的G的同分异构体有_____________ 种(不考虑立体异构)。
a. 分子中有一个苯环和一个六元碳环以一根σ键相连
b.能与FeCl3溶液发生显色反应
c.1mol该有机物最多能与2mol NaOH发生反应
(6)根据题中信息,写出以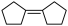 为原料合成
为原料合成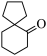 的路线
的路线_______ 。

回答下列问题:
(1)A→ B的目的是
(2)B→C 的反应类型是
(3)
 可以与水以任意比例互溶,原因是
可以与水以任意比例互溶,原因是(4) A、B 、C分子中均含有共轭结构,下列可用于检测共轭体系的是
a.紫外一可见光谱 b. 红外光谱 c.核磁共振氢谱 d.质谱
(5)同时满足下列条件的G的同分异构体有
a. 分子中有一个苯环和一个六元碳环以一根σ键相连
b.能与FeCl3溶液发生显色反应
c.1mol该有机物最多能与2mol NaOH发生反应
(6)根据题中信息,写出以
 为原料合成
为原料合成 的路线
的路线
您最近一年使用:0次
名校
解题方法
9 . 金属Mn、Co、Ni、Sb等在电池、储氢材料、催化剂等方面有广泛应用。请回答下列问题:
(1)基态Co原子中,核外电子占据的最高能层的符号是_______ ,基态Ni简化的核外电子排布式为_______ 。
(2)铜锰氧化物( CuMn2O4)能在常温下催化氧化甲醛生成甲酸(结构如图)。
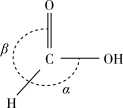
①甲酸的沸点比甲醛的_______ (填“低”或“高”),主要原因是_______ 。
②甲酸分子中O-H键的类型是s-sp3σ键,C-H键的类型是_______ σ键,键角:α_______ β(填“>”“=”或“<”)。
(3)超强酸氟锑酸(结构如图)在化学和化学工业上有很大的应用价值,是活性极高的催化剂。

①该物质中∠FSbF为90°或180° ,则阴离子的空间构型为_______ 。
②阴离子的中心原子的杂化轨道类型是_______ (填序号)。
A. sp3d2 B. sp2 C. sp3 D. sp
(4)Mg2 NiH4是科学家研究的一种高效固态储氢材料。在Mg2NiH4晶胞中,Ni原子占据如图所示的顶点和面心,Mg2+处于图中八个小立方体的体心。Mg2+和Ni原子的最短距离为d nm,NA为阿伏加德罗常数的值,该晶体的密度为_______ g·cm-3(用含NA、d、M的代数式表示,Mg2NiH4的相对分子质量为M)。
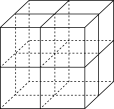
(1)基态Co原子中,核外电子占据的最高能层的符号是
(2)铜锰氧化物( CuMn2O4)能在常温下催化氧化甲醛生成甲酸(结构如图)。

①甲酸的沸点比甲醛的
②甲酸分子中O-H键的类型是s-sp3σ键,C-H键的类型是
(3)超强酸氟锑酸(结构如图)在化学和化学工业上有很大的应用价值,是活性极高的催化剂。

①该物质中∠FSbF为90°或180° ,则阴离子的空间构型为
②阴离子的中心原子的杂化轨道类型是
A. sp3d2 B. sp2 C. sp3 D. sp
(4)Mg2 NiH4是科学家研究的一种高效固态储氢材料。在Mg2NiH4晶胞中,Ni原子占据如图所示的顶点和面心,Mg2+处于图中八个小立方体的体心。Mg2+和Ni原子的最短距离为d nm,NA为阿伏加德罗常数的值,该晶体的密度为

您最近一年使用:0次
2022-05-30更新
|
265次组卷
|
3卷引用:安徽省名校2022届高三毕业班考前定位理科综合化学试题
名校
解题方法
10 . 近年来我国科学家发现了一系列意义重大的铁系超导材料,其中一类为Fe-Sm-As-F-O组成的化合物。回答下列问题:
(1)元素As与N同主族。预测As的氢化物分子的立体结构为_______ ,其沸点比NH3的_______ (填“高”或“低”)。
(2)Fe成为阳离子时首先失去_______ 轨道电子,Sm的价层电子排布式为4f66s2,Sm3+的价层电子排布式为_______ 。
(3)Na、Mg、Al三种元素中,有一种元素的电离能数据如下:
则该元素是______________ (填写元素符号)。
(4)磷酸亚铁锂(LiFePO4)可用作锂离子电池正极材料,具有热稳定性好、循环性能优良、安全性高等特点,文献报道可采用FeCl3、NH4H2PO4、LiCl和苯胺等作为原料制备。
①在周期表中,与Li的化学性质最相似的邻族元素是__________ ,该元素基态原子核外M层电子的自旋状态_______ (填“相同”或“相反”)。
②NH4H2PO4中,电负性最高的元素是_______ ,P的_______ 杂化轨道与O的2p轨道形成_______ 键。
(1)元素As与N同主族。预测As的氢化物分子的立体结构为
(2)Fe成为阳离子时首先失去
(3)Na、Mg、Al三种元素中,有一种元素的电离能数据如下:
| 电离能 | I1 | I2 | I3 | I4 | ...... |
| I/kJ▪mol-1 | 578 | 1817 | 2745 | 11578 | ...... |
则该元素是
(4)磷酸亚铁锂(LiFePO4)可用作锂离子电池正极材料,具有热稳定性好、循环性能优良、安全性高等特点,文献报道可采用FeCl3、NH4H2PO4、LiCl和苯胺等作为原料制备。
①在周期表中,与Li的化学性质最相似的邻族元素是
②NH4H2PO4中,电负性最高的元素是
您最近一年使用:0次



