近年来我国科学家发现了一系列意义重大的铁系超导材料,其中一类为Fe-Sm-As-F-O组成的化合物。回答下列问题:
(1)元素As与N同主族。预测As的氢化物分子的立体结构为_______ ,其沸点比NH3的_______ (填“高”或“低”)。
(2)Fe成为阳离子时首先失去_______ 轨道电子,Sm的价层电子排布式为4f66s2,Sm3+的价层电子排布式为_______ 。
(3)Na、Mg、Al三种元素中,有一种元素的电离能数据如下:
则该元素是______________ (填写元素符号)。
(4)磷酸亚铁锂(LiFePO4)可用作锂离子电池正极材料,具有热稳定性好、循环性能优良、安全性高等特点,文献报道可采用FeCl3、NH4H2PO4、LiCl和苯胺等作为原料制备。
①在周期表中,与Li的化学性质最相似的邻族元素是__________ ,该元素基态原子核外M层电子的自旋状态_______ (填“相同”或“相反”)。
②NH4H2PO4中,电负性最高的元素是_______ ,P的_______ 杂化轨道与O的2p轨道形成_______ 键。
(1)元素As与N同主族。预测As的氢化物分子的立体结构为
(2)Fe成为阳离子时首先失去
(3)Na、Mg、Al三种元素中,有一种元素的电离能数据如下:
| 电离能 | I1 | I2 | I3 | I4 | ...... |
| I/kJ▪mol-1 | 578 | 1817 | 2745 | 11578 | ...... |
则该元素是
(4)磷酸亚铁锂(LiFePO4)可用作锂离子电池正极材料,具有热稳定性好、循环性能优良、安全性高等特点,文献报道可采用FeCl3、NH4H2PO4、LiCl和苯胺等作为原料制备。
①在周期表中,与Li的化学性质最相似的邻族元素是
②NH4H2PO4中,电负性最高的元素是
更新时间:2022-05-20 17:26:57
|
相似题推荐
解答题-结构与性质
|
较难
(0.4)
名校
【推荐1】过渡元素镍(Ni)、铬(Cr)都是重要的合金元素,他们的配合物在科技生活中都有很重要的应用,例如我国科学家合成铬的化合物通过烷基铝和[ph3C]+[B(C6F5)4]-活化后,对乙烯聚合表现出较好的催化活性。合成铬的化合物过程中的一步反应为:

回答下列问题:
(1)Cr3+价电子核外电子排布式为______ ,分子甲中除铬外其他元素的电负性由大到小依次为______ (填元素符号)。
(2)一定条件下环戊二烯 可转化为
可转化为 ,在这个过程中C原子的杂化方式变化为由sp3变为
,在这个过程中C原子的杂化方式变化为由sp3变为_____ , 中大π键可表示为
中大π键可表示为_____ 。
(3)化合物丙中1、2、3、4处的化学键是配位键的是_______ 。
a.只有2 b.2、3、4 c.全部都是
(4)AsCl3也可以与铬离子形成配合物,当氯原子被烷基取代后,配位能力增强,其原因是__________ 。
(5)水在合成铬的化合物的过程中作溶剂。研究表明水能凝结成13种类型的结晶体。重冰(密度比水大)属于立方晶系,其立方晶胞沿x、y或z轴的投影图如图所示,晶体中H2O的配位数为_________ 。
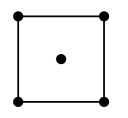
(6)一种由镍、氟、钾三种元素组成的化合物晶胞结构如图所示,原子A、B之间的距离是_________ (用字母a、b、c表示),晶胞中镍的分数坐标有____ 种。


回答下列问题:
(1)Cr3+价电子核外电子排布式为
(2)一定条件下环戊二烯
 可转化为
可转化为 ,在这个过程中C原子的杂化方式变化为由sp3变为
,在这个过程中C原子的杂化方式变化为由sp3变为 中大π键可表示为
中大π键可表示为(3)化合物丙中1、2、3、4处的化学键是配位键的是
a.只有2 b.2、3、4 c.全部都是
(4)AsCl3也可以与铬离子形成配合物,当氯原子被烷基取代后,配位能力增强,其原因是
(5)水在合成铬的化合物的过程中作溶剂。研究表明水能凝结成13种类型的结晶体。重冰(密度比水大)属于立方晶系,其立方晶胞沿x、y或z轴的投影图如图所示,晶体中H2O的配位数为

(6)一种由镍、氟、钾三种元素组成的化合物晶胞结构如图所示,原子A、B之间的距离是

您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐2】钕铁硼磁铁因其超强的磁性被誉为“永磁之王”。工业上从废旧钕铁硼合金废料(含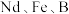 等)中回收、制取氧化钕的流程如图所示:
等)中回收、制取氧化钕的流程如图所示:
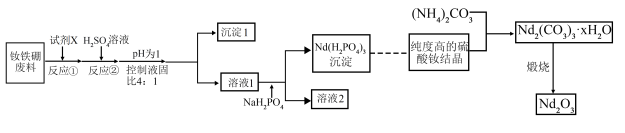
已知:① 稳定的化合价为
稳定的化合价为 ;金属钕的活动性较强,能与酸发生置换反应。
;金属钕的活动性较强,能与酸发生置换反应。
②硼不与稀硫酸反应。
③常温下, 。
。
回答下列问题:
(1)反应①的目的是去除废料表面的油脂和污渍,可选用下列中的___________(填标号)作试剂X。
(2)沉淀1的主要成分是___________ (填化学式)。
(3)向溶液1中加入 进行“沉钕”,写出该反应的离子方程式
进行“沉钕”,写出该反应的离子方程式___________ ;已知溶液1中 ,常温下,“沉钕”过程中,控制
,常温下,“沉钕”过程中,控制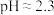 ,使
,使 沉淀完全,通过计算说明是否有
沉淀完全,通过计算说明是否有 沉淀生成
沉淀生成___________ (填“有”或“无”)。
(4)判断 已洗涤干净的实验操作及现象是
已洗涤干净的实验操作及现象是___________ 。
(5)写出煅烧生成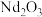 的化学方程式:
的化学方程式:___________ 。
(6)硼与硅相似,也能与氢形成一类化合物——硼烷。常见的有乙硼烷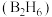 、丁硼烷
、丁硼烷 、己硼烷
、己硼烷 等。
等。
①硼、氮、氧元素的第一电离能由大到小的顺序是___________ 。
②乙硼烷的结构式为 ,分子中B原子通过氢桥键(
,分子中B原子通过氢桥键(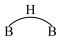 )形成一个四元环。丁硼烷
)形成一个四元环。丁硼烷 分子中存在4个氢桥键且有两个五元环,写出其结构式
分子中存在4个氢桥键且有两个五元环,写出其结构式___________ 。
 等)中回收、制取氧化钕的流程如图所示:
等)中回收、制取氧化钕的流程如图所示:
已知:①
 稳定的化合价为
稳定的化合价为 ;金属钕的活动性较强,能与酸发生置换反应。
;金属钕的活动性较强,能与酸发生置换反应。②硼不与稀硫酸反应。
③常温下,
 。
。回答下列问题:
(1)反应①的目的是去除废料表面的油脂和污渍,可选用下列中的___________(填标号)作试剂X。
| A.酒精 | B. 溶液 溶液 | C.纯碱溶液 | D.稀硝酸 |
(2)沉淀1的主要成分是
(3)向溶液1中加入
 进行“沉钕”,写出该反应的离子方程式
进行“沉钕”,写出该反应的离子方程式 ,常温下,“沉钕”过程中,控制
,常温下,“沉钕”过程中,控制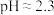 ,使
,使 沉淀完全,通过计算说明是否有
沉淀完全,通过计算说明是否有 沉淀生成
沉淀生成(4)判断
 已洗涤干净的实验操作及现象是
已洗涤干净的实验操作及现象是(5)写出煅烧生成
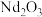 的化学方程式:
的化学方程式:(6)硼与硅相似,也能与氢形成一类化合物——硼烷。常见的有乙硼烷
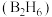 、丁硼烷
、丁硼烷 、己硼烷
、己硼烷 等。
等。①硼、氮、氧元素的第一电离能由大到小的顺序是
②乙硼烷的结构式为
 ,分子中B原子通过氢桥键(
,分子中B原子通过氢桥键( )形成一个四元环。丁硼烷
)形成一个四元环。丁硼烷 分子中存在4个氢桥键且有两个五元环,写出其结构式
分子中存在4个氢桥键且有两个五元环,写出其结构式
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐3】近日,中国科学院上海有机化学研究所游书力研究员团队将铜催化的不对称共轭加成反应与铱(Ir)催化的不对称烯丙基取代反应相结合,成功构建了含多个连续手性中心的酮类化合物,其原理如图所示(Ac代表 基,R'、R''、R均为烃基)。
基,R'、R''、R均为烃基)。

回答下列问题:
(1)甲分子中含有的化学键类型是___________ (填字母)。
A.离子键 B.σ键 C.非极性键
(2)合成丙时需要锌、铜作催化剂。第二电离能与第一电离能之差较小的是___________ (填“Zn”或“Cu”),判断理由是___________ 。
(3)若R、R'、R''都是饱和烃基,在甲、丙中,存在顺反异构体的是________ (填代号)。
(4)在含铱催化剂作用下,甲烷选择性氧化可合成多种高附加值的产品,原理如图所示。

①在图中涉及的物质中,除了氢气外,属于非极性分子的是___________ (填化学式)。
②Ir晶胞结构如图所示,晶胞参数为apm, 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。

铱晶胞中,面心上Ir原子连接起来构成___________ (填字母)。
a.正四面体 b.正方形 c.正八面体 d.正六面体
该晶体的密度为___________  (用含a、
(用含a、 的代数式表示)。
的代数式表示)。
 基,R'、R''、R均为烃基)。
基,R'、R''、R均为烃基)。
回答下列问题:
(1)甲分子中含有的化学键类型是
A.离子键 B.σ键 C.非极性键
(2)合成丙时需要锌、铜作催化剂。第二电离能与第一电离能之差较小的是
(3)若R、R'、R''都是饱和烃基,在甲、丙中,存在顺反异构体的是
(4)在含铱催化剂作用下,甲烷选择性氧化可合成多种高附加值的产品,原理如图所示。

①在图中涉及的物质中,除了氢气外,属于非极性分子的是
②Ir晶胞结构如图所示,晶胞参数为apm,
 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。
铱晶胞中,面心上Ir原子连接起来构成
a.正四面体 b.正方形 c.正八面体 d.正六面体
该晶体的密度为
 (用含a、
(用含a、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
解答题-有机推断题
|
较难
(0.4)
名校
解题方法
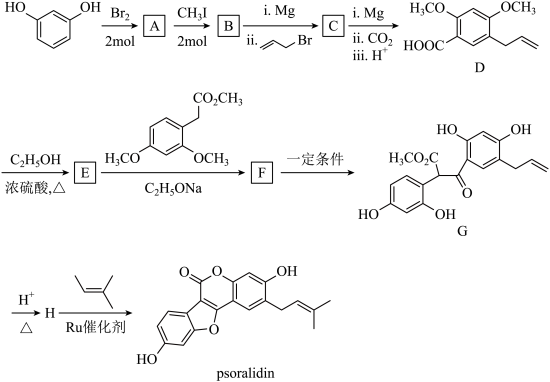
【推荐1】已知间苯二酚可以合成中草药的活性成分Psoralidin(化合物P),合成路线如下: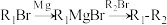 ;
;
ⅱ.
(1)A中含氧官能团的名称为_______ 。
(2)C的结构简式为_______ 。
(3)D→E的方程式为_______ 。
(4)下列关于物质F的说法正确的是_______。
(5)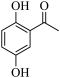 的同分异构体中,既能水解,又能发生银镜反应,还能使FeCl3溶液显紫色的有
的同分异构体中,既能水解,又能发生银镜反应,还能使FeCl3溶液显紫色的有_______ 种。
(6)H+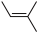 →P+J的反应原理如下。J的名称为
→P+J的反应原理如下。J的名称为_______ 。_______ 、_______ 、_______ 。
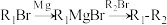 ;
;ⅱ.

(1)A中含氧官能团的名称为
(2)C的结构简式为
(3)D→E的方程式为
(4)下列关于物质F的说法正确的是_______。
| A.分子中有1个手性碳原子 | B.存在顺反异构体 |
| C.碳原子的杂化方式有2种 | D.1molF最多能与7molH2发生加成反应 |
(5)
 的同分异构体中,既能水解,又能发生银镜反应,还能使FeCl3溶液显紫色的有
的同分异构体中,既能水解,又能发生银镜反应,还能使FeCl3溶液显紫色的有(6)H+
 →P+J的反应原理如下。J的名称为
→P+J的反应原理如下。J的名称为
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
解题方法
【推荐2】已知X、Y、Z、W、Q是前四周期的核电荷数依次增大的元素,X的价电子层中有3个未成对电子,X与Z同主族;Y与W同主族,W元素原子M层有两对成对电子;Q的最外层只有1个电子,但次外层有18个电子。
(1)X、Y、W的第一电离能由大到小的顺序是__ (填字母对应的元素符号)。
(2)已知元素Z的某钾盐(KH2ZO4)是其酸(H3ZO2)的正盐,则酸H3ZO2的结构式为__ (元素Z用对应的元素符号书写)。
(3)已知元素X、Z相关键的键能(kJ•mol-1)如表:从能量角度看,X元素形成的单质以X2、而Z元素形成的单质Z4(结构式可表示为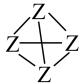 )形式存在的原因是
)形式存在的原因是__ 。
(4)元素W的含氧酸根离子(WO )的空间构型为
)的空间构型为__ ,与之互为等电子体的阴离子有__ (写出一种离子符号;等电子体指化学通式相同且价电子总数相等的分子或离子)。
(5)对于基态Q原子,下列叙述正确的是__ (填标号)。
(6)向盛有QSO4水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液。分离出所得溶质化合物[Q(NH3)4(H2O)2]SO4,然后加热该化合物固体,首先失去的组分是__ ,理由是__ 。
(1)X、Y、W的第一电离能由大到小的顺序是
(2)已知元素Z的某钾盐(KH2ZO4)是其酸(H3ZO2)的正盐,则酸H3ZO2的结构式为
(3)已知元素X、Z相关键的键能(kJ•mol-1)如表:从能量角度看,X元素形成的单质以X2、而Z元素形成的单质Z4(结构式可表示为
 )形式存在的原因是
)形式存在的原因是| X—X | X≡X | Z—Z | Z≡Z |
| 193 | 946 | 197 | 489 |
 )的空间构型为
)的空间构型为(5)对于基态Q原子,下列叙述正确的是
| A.遵循能量最低原理,核外电子排布应为[Ar]3d94s2 |
| B.排布在外层的电子总是比排布在内层的电子离核更远 |
| C.电负性比钾高,原子对键合电子的吸引力比钾大 |
| D.电子先排入4s轨道,再排进3d轨道,故3d轨道的电子能量比4s高 |
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐3】非金属元素及其化合物在生产、生活中占据重要地位。回答下列问题:
(1)基态Se原子核外电子占据的最高能级符号为____ ,该能级的电子云轮廓图形为_____ 形。
(2)H2O、H2S、H2Se的沸点由高到低的顺序为_____ (填化学式,下同),酸性由强到弱的顺序为______ 。
(3)下列分子或离子与CO2具有相同类型的化学键和立体结构的是_______ (填标号)。
a.SO2 b.CS2 c.OF2 d.NO
(4)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。EDTA螯合物的结构如下图所示,EDTA的配体数为_____ ,EDTA中C原子的杂化方式为_____ ,1molEDTA通过螯合作用形成了_____ mol五元环。
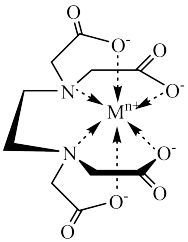
(1)基态Se原子核外电子占据的最高能级符号为
(2)H2O、H2S、H2Se的沸点由高到低的顺序为
(3)下列分子或离子与CO2具有相同类型的化学键和立体结构的是
a.SO2 b.CS2 c.OF2 d.NO

(4)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。EDTA螯合物的结构如下图所示,EDTA的配体数为

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐1】氮族元素是一类重要元素,广泛应用于生产生活,特别是在医药、纳米材料制备中。回答下列问题:
(1)N、P同族,性质相似。氮原子间可形成键能很大的氮氮三键而磷原子间不能形成类似结构的原因是_____ 。
(2)肼(N2H4)和偏二甲肼[(CH3)2NNH2]均为无色液体,属于同系物,是常用的火箭推进剂,其熔沸点如表:
二者熔沸点差异较大的主要原因是_____ 。
(3)在多原子分子中如有相互平行的p轨道,它们连贯重叠在一起构成一个整体,p电子在多个原子间运动形成π型化学键,这种不局限在两个原子之间的π键称为离域π键,简称大π键。可用符号Π 表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数,如苯分子中的大π键可表示为Π
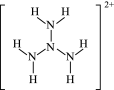
表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数,如苯分子中的大π键可表示为Π 。计算表明,N4H
。计算表明,N4H 结构如图所示,只有一种化学环境的氢原子,其中的大π键可表示为
结构如图所示,只有一种化学环境的氢原子,其中的大π键可表示为_____ 。
(4)氮化硼(BN)是由氮原子和硼原子所构成的晶体。工业上制备氮化硼的一种方法为BCl3(g)+NH3(g)=BN(s)+3HCl(g)。形成BCl3时,基态B原子价电子层上的电子先激发再杂化,激发时B原子的价电子轨道表示式可能为_____ (填标号)。
(1)N、P同族,性质相似。氮原子间可形成键能很大的氮氮三键而磷原子间不能形成类似结构的原因是
(2)肼(N2H4)和偏二甲肼[(CH3)2NNH2]均为无色液体,属于同系物,是常用的火箭推进剂,其熔沸点如表:
| 物质 | 肼 | 偏二甲肼 |
| 熔点 | 1.4℃ | -58℃ |
| 沸点 | 113.5℃ | 63.9℃ |
(3)在多原子分子中如有相互平行的p轨道,它们连贯重叠在一起构成一个整体,p电子在多个原子间运动形成π型化学键,这种不局限在两个原子之间的π键称为离域π键,简称大π键。可用符号Π
 表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数,如苯分子中的大π键可表示为Π
表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数,如苯分子中的大π键可表示为Π 。计算表明,N4H
。计算表明,N4H 结构如图所示,只有一种化学环境的氢原子,其中的大π键可表示为
结构如图所示,只有一种化学环境的氢原子,其中的大π键可表示为
(4)氮化硼(BN)是由氮原子和硼原子所构成的晶体。工业上制备氮化硼的一种方法为BCl3(g)+NH3(g)=BN(s)+3HCl(g)。形成BCl3时,基态B原子价电子层上的电子先激发再杂化,激发时B原子的价电子轨道表示式可能为
A.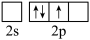 | B.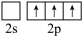 | C.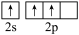 | D. |
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐2】I.解释下列问题:
(1)H2O内的O—H、水分子间的范德华力和氢键,从强到弱依次为______ ,H+可与H2O形成H3O+,H3O+中O采用______ 杂化,H3O+的空间构型为______ 。H3O+中H—O—H键角比H2O中的______ ,原因是______ 。
(2)用质谱仪检测气态乙酸时,谱图中出现质荷比(相对分子质量)为120的峰,原因是______ 。
(3)金属镓(Ga)位于元素周期表中第4周期IIIA族,其卤化物的熔点如下表:
GaF3熔点比GaCl3熔点高很多的原因是_______________ 。
(4)三价铬离子能形成多种配位化合物。 中提供电子对形成配位键的原子是
中提供电子对形成配位键的原子是_________ ,中心离子的配位数为_______ 。
II.钙钛矿(CaTiO3)型化合物是一类可用于生产太阳能电池、传感器、固体电阻器等的功能材料,回答下列问题:(M(Pb)=207g/mol;M(I)=127g/mol;M(N)=14g/mol;M(C)=12g/mol)
(5)基态Ti原子的核外电子排布式为_________ 。
(6)CaTiO3的晶胞如图(a)所示,金属离子与氧离子间的作用力为_______ ,Ca2+的配位数是_______ 。

(7)一种立方钙钛矿结构的金属卤化物光电材料的组成为Pb2+、I﹣和有机碱离子 ,其晶胞如图(b)所示。其中Pb2+与图(a)中
,其晶胞如图(b)所示。其中Pb2+与图(a)中_______ 的空间位置相同,有机碱 中,N原子的杂化轨道类型是
中,N原子的杂化轨道类型是_______ ;若晶胞参数为anm,则晶体密度为_______ g·cm-3(列出计算式)。

(1)H2O内的O—H、水分子间的范德华力和氢键,从强到弱依次为
(2)用质谱仪检测气态乙酸时,谱图中出现质荷比(相对分子质量)为120的峰,原因是
(3)金属镓(Ga)位于元素周期表中第4周期IIIA族,其卤化物的熔点如下表:
| GaF3 | GaCl3 | GaBr3 | |
| 熔点/℃ | >1000 | 77.75 | 122.3 |
(4)三价铬离子能形成多种配位化合物。
 中提供电子对形成配位键的原子是
中提供电子对形成配位键的原子是II.钙钛矿(CaTiO3)型化合物是一类可用于生产太阳能电池、传感器、固体电阻器等的功能材料,回答下列问题:(M(Pb)=207g/mol;M(I)=127g/mol;M(N)=14g/mol;M(C)=12g/mol)
(5)基态Ti原子的核外电子排布式为
(6)CaTiO3的晶胞如图(a)所示,金属离子与氧离子间的作用力为

(7)一种立方钙钛矿结构的金属卤化物光电材料的组成为Pb2+、I﹣和有机碱离子
 ,其晶胞如图(b)所示。其中Pb2+与图(a)中
,其晶胞如图(b)所示。其中Pb2+与图(a)中 中,N原子的杂化轨道类型是
中,N原子的杂化轨道类型是
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
【推荐3】2019年诺贝尔化学奖授予三位化学家,以表彰其对研究开发锂离子电池作出的卓越贡献。LiFePO4、聚乙二酶、LiPF6、LiAsF6,和LiCl等可作锂离子聚合物电池的材料。回答下列问题:
(1)Li、F、P、As四种元素的第一电离能由大到小的顺序为___ 。
(2)乙二醇(HCH2CH2OH)的相对分子质量与丙醇(CH3CH2CH2OH)相近,但沸点:丙醇97.2℃,乙二醇197.3%℃,原因是___ 。
(3)电池工作时,Li+沿聚乙二醇分子中的碳氧链迁移的过程如图甲所示(图中阴离子未画出)。电解质LiPF6或LiAsF6的阴离子结构如图乙所示(X=P、As)。
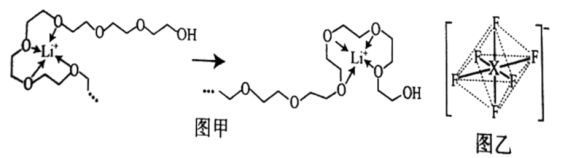
①聚乙二醇分子中,碳、氧的杂化类型分别是___ 、___ 。
②从化学键角度看,Li+迁移过程发生___ (填“物理变化”或“化学变化”)。
③PF 中P的配位数为
中P的配位数为___ 。
④相同条件,Li+在LiAsF6中迁移较快,原因是___ 。
(4)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。LiCl•3H2O属正交晶系(长方体形)。晶胞参数为0.72nm、1.0nm、0.56nm。如图为沿Z轴投影的晶胞中所有Cl原子的分布图和原子分数坐标。据此推断该晶胞中Cl原子的数目为___ 。LiCl•3H2O的摩尔质量为Mg·mol-1,设NA为阿伏加德罗常数的值,则LiCl•3H2O晶体的密度为___ g·cm-3(列出计算表达式)。

(1)Li、F、P、As四种元素的第一电离能由大到小的顺序为
(2)乙二醇(HCH2CH2OH)的相对分子质量与丙醇(CH3CH2CH2OH)相近,但沸点:丙醇97.2℃,乙二醇197.3%℃,原因是
(3)电池工作时,Li+沿聚乙二醇分子中的碳氧链迁移的过程如图甲所示(图中阴离子未画出)。电解质LiPF6或LiAsF6的阴离子结构如图乙所示(X=P、As)。

①聚乙二醇分子中,碳、氧的杂化类型分别是
②从化学键角度看,Li+迁移过程发生
③PF
 中P的配位数为
中P的配位数为④相同条件,Li+在LiAsF6中迁移较快,原因是
(4)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。LiCl•3H2O属正交晶系(长方体形)。晶胞参数为0.72nm、1.0nm、0.56nm。如图为沿Z轴投影的晶胞中所有Cl原子的分布图和原子分数坐标。据此推断该晶胞中Cl原子的数目为

您最近一年使用:0次



