1 . 共价晶体
| 概念 | 共价晶体是原子之间以 | |
| 构成粒子 | ||
| 微粒间的作用 | ||
| 物理性质 | 熔、沸点 | |
| 常见共价晶体 | 金刚石、单晶硅、碳化硅(SiC)、二氧化硅(SiO2)等。 | |
| 典型共价晶体 | 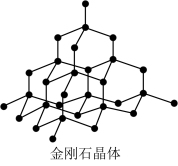 每个C原子形成4个C-C键,构成正四面体形成空间网状结构,其中n(C):n(C-C)=1:2 | 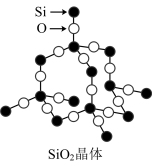 每个Si形成4个Si-O键,每个O形成2个O-Si键,向空间伸展形成网状结构,不存在单个分子,Si与O个数比为1:2,SiO2为化学式 |
您最近一年使用:0次
2 . 常见晶体的结构分析
(1)金刚石晶体



①在晶体中每个碳原子以_______ 个共价单键与相邻的_______ 个碳原子相结合,成为正四面体。
②晶体中C-C-C夹角为_______ ,碳原子采取了_______ 杂化。
③最小环上有_______ 个碳原子。
④晶体中碳原子个数与C-C键数之比为_______ 。
⑤在一个晶胞中,碳原子位于立方体的8个顶点、6个面心以及晶胞内部,由“均摊法”可求出该晶胞中实际含有的碳原子数为_______ 。
(2)二氧化硅晶体

①每个硅原子与相邻的_______ 个氧原子以共价键相结合构成_______ 结构,硅原子在正四面体的中心,4个氧原子在正四面体的4个顶点。晶体中Si原子与O原子个数比为_______ 。
②每个Si原子与4个O原子成键,每个O原子与_______ 个Si原子成键,最小的环是_______ 元环。
③每个最小的环实际拥有的硅原子为_______ ,氧原子数为_______ 。
④1molSiO2晶体中含Si-O键数目为_______ ,在SiO2晶体中Si、O原子均采取_______ 杂化。
⑤SiO2具有许多重要用途,是制造水泥、玻璃、人造红宝石、单晶硅、硅光电池、芯片和光导纤维的原料。
(1)金刚石晶体



①在晶体中每个碳原子以
②晶体中C-C-C夹角为
③最小环上有
④晶体中碳原子个数与C-C键数之比为
⑤在一个晶胞中,碳原子位于立方体的8个顶点、6个面心以及晶胞内部,由“均摊法”可求出该晶胞中实际含有的碳原子数为
(2)二氧化硅晶体

①每个硅原子与相邻的
②每个Si原子与4个O原子成键,每个O原子与
③每个最小的环实际拥有的硅原子为
④1molSiO2晶体中含Si-O键数目为
⑤SiO2具有许多重要用途,是制造水泥、玻璃、人造红宝石、单晶硅、硅光电池、芯片和光导纤维的原料。
您最近一年使用:0次
3 . 观察对比晶体硅、碳化硅、二氧化硅的晶胞,并总结结构特征。_______ 。


您最近一年使用:0次
4 . 怎么从原子结构的角度理解金刚石、硅 、锗的熔点和硬度依次下降?_______ 。
您最近一年使用:0次
5 . “具有共价键的晶体叫做共价晶体”这种说法对吗?为什么?_______ 。
您最近一年使用:0次
6 . 分类:_______ 、_______ 、_______
您最近一年使用:0次
7 . 组成微粒:_______
您最近一年使用:0次
8 . 比较四种晶体的结构和性质。
类型 比较 | 分子晶体 | 原子晶体 | 金属晶体 | 离子晶体 |
| 构成粒子 | ||||
| 粒子间的相互作用力 | ||||
| 硬度 | ||||
| 熔、沸点 | ||||
| 溶解性 | ||||
| 导电、传热性 |
您最近一年使用:0次
2022-02-17更新
|
202次组卷
|
2卷引用:课前-3.3.2 离子晶体 过渡晶体与混合型晶体-人教版2019选择性必修2
9 . 分析第三周期前几种元素的氧化物中,化学键中离子键成分的百分数的变化趋势并解释其原因。进一步描述第三周期主族元素的氧化物的晶体类型的变化趋势_______ 。
| 氧化物 | Na2O | MgO | Al2O3 | SiO2 |
| 离子键的百分数/% | 62 | 50 | 41 | 33 |
您最近一年使用:0次



