解题方法
1 . 海水中蕴藏着丰富的化学资源,经加工处理可制取钠、氯气和溴等化学物质。
(1)将金属钠放入液氨中,钠沉入液氨底部。其中一部分钠与液氨反应:2Na+2NH3=2NaNH2+H2↑,并缓慢放出气泡;另一部分钠与液氨溶剂化,生成氨合钠离子[Na+(NH3)6]和氨合电子[e-(NH3)6],钠的溶剂化过程如图所示。

①密度:ρ(Na)___________ ρ(液氨)(填“>”“=”或“<”)。
②将2.3g钠投入液氨中,得到0.224L(标准状况下)H2.与液氨反应产生H2的钠和发生溶剂化作用的钠,两者物质的量之比为___________ 。
(2)工业上可用Cl2和NaOH溶液反应生产“84”消毒液,“84”消毒液中含有ClO-和Cl-。
①Cl2和NaOH溶液反应生成ClO-和Cl-的化学方程式为___________ 。
②“84”消毒液使用时不能与洁厕剂(成分为盐酸)混用,原因是这两种溶液混合时,___________ (填离子符号)在酸性条件下会反应产生Cl2。
(3)提取粗盐后的母液中含较高浓度的溴元素。某课外兴趣小组先将母液中的溴元素氧化成Br2,再获取液溴,流程如下:

①“萃取”时,使用一定体积的有机萃取剂。为提高Br2的萃取率,应采取的措施为___________ 。萃取后静置,进行___________ (填操作名称),可得到溴的有机溶液。
②“反萃取”时,Br2与Na2CO3溶液反应生成NaBrO3与NaBr。该反应生成的BrO 与Br-物质的量之比为
与Br-物质的量之比为___________ 。
(1)将金属钠放入液氨中,钠沉入液氨底部。其中一部分钠与液氨反应:2Na+2NH3=2NaNH2+H2↑,并缓慢放出气泡;另一部分钠与液氨溶剂化,生成氨合钠离子[Na+(NH3)6]和氨合电子[e-(NH3)6],钠的溶剂化过程如图所示。

①密度:ρ(Na)
②将2.3g钠投入液氨中,得到0.224L(标准状况下)H2.与液氨反应产生H2的钠和发生溶剂化作用的钠,两者物质的量之比为
(2)工业上可用Cl2和NaOH溶液反应生产“84”消毒液,“84”消毒液中含有ClO-和Cl-。
①Cl2和NaOH溶液反应生成ClO-和Cl-的化学方程式为
②“84”消毒液使用时不能与洁厕剂(成分为盐酸)混用,原因是这两种溶液混合时,
(3)提取粗盐后的母液中含较高浓度的溴元素。某课外兴趣小组先将母液中的溴元素氧化成Br2,再获取液溴,流程如下:

①“萃取”时,使用一定体积的有机萃取剂。为提高Br2的萃取率,应采取的措施为
②“反萃取”时,Br2与Na2CO3溶液反应生成NaBrO3与NaBr。该反应生成的BrO
 与Br-物质的量之比为
与Br-物质的量之比为
您最近一年使用:0次
名校
2 . 二硫化钼(MoS2,难溶于水)具有良好的光、电性能,可由钼精矿(主要含MoS2,还含NiS、CaMoO4等)为原料经过如下过程制得。
(1)“浸取”。向钼精矿中加入NaOH溶液,再加入NaClO溶液,充分反应后的溶液中含有Na2MoO4、Na2SO4、NiSO4、NaCl。
①写出浸取时MoS2发生反应的离子方程式:_______ 。
②浸取后的滤渣中含CaMoO4。若浸取时向溶液中加入Na2CO3溶液,可提高浸出液中Mo元素的含量,原因是_______ 。
③浸取时,Mo元素的浸出率与时间的变化如图1所示。已知生成物对反应无影响,则反应3~4min时,Mo元素的浸出率迅速上升的原因是_______ 。

(2)“制硫代钼酸铵[(NH4)2MoS4,摩尔质量260g•mol-1]”。向浸出液中加入NH4NO3和HNO3,析出(NH4)2Mo4O13,将(NH4)2Mo4O13溶于水,向其中加入(NH4)2S溶液,可得(NH4)2MoS4,写出生成(NH4)2MoS4反应的化学方程式:________ 。
(3)“制MoS2”。(NH4)2MoS4可通过如下两种方法制取MoS2:
方法一:将(NH4)2MoS4在一定条件下加热,可分解得到MoS2、NH3、H2S和硫单质。其中NH3、H2S和硫单质的物质的量之比为8:4:1。
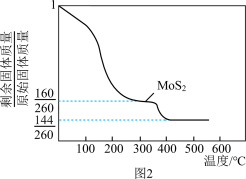
方法二:将(NH4)2MoS4在空气中加热可得MoS2,加热时所得剩余固体的质量与原始固体质量的比值与温度的关系如图2所示。
①方法一中,所得硫单质的分子式为_______ 。
②方法二中,500℃可得到Mo的一种氧化物,该氧化物的化学式为_______ 。
(1)“浸取”。向钼精矿中加入NaOH溶液,再加入NaClO溶液,充分反应后的溶液中含有Na2MoO4、Na2SO4、NiSO4、NaCl。
①写出浸取时MoS2发生反应的离子方程式:
②浸取后的滤渣中含CaMoO4。若浸取时向溶液中加入Na2CO3溶液,可提高浸出液中Mo元素的含量,原因是
③浸取时,Mo元素的浸出率与时间的变化如图1所示。已知生成物对反应无影响,则反应3~4min时,Mo元素的浸出率迅速上升的原因是

(2)“制硫代钼酸铵[(NH4)2MoS4,摩尔质量260g•mol-1]”。向浸出液中加入NH4NO3和HNO3,析出(NH4)2Mo4O13,将(NH4)2Mo4O13溶于水,向其中加入(NH4)2S溶液,可得(NH4)2MoS4,写出生成(NH4)2MoS4反应的化学方程式:
(3)“制MoS2”。(NH4)2MoS4可通过如下两种方法制取MoS2:
方法一:将(NH4)2MoS4在一定条件下加热,可分解得到MoS2、NH3、H2S和硫单质。其中NH3、H2S和硫单质的物质的量之比为8:4:1。
方法二:将(NH4)2MoS4在空气中加热可得MoS2,加热时所得剩余固体的质量与原始固体质量的比值与温度的关系如图2所示。

①方法一中,所得硫单质的分子式为
②方法二中,500℃可得到Mo的一种氧化物,该氧化物的化学式为
您最近一年使用:0次
2023-05-29更新
|
500次组卷
|
3卷引用:江苏省常州高级中学2023-2024学年高三上学期开学考试化学试题
名校
解题方法
3 . 为探索工业含铝、铁、铜合金废料的再利用,某同学实设计的回收利用方案如图:
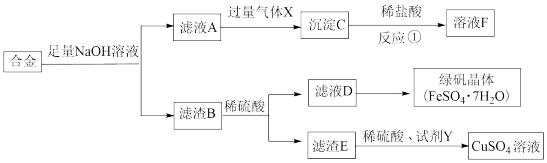
(1)气体X的化学式是_____ 。
(2)检验滤液D是否含有Fe3+的最佳试剂为_____ (填序号)。
(3)若要从滤液D得到绿矾晶体,必须进行的实验操作步骤:_____ 、冷却结晶、过滤、自然干燥。
(4)写出“滤液A”与“过量气体X”反应的离子方程式_____ 。
(5)浓硝酸可以溶解铜,也可以溶解上述合金。若固体未完全溶解,则滤液D中Fe元素将以_____ (填“Fe3+”或“Fe2+”)离子形式存在。

(1)气体X的化学式是
(2)检验滤液D是否含有Fe3+的最佳试剂为
| A.KMnO4 | B.NaOH | C.氯水 | D.KSCN |
(4)写出“滤液A”与“过量气体X”反应的离子方程式
(5)浓硝酸可以溶解铜,也可以溶解上述合金。若固体未完全溶解,则滤液D中Fe元素将以
您最近一年使用:0次
2022-12-13更新
|
213次组卷
|
2卷引用:四川省岳池中学2023-2024学年高一下学期开学考试化学试题
名校
4 . 某化学小组试利用废铝屑(含杂质铁)制备硫酸铝晶体,并对硫酸铝晶体进行热重分析,其主要实验流程如下:

(1)向溶液A中通入过量的CO2,发生反应的离子方程式为________________________ 。
(2) 操作II所包含的实验操作的名称依次为_________ 、冷却结晶、_____________ 、洗涤、干燥。
(3)若开始时称取的废铝屑的质量为5.00g,得到固体A的质量为0.95g,硫酸铝晶体的质量为49.95g(假设每一步的转化率均为100%),则所得硫酸铝晶体(含有结晶水)的化学式为_________________ 。
(4)取以上制得的硫酸铝晶体进行热重分析,其热分解主要分为三个阶段:第一阶段失重40.54%,第二阶段失重48.65%,第三阶段失重84.68%,以后不再失重。其热分解的曲线如下图所示。
已知:失重﹪= ×100%
×100%

则失重第一阶段的化学方程式为________________________ 。

(1)向溶液A中通入过量的CO2,发生反应的离子方程式为
(2) 操作II所包含的实验操作的名称依次为
(3)若开始时称取的废铝屑的质量为5.00g,得到固体A的质量为0.95g,硫酸铝晶体的质量为49.95g(假设每一步的转化率均为100%),则所得硫酸铝晶体(含有结晶水)的化学式为
(4)取以上制得的硫酸铝晶体进行热重分析,其热分解主要分为三个阶段:第一阶段失重40.54%,第二阶段失重48.65%,第三阶段失重84.68%,以后不再失重。其热分解的曲线如下图所示。
已知:失重﹪=
 ×100%
×100% 
则失重第一阶段的化学方程式为
您最近一年使用:0次
名校
解题方法
5 . 分铈、铬、钛、镍虽不是中学阶段常见的金属元素,但在工业生产中有着重要作用。
(1)二氧化铈 (CeO2)在平板电视显示屏中有着重要应用。CeO2在稀硫酸和H2O2的作用下可生成Ce3+,CeO2在该反应中作______ 剂。
(2)自然界Cr主要以+3价和+6价存在。+6价的Cr能引起细胞的突变,可以用亚硫酸钠将其还原为+3价的铬。完成并配平下列离子方程式:
_____ Cr2O72-+_____ SO32-+_____ =_____ Cr3++_____ SO42-+ _____ H2O
(3)钛(Ti)被誉为“二十一世纪的金属”,工业上在550℃时用钠与四氯化钛反应可制得钛,该反应的化学方程式是____ 。
(4)NiSO4·xH2O是一种绿色易溶于水的晶体,广泛用于镀镍、电池等,可由电镀渣(除镍外,还含有铜、锌、铁等元素)为原料获得。操作步骤如下:

①向滤液Ⅰ中加入FeS是为了除去Cu2+、Zn2+等杂质,除去Cu2+的离子方程式为__ 。
②对滤液Ⅱ先加H2O2再调pH,调pH的目的是_____ 。
③滤液Ⅲ溶质的主要成分是NiSO4,加Na2CO3过滤后,再加适量稀硫酸溶解又生成NiSO4,这两步操作的目的是_____ 。
(1)二氧化铈 (CeO2)在平板电视显示屏中有着重要应用。CeO2在稀硫酸和H2O2的作用下可生成Ce3+,CeO2在该反应中作
(2)自然界Cr主要以+3价和+6价存在。+6价的Cr能引起细胞的突变,可以用亚硫酸钠将其还原为+3价的铬。完成并配平下列离子方程式:
(3)钛(Ti)被誉为“二十一世纪的金属”,工业上在550℃时用钠与四氯化钛反应可制得钛,该反应的化学方程式是
(4)NiSO4·xH2O是一种绿色易溶于水的晶体,广泛用于镀镍、电池等,可由电镀渣(除镍外,还含有铜、锌、铁等元素)为原料获得。操作步骤如下:

①向滤液Ⅰ中加入FeS是为了除去Cu2+、Zn2+等杂质,除去Cu2+的离子方程式为
②对滤液Ⅱ先加H2O2再调pH,调pH的目的是
③滤液Ⅲ溶质的主要成分是NiSO4,加Na2CO3过滤后,再加适量稀硫酸溶解又生成NiSO4,这两步操作的目的是
您最近一年使用:0次
2016-12-09更新
|
748次组卷
|
4卷引用:2017届黑龙江牡丹江第一高级中学高三上开学摸底考试化学
6 . 氯化铁是常见的水处理剂,无水FeCl3 的熔点为282℃,沸点为315℃。工业上制备无水FeCl3 的一种工艺流程如下:

(1)氯化铁能用作水处理剂的原因是_________________ (用必要的文字和化学方程式说明)。
(2)吸收塔中吸收剂X 是_______ 。
(3)温度超过400℃时,捕集器中捕集到的物质的相对分子质量为325,该物质的分子式为________ 。
(4)从副产物FeCl3溶液中获得FeCl3·6H2O 的方法是在滴加浓盐酸后,________ 、________ 、过滤,洗涤、晾干。
(5)用FeCl3溶液(32%~35%)腐蚀印刷线路板的废液中含FeCl3、FeCl2和CuCl2。用化学方法回收废液中铜的方法是______________ (用反应式表示并简述操作要点)。

(1)氯化铁能用作水处理剂的原因是
(2)吸收塔中吸收剂X 是
(3)温度超过400℃时,捕集器中捕集到的物质的相对分子质量为325,该物质的分子式为
(4)从副产物FeCl3溶液中获得FeCl3·6H2O 的方法是在滴加浓盐酸后,
(5)用FeCl3溶液(32%~35%)腐蚀印刷线路板的废液中含FeCl3、FeCl2和CuCl2。用化学方法回收废液中铜的方法是
您最近一年使用:0次
10-11高一上·安徽宿州·阶段练习
名校
7 . 除去括号中杂质,写出所加试剂与反应的离子方程式。
(1)SO42-(CO32-),所加试剂:________ ,离子方程式_____________
(2)Cl-(SO42-),所加试剂:________ ,离子方程式________________
(3)Fe2+(Cu2+),所加试剂:________ ,离子方程式_______________
(4)BaCl2 (HCl ),所加试剂:________ ,离子方程式______________
(1)SO42-(CO32-),所加试剂:
(2)Cl-(SO42-),所加试剂:
(3)Fe2+(Cu2+),所加试剂:
(4)BaCl2 (HCl ),所加试剂:
您最近一年使用:0次
2010-12-27更新
|
882次组卷
|
3卷引用:湖北省武汉市第六中学2022-2023学年高一上学期9月入学第一次测试化学试题
湖北省武汉市第六中学2022-2023学年高一上学期9月入学第一次测试化学试题(已下线)2010年安徽省泗县双语中学高一上学期第三次月考化学试卷辽宁省盘锦市第二高级中学2019-2020学年高一上学期第一阶段考试化学试题



