名校
解题方法
1 . 工业上高炉炼铁产生的CO和CO2可以按如下流程脱除或利用。___________ 。
(2)煅烧产生的尾气可通过途径Ⅱ转化为CO2.。2分子氨和1分子CO2生产A,最终转化为尿素[CO(NH2)2];可通过途径Ⅲ转为b。
①下列说法正确的是___________ 。
A.黄铁(FeS2)可作为高炉炼铁的铁源
B.途径Ⅱ可通过实现反应转化MnO2+CO→CO2+Mn2O3
C.化合物A是一种盐
D.化合物B为CH3COONa
②尿素[CO(NH2)2]在较高温度下可以聚合成环状化合物三聚氰胺(C3H6N6),写出该反应的化学方程式___________ 。
(3)设计实验验证化合物A中含有N元素___________ ;写出实验过程中涉及的反应方程式___________ 。

已知: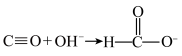 。请回答:
。请回答:
(2)煅烧产生的尾气可通过途径Ⅱ转化为CO2.。2分子氨和1分子CO2生产A,最终转化为尿素[CO(NH2)2];可通过途径Ⅲ转为b。
①下列说法正确的是
A.黄铁(FeS2)可作为高炉炼铁的铁源
B.途径Ⅱ可通过实现反应转化MnO2+CO→CO2+Mn2O3
C.化合物A是一种盐
D.化合物B为CH3COONa
②尿素[CO(NH2)2]在较高温度下可以聚合成环状化合物三聚氰胺(C3H6N6),写出该反应的化学方程式
(3)设计实验验证化合物A中含有N元素
您最近一年使用:0次
解题方法
2 . 某工厂废水中含有大量的FeSO4和较多的CuSO4。为制备晶体X并检验其部分性质,按如图流程进行相关实验:
②晶体X是一种含结晶水的化合物,制备X时加入的(NH4)2SO4与FeSO4溶液中溶质的物质的量相等。
(1)在制备晶体X的过程中,会使用少量酒精来洗涤晶体。其目的是_______ 。
(2)取少量铜粉加入浓盐酸中加热,铜粉溶解并生成H3[CuCl4],写出化学方程式_______ 。
(3)下列说法不正确 的是_______ (填字母)。
(4)取少量略变黄的绿矾溶于稀硫酸,请设计实验验证溶液中铁元素的存在形式_______ ;写出实验过程中所涉及的反应方程式_______ 。

②晶体X是一种含结晶水的化合物,制备X时加入的(NH4)2SO4与FeSO4溶液中溶质的物质的量相等。
(1)在制备晶体X的过程中,会使用少量酒精来洗涤晶体。其目的是
(2)取少量铜粉加入浓盐酸中加热,铜粉溶解并生成H3[CuCl4],写出化学方程式
(3)下列说法
| A.测得晶体X分子量为392,则其化学式可能为(NH4)2Fe(SO4)2•6H2O |
| B.晶体X中不含Fe3+,故不可以作净水剂和消毒剂 |
| C.晶体X比绿矾稳定的原因是(NH4)2SO4包裹在FeSO4外部,隔绝空气,防止Fe2+被氧化 |
| D.结合流程图信息,测定待测KMnO4溶液浓度时,用晶体X配标准液去滴定比绿矾误差更小 |
(4)取少量略变黄的绿矾溶于稀硫酸,请设计实验验证溶液中铁元素的存在形式
您最近一年使用:0次
3 . 纳米 被广泛用于结构陶瓷、催化材料等功能材料。某兴趣小组利用废弃的含有
被广泛用于结构陶瓷、催化材料等功能材料。某兴趣小组利用废弃的含有 的
的 溶液制备纳米
溶液制备纳米 :
: 与HCl、乙醚形成化合物
与HCl、乙醚形成化合物 而溶于乙醚,当盐酸浓度降低时,化合物解离。
而溶于乙醚,当盐酸浓度降低时,化合物解离。
请回答:
(1)煅烧过程盛放固体的仪器名称为_______ 。
(2)步骤Ⅳ中发生反应的离子方程式为______________ 。
(3)下列说法正确_______。
(4)市售PAC是由 水解产生的一系列中间产物脱水聚合而成,其中稳定存在形态为聚十三铝
水解产生的一系列中间产物脱水聚合而成,其中稳定存在形态为聚十三铝 ,简称
,简称 。
。 含量的高低直接影响PAC的净水效能。向
含量的高低直接影响PAC的净水效能。向 溶液中缓慢滴加一定量NaOH溶液,若只生成
溶液中缓慢滴加一定量NaOH溶液,若只生成 ,则理论上
,则理论上
_______ 。
(5)设计如下实验过程测定溶液Ⅲ中的 的浓度:
的浓度: 的浓度,会使结果
的浓度,会使结果_______ (填“偏高”、“偏低”或“不变”)。
②虚线框内操作可以用下列操作_______ 代替。
 被广泛用于结构陶瓷、催化材料等功能材料。某兴趣小组利用废弃的含有
被广泛用于结构陶瓷、催化材料等功能材料。某兴趣小组利用废弃的含有 的
的 溶液制备纳米
溶液制备纳米 :
:
 与HCl、乙醚形成化合物
与HCl、乙醚形成化合物 而溶于乙醚,当盐酸浓度降低时,化合物解离。
而溶于乙醚,当盐酸浓度降低时,化合物解离。请回答:
(1)煅烧过程盛放固体的仪器名称为
(2)步骤Ⅳ中发生反应的离子方程式为
(3)下列说法正确_______。
| A.步骤Ⅱ的试剂X可用水,步骤Ⅲ的操作B是蒸馏 |
B.纳米 属于离子晶体,熔点高于大块 属于离子晶体,熔点高于大块 晶体 晶体 |
C.步骤Ⅰ,若在溶液Ⅱ中检测到 ,需再次萃取 ,需再次萃取 |
D. 中,仅阴离子中存在配位键 中,仅阴离子中存在配位键 |
(4)市售PAC是由
 水解产生的一系列中间产物脱水聚合而成,其中稳定存在形态为聚十三铝
水解产生的一系列中间产物脱水聚合而成,其中稳定存在形态为聚十三铝 ,简称
,简称 。
。 含量的高低直接影响PAC的净水效能。向
含量的高低直接影响PAC的净水效能。向 溶液中缓慢滴加一定量NaOH溶液,若只生成
溶液中缓慢滴加一定量NaOH溶液,若只生成 ,则理论上
,则理论上
(5)设计如下实验过程测定溶液Ⅲ中的
 的浓度:
的浓度:
 的浓度,会使结果
的浓度,会使结果②虚线框内操作可以用下列操作
A. 
B.
C. 
D.
您最近一年使用:0次
4 . 碘化锡(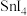 )主要用于制造有机锡配合物。某小组利用单质锡和碘制备碘化锡,其主要实验流程如下(反应装置见下图,夹持仪器略去):
)主要用于制造有机锡配合物。某小组利用单质锡和碘制备碘化锡,其主要实验流程如下(反应装置见下图,夹持仪器略去):
②碘化锡在丙酮和热的石油醚中溶解度较大,在冷的石油醚中溶解度小。
③石油醚的沸点为60~90℃,碘单质的升华温度为45~77℃。
请回答:
(1)反应装置中仪器X的名称是___________ 。
(2)下列说法不正确的是___________。
(3)反应装置中,为使紫色碘蒸气上升不高于冷凝管的中间部位,可采取的措施是___________ 。判断“反应装置”中的反应已完全的实验现象是___________ 。
(4)步骤 ,圆底烧瓶中还附着四碘化锡晶体,处理的方法是
,圆底烧瓶中还附着四碘化锡晶体,处理的方法是___________ 。
(5)产品中的杂质可以进一步采用重结晶法提纯。请从下列选项中选择最佳选项并进行排序。___________
取碘化锡样品放入烧杯中→___________→___________→___________
a.加入适量的热水
b.加入适量的热的石油醚
c.用冷水浴冷却结晶
d.趁热过滤
e.加入适量的冷的石油醚
(6)该小组对制备的碘化锡产品进行性质和组成上的研究。
①取适量的产品溶解在2mL丙酮中配成溶液,再加入1ml蒸馏水,产生白色无定型沉淀,写出反应的化学方程式___________ 。
②本实验可以通过测定某些物理量来确定碘化锡的化学式,需测定的物理量有___________ 。
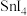 )主要用于制造有机锡配合物。某小组利用单质锡和碘制备碘化锡,其主要实验流程如下(反应装置见下图,夹持仪器略去):
)主要用于制造有机锡配合物。某小组利用单质锡和碘制备碘化锡,其主要实验流程如下(反应装置见下图,夹持仪器略去):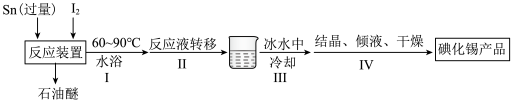
②碘化锡在丙酮和热的石油醚中溶解度较大,在冷的石油醚中溶解度小。
③石油醚的沸点为60~90℃,碘单质的升华温度为45~77℃。
请回答:
(1)反应装置中仪器X的名称是
(2)下列说法不正确的是___________。
| A.将锡片剪成细小碎片、碘磨细的原因是充分反应,同时提高反应速率 |
| B.仪器X的作用是吸收石油醚,防止石油醚扩散到空气中 |
C.步骤 可以不转移反应液,直接在原反应装置(圆底烧瓶)中进行后续操作 可以不转移反应液,直接在原反应装置(圆底烧瓶)中进行后续操作 |
D.步骤 采用蒸发结晶比冷却结晶更好 采用蒸发结晶比冷却结晶更好 |
(3)反应装置中,为使紫色碘蒸气上升不高于冷凝管的中间部位,可采取的措施是
(4)步骤
 ,圆底烧瓶中还附着四碘化锡晶体,处理的方法是
,圆底烧瓶中还附着四碘化锡晶体,处理的方法是(5)产品中的杂质可以进一步采用重结晶法提纯。请从下列选项中选择最佳选项并进行排序。
取碘化锡样品放入烧杯中→___________→___________→___________
a.加入适量的热水
b.加入适量的热的石油醚
c.用冷水浴冷却结晶
d.趁热过滤
e.加入适量的冷的石油醚
(6)该小组对制备的碘化锡产品进行性质和组成上的研究。
①取适量的产品溶解在2mL丙酮中配成溶液,再加入1ml蒸馏水,产生白色无定型沉淀,写出反应的化学方程式
②本实验可以通过测定某些物理量来确定碘化锡的化学式,需测定的物理量有
您最近一年使用:0次
解题方法
5 . 斑铜矿(主要成分是Cu5FeS4,含少量SiO2)是自然界中最丰富的含铜矿物之一,以斑铜矿为原料可实现如下转化。
②Cu+酸性条件发生自身氧化还原反应生成Cu2+和Cu。
③ 加热时易失去NH3。
加热时易失去NH3。
请回答:
(1)①溶液A中加试剂X可实现FeCl3的循环利用,则试剂X是_______ 。
②固体C可通过溶解、过滤、蒸馏等操作分离出硫单质,溶解时最适宜的溶剂为_______ 。
A.水 B.NaOH溶液 C.CS2 D.酒精
(2)步骤Ⅱ需快速将固体B投入到NaCl溶液中,原因是_______ 。
(3)写出溶液D中的所有阳离子_______ 。
(4)写出反应I的离子方程式_______ 。
(5)将斑铜矿在有氧条件下用氨水浸出,可制得 晶体,反应原理为
晶体,反应原理为 (未配平)。设计由浸出液制取
(未配平)。设计由浸出液制取 晶体的实验方案:
晶体的实验方案:_______ 。

②Cu+酸性条件发生自身氧化还原反应生成Cu2+和Cu。
③
 加热时易失去NH3。
加热时易失去NH3。请回答:
(1)①溶液A中加试剂X可实现FeCl3的循环利用,则试剂X是
②固体C可通过溶解、过滤、蒸馏等操作分离出硫单质,溶解时最适宜的溶剂为
A.水 B.NaOH溶液 C.CS2 D.酒精
(2)步骤Ⅱ需快速将固体B投入到NaCl溶液中,原因是
(3)写出溶液D中的所有阳离子
(4)写出反应I的离子方程式
(5)将斑铜矿在有氧条件下用氨水浸出,可制得
 晶体,反应原理为
晶体,反应原理为 (未配平)。设计由浸出液制取
(未配平)。设计由浸出液制取 晶体的实验方案:
晶体的实验方案:
您最近一年使用:0次
6 . 某固态化合物Y的组成为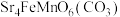 ,以Y为原料可实现如下转化:
,以Y为原料可实现如下转化: 均不能形成配合物。请回答:
均不能形成配合物。请回答:
(1)写出溶液C中的所有阳离子____________ 。
(2)步骤V中的反应为 ,请说明
,请说明 能够较完全转化为
能够较完全转化为 的两个原因是:①生成
的两个原因是:①生成 降低了体系的能量;②
降低了体系的能量;②____________ 。
(3)下列说法正确的是____________。
(4)固体Y可与 溶液反应,写出该反应的离子方程式
溶液反应,写出该反应的离子方程式____________ 。
(5)设计实验方案检验气体中除 以外的两种主要成分
以外的两种主要成分____________ 。
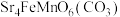 ,以Y为原料可实现如下转化:
,以Y为原料可实现如下转化:
 均不能形成配合物。请回答:
均不能形成配合物。请回答:(1)写出溶液C中的所有阳离子
(2)步骤V中的反应为
 ,请说明
,请说明 能够较完全转化为
能够较完全转化为 的两个原因是:①生成
的两个原因是:①生成 降低了体系的能量;②
降低了体系的能量;②(3)下列说法正确的是____________。
A.固体B中含有 单质 单质 |
B.步骤Ⅱ反应促进了 水解平衡正向移动 水解平衡正向移动 |
C.步骤Ⅲ可推断碱性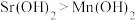 |
D.直接加热 不能得到 不能得到 |
(4)固体Y可与
 溶液反应,写出该反应的离子方程式
溶液反应,写出该反应的离子方程式(5)设计实验方案检验气体中除
 以外的两种主要成分
以外的两种主要成分
您最近一年使用:0次
2024-05-12更新
|
320次组卷
|
3卷引用:浙江省Lambda联盟2023-2024学年高三下学期第一次联考化学试题
名校
解题方法
7 . 聚合硫酸铝铁(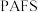 )是一种高效净水剂,广泛应用于饮用水处理、工业废水处理和污水处理。它能有效去除悬浊物、胶体颗粒、重金属、氨氨、有机物和色度等污染物,提高水质,保护环境。它的生产可以利用硫铁矿烧渣(主要成分为
)是一种高效净水剂,广泛应用于饮用水处理、工业废水处理和污水处理。它能有效去除悬浊物、胶体颗粒、重金属、氨氨、有机物和色度等污染物,提高水质,保护环境。它的生产可以利用硫铁矿烧渣(主要成分为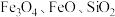 等)和粉煤灰(主要成分为
等)和粉煤灰(主要成分为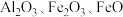 等),经过一系列的反应制得,具体流程如下:
等),经过一系列的反应制得,具体流程如下:___________ (填序号)。
A.降低温度 B.烧渣粉碎 C.适当提高硫酸浓度 D.加水稀释
“酸溶”后得到的溶液中,主要存在的金属阳离子有___________ (填化学符号)。
(2)检验“氧化”后溶液中金属阳离子的方法是___________ 。
(3)实验测得“氧化”过程中温度过高氧化效率会下降,原因可能是___________ 。
(4)“酸溶”过程中发生反应的离子方程式为___________ 。
(5)滤渣Ⅱ中可以循环利用的物质是___________ (填化学式)。
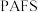 )是一种高效净水剂,广泛应用于饮用水处理、工业废水处理和污水处理。它能有效去除悬浊物、胶体颗粒、重金属、氨氨、有机物和色度等污染物,提高水质,保护环境。它的生产可以利用硫铁矿烧渣(主要成分为
)是一种高效净水剂,广泛应用于饮用水处理、工业废水处理和污水处理。它能有效去除悬浊物、胶体颗粒、重金属、氨氨、有机物和色度等污染物,提高水质,保护环境。它的生产可以利用硫铁矿烧渣(主要成分为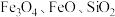 等)和粉煤灰(主要成分为
等)和粉煤灰(主要成分为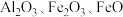 等),经过一系列的反应制得,具体流程如下:
等),经过一系列的反应制得,具体流程如下: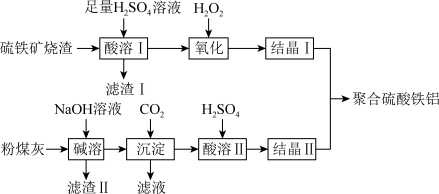
A.降低温度 B.烧渣粉碎 C.适当提高硫酸浓度 D.加水稀释
“酸溶”后得到的溶液中,主要存在的金属阳离子有
(2)检验“氧化”后溶液中金属阳离子的方法是
(3)实验测得“氧化”过程中温度过高氧化效率会下降,原因可能是
(4)“酸溶”过程中发生反应的离子方程式为
(5)滤渣Ⅱ中可以循环利用的物质是
您最近一年使用:0次
2024-04-24更新
|
200次组卷
|
2卷引用:2024届浙江省舟山中学高三下学期模拟预测化学试题
8 . 黄铜矿的主要成分为 ,以
,以 为原料实现如下转化。
为原料实现如下转化。
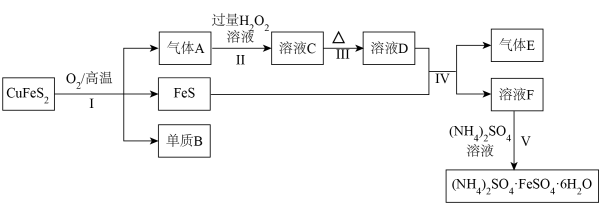
请回答:
(1)步骤Ⅰ的化学方程式是__________ 。
步骤Ⅲ的目的是__________ 。
步骤Ⅴ的操作是蒸发浓缩、冷却结晶,据此可以推测F的溶质、 和
和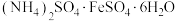 中溶解度最小的是
中溶解度最小的是__________ 。
(2)下列说法正确的是__________。
(3)设计实验方案证明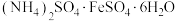 中金属阳离子
中金属阳离子__________ 。
 ,以
,以 为原料实现如下转化。
为原料实现如下转化。
请回答:
(1)步骤Ⅰ的化学方程式是
步骤Ⅲ的目的是
步骤Ⅴ的操作是蒸发浓缩、冷却结晶,据此可以推测F的溶质、
 和
和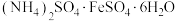 中溶解度最小的是
中溶解度最小的是(2)下列说法正确的是__________。
| A.气体A是常见的漂白剂 |
| B.单质B和溶液C不能发生反应 |
C.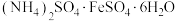 可以用作污水处理的混凝剂 可以用作污水处理的混凝剂 |
| D.气体E的水溶液在空气中长期放置易变质 |
(3)设计实验方案证明
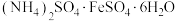 中金属阳离子
中金属阳离子
您最近一年使用:0次
2024-04-18更新
|
283次组卷
|
3卷引用:浙江绍兴市2023-2024学年高三下学期选考科目适应性考试化学试题
9 . 半水煤气(含有 、
、 、
、 、
、 ,以及少量的
,以及少量的 、
、 和
和 )经提纯后可获得工业合成氨所需的
)经提纯后可获得工业合成氨所需的 和
和 混合气。过程如下:
混合气。过程如下:
 。
。
② 与
与 反应的方程式为:
反应的方程式为: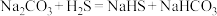 。
。
③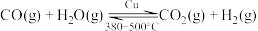
 。请回答:
。请回答:
(1)半水煤气通过___________ 溶液(填化学式)可证明有 气体。
气体。
(2)在“催化转化炉”的后半段补充通入 作“冷激气”,原因是
作“冷激气”,原因是___________ 。
(3)已知:高压下 极易溶于水;用醋酸亚铜氨溶液(易被氧化)溶液可吸收
极易溶于水;用醋酸亚铜氨溶液(易被氧化)溶液可吸收 ,碱性焦没食子酸溶液(易受酸性气体影响)可吸收
,碱性焦没食子酸溶液(易受酸性气体影响)可吸收 。“精制过程”需除去混合气体中的
。“精制过程”需除去混合气体中的 、
、 、
、 和
和 ,请排序
,请排序___________ : ___________ ___________
___________ ___________
___________ ___________。
___________。
(4)通过测定“催化转化炉”进出口气体中 体积分数以确定
体积分数以确定 转化率。取标况下
转化率。取标况下 进口或出口气体,经历的实验过程以及反应前后每个装置的质量变化(
进口或出口气体,经历的实验过程以及反应前后每个装置的质量变化(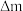 )如下:
)如下:___________
② 体积分数为
体积分数为___________ (用含 及
及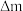 的式子表示,忽略空气影响)。
的式子表示,忽略空气影响)。
(5)下列说法正确的是___________
 、
、 、
、 、
、 ,以及少量的
,以及少量的 、
、 和
和 )经提纯后可获得工业合成氨所需的
)经提纯后可获得工业合成氨所需的 和
和 混合气。过程如下:
混合气。过程如下:

 。
。②
 与
与 反应的方程式为:
反应的方程式为: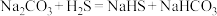 。
。③
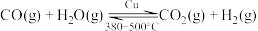
 。请回答:
。请回答:(1)半水煤气通过
 气体。
气体。(2)在“催化转化炉”的后半段补充通入
 作“冷激气”,原因是
作“冷激气”,原因是(3)已知:高压下
 极易溶于水;用醋酸亚铜氨溶液(易被氧化)溶液可吸收
极易溶于水;用醋酸亚铜氨溶液(易被氧化)溶液可吸收 ,碱性焦没食子酸溶液(易受酸性气体影响)可吸收
,碱性焦没食子酸溶液(易受酸性气体影响)可吸收 。“精制过程”需除去混合气体中的
。“精制过程”需除去混合气体中的 、
、 、
、 和
和 ,请排序
,请排序 ___________
___________ ___________
___________ ___________。
___________。
|
|
|
|
| (a) | (b) | (c) | (d) |
(4)通过测定“催化转化炉”进出口气体中
 体积分数以确定
体积分数以确定 转化率。取标况下
转化率。取标况下 进口或出口气体,经历的实验过程以及反应前后每个装置的质量变化(
进口或出口气体,经历的实验过程以及反应前后每个装置的质量变化(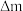 )如下:
)如下:
②
 体积分数为
体积分数为 及
及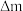 的式子表示,忽略空气影响)。
的式子表示,忽略空气影响)。(5)下列说法正确的是___________
A.“煤气发生炉”应先通 后通 后通 |
B.采用饱和 溶液吸收 溶液吸收 会造成管道堵塞 会造成管道堵塞 |
C.吸收塔内放置空心瓷环可提高 的吸收率 的吸收率 |
D.半水煤气中的 会导致 会导致 催化剂失效 催化剂失效 |
您最近一年使用:0次
2024-04-15更新
|
253次组卷
|
2卷引用:浙江省金华市十校2023-2024学年高三下学期4月模拟考试化学试题
解题方法
10 . 过氧化钙( )微溶于水,碱性条件下较稳定,可作为医用防腐剂和消毒剂,也可作为改良剂为农业、园艺和生物技术应用提供氧气。以下是一种实验室制备较高纯度过氧化钙的流程图:
)微溶于水,碱性条件下较稳定,可作为医用防腐剂和消毒剂,也可作为改良剂为农业、园艺和生物技术应用提供氧气。以下是一种实验室制备较高纯度过氧化钙的流程图: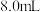 盐酸,所用的仪器是___________。
盐酸,所用的仪器是___________。
(2)下列说法正确的是___________。
(3)写出步骤Ⅲ发生反应的化学方程式___________ ,步骤Ⅲ采用冰水浴可提高产率,其原因有(回答两点)___________ 。
(4)准确称取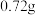 产品配成
产品配成 溶液。取
溶液。取 溶液,加入
溶液,加入 醋酸溶液和2-3滴
醋酸溶液和2-3滴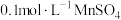 溶液,用
溶液,用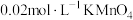 标准溶液滴定至浅红色,半分钟不褪色;平行测定3次,消耗
标准溶液滴定至浅红色,半分钟不褪色;平行测定3次,消耗 标准溶液的平均值为
标准溶液的平均值为 。
。
① 溶液的作用是
溶液的作用是___________ 。
② 的纯度为
的纯度为___________ 。
 )微溶于水,碱性条件下较稳定,可作为医用防腐剂和消毒剂,也可作为改良剂为农业、园艺和生物技术应用提供氧气。以下是一种实验室制备较高纯度过氧化钙的流程图:
)微溶于水,碱性条件下较稳定,可作为医用防腐剂和消毒剂,也可作为改良剂为农业、园艺和生物技术应用提供氧气。以下是一种实验室制备较高纯度过氧化钙的流程图:
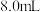 盐酸,所用的仪器是___________。
盐酸,所用的仪器是___________。A. 量筒 量筒 | B. 量筒 量筒 |
C. 碱式滴定管 碱式滴定管 | D. 烧杯 烧杯 |
(2)下列说法正确的是___________。
| A.步骤I中应使用过量的盐酸,以提高碳酸钙的利用率 |
| B.步骤Ⅱ中的煮沸操作的主要目的是加快反应速率 |
| C.步骤Ⅲ中的混合操作,应将氯化钙溶液滴入氨水-双氧水混合液中 |
| D.步骤V中可用冰水洗涤 |
(3)写出步骤Ⅲ发生反应的化学方程式
(4)准确称取
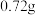 产品配成
产品配成 溶液。取
溶液。取 溶液,加入
溶液,加入 醋酸溶液和2-3滴
醋酸溶液和2-3滴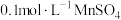 溶液,用
溶液,用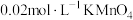 标准溶液滴定至浅红色,半分钟不褪色;平行测定3次,消耗
标准溶液滴定至浅红色,半分钟不褪色;平行测定3次,消耗 标准溶液的平均值为
标准溶液的平均值为 。
。①
 溶液的作用是
溶液的作用是②
 的纯度为
的纯度为
您最近一年使用:0次