名校
解题方法
1 . 利用废旧铁铜粉可以制备补血剂原料碳酸亚铁和杀菌剂胆矾。流程如下图所示:

(1)“滤液1”中一定含有的金属阳离子________ ,写出检验该金属阳离子的方法_________ 。
(2)写出“沉淀”过程中发生反应的离子方程式___________ 。
(3)向 固体中加入热蒸馏水,固体未见明显减少,一段时间后,难溶物上方出现红褐色氢氧化物并有气泡产生。试写出所发生的化学方程式
固体中加入热蒸馏水,固体未见明显减少,一段时间后,难溶物上方出现红褐色氢氧化物并有气泡产生。试写出所发生的化学方程式___________ 。
(4)“溶解1”过程温度不宜过高的原因是___________ 。
(5)胆矾结晶水测定:称量干燥坩埚的质量为 ,加入胆矾后总质量为
,加入胆矾后总质量为 ,将坩埚加热至胆矾全部变为白色,置于干燥器中冷至室温后称量,重复上述操作,最终总质量恒定为
,将坩埚加热至胆矾全部变为白色,置于干燥器中冷至室温后称量,重复上述操作,最终总质量恒定为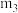 。根据实验数据,胆矾分子中结晶水的个数为
。根据实验数据,胆矾分子中结晶水的个数为___________ (写表达式),下列操作中,会导致结晶水数目测定值偏高的是___________ 。
A.胆矾未充分干燥 B.坩埚未置于干燥器中冷却 C.加热时有少胆矾迸溅出来

(1)“滤液1”中一定含有的金属阳离子
(2)写出“沉淀”过程中发生反应的离子方程式
(3)向
 固体中加入热蒸馏水,固体未见明显减少,一段时间后,难溶物上方出现红褐色氢氧化物并有气泡产生。试写出所发生的化学方程式
固体中加入热蒸馏水,固体未见明显减少,一段时间后,难溶物上方出现红褐色氢氧化物并有气泡产生。试写出所发生的化学方程式(4)“溶解1”过程温度不宜过高的原因是
(5)胆矾结晶水测定:称量干燥坩埚的质量为
 ,加入胆矾后总质量为
,加入胆矾后总质量为 ,将坩埚加热至胆矾全部变为白色,置于干燥器中冷至室温后称量,重复上述操作,最终总质量恒定为
,将坩埚加热至胆矾全部变为白色,置于干燥器中冷至室温后称量,重复上述操作,最终总质量恒定为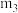 。根据实验数据,胆矾分子中结晶水的个数为
。根据实验数据,胆矾分子中结晶水的个数为A.胆矾未充分干燥 B.坩埚未置于干燥器中冷却 C.加热时有少胆矾迸溅出来
您最近一年使用:0次
2 . 钼酸钠晶体(Na2MoO4·2H2O)常用于配制金属缓蚀剂。下图是利用钼精矿(主要成分是MoS2含少量PbS等)为原料生产钼酸钠晶体的工艺流程图。

回答下列问题:
(1)Na2MoO4·2H2O中钼元素的化合价是________ ;
(2)“焙烧”反应为2MoS2+7O2 2MoO3+4SO2,该反应氧化产物是
2MoO3+4SO2,该反应氧化产物是_______ (填化学式),写出一条提高焙烧效率的措施_______________ 。
(3)“浸取”时含钼化合物发生反应的离子方程式为______________ 。
(4)“结晶”前需向滤液中加入Ba(OH)2固体以除去CO 。若滤液中(MoO
。若滤液中(MoO )=0.40mol/L,c(CO
)=0.40mol/L,c(CO )=0.20mol/L,要使钼元素无损失,残余CO
)=0.20mol/L,要使钼元素无损失,残余CO 的最低浓度是
的最低浓度是___ mol/L[已知:Ksp(BaCO3)=1×10-9、Ksp(BaMoO4)=4.0×10-8;
(5)将粗品进一步提纯的操作名称是__________ 。
(6)钼酸钠也可用钼酸铵[(NH4)2MoO4]和适量热的纯碱反应来制取,反应后溶液中只含钼酸钠从而有利于提纯。该反应的化学方程式为_________ 。
(7)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在缓蚀剂中的腐蚀速率实验结果如图所示。
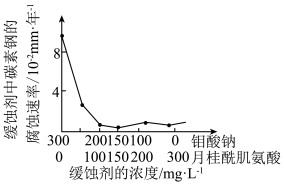
要使碳素钢的缓蚀效果最好,缓蚀剂中钼酸钠(摩尔质量为M)的物质的量浓度为___ mol/L。

回答下列问题:
(1)Na2MoO4·2H2O中钼元素的化合价是
(2)“焙烧”反应为2MoS2+7O2
 2MoO3+4SO2,该反应氧化产物是
2MoO3+4SO2,该反应氧化产物是(3)“浸取”时含钼化合物发生反应的离子方程式为
(4)“结晶”前需向滤液中加入Ba(OH)2固体以除去CO
 。若滤液中(MoO
。若滤液中(MoO )=0.40mol/L,c(CO
)=0.40mol/L,c(CO )=0.20mol/L,要使钼元素无损失,残余CO
)=0.20mol/L,要使钼元素无损失,残余CO 的最低浓度是
的最低浓度是(5)将粗品进一步提纯的操作名称是
(6)钼酸钠也可用钼酸铵[(NH4)2MoO4]和适量热的纯碱反应来制取,反应后溶液中只含钼酸钠从而有利于提纯。该反应的化学方程式为
(7)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在缓蚀剂中的腐蚀速率实验结果如图所示。

要使碳素钢的缓蚀效果最好,缓蚀剂中钼酸钠(摩尔质量为M)的物质的量浓度为
您最近一年使用:0次
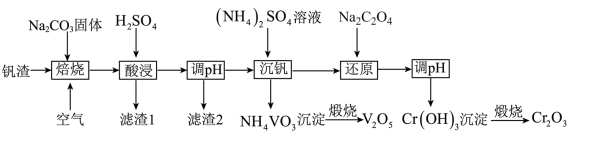
3 . 某高铬型钒渣含Fe2O3、Fe3O4、SiO2、Al2O3、V2O5、Cr2O3等物质,从中分离提取钒和铬的工艺流程如图所示:
(1)“焙烧”时V2O5、Cr2O3转化为NaVO3和Na2CrO4,SiO2、Al2O3转化为________ 和_______ 。
(2)滤渣1中主要含______ 。 滤渣2的主要成分是Fe(OH)3和Al(OH)3,对应调pH应不低于______ 。(常温下,当溶液中离子浓度小于1×10-5mol/L时认为沉淀完全, Ksp[Fe(OH)3]=4.0×10-38、Ksp[Al(OH)3]=1.0×10-33)。
(3)“沉钒”时的离子方程式是_______ ,NH4VO3煅烧过程中的化学方程式是______ 。
(4)“还原”时溶液的pH在2.5左右,反应的离子方程式是________ 。
(5)已知:25 °C时,H2C2O4的电离常数Ka1=5.9×10-2,Ka2=6. 4×10-5,则25° C时,0.1 mol·L-1NaHC2O4溶液中各离子浓度由大到小的顺序为_____ ,向0.1 mol· L-1H2C2O4溶液中加入一定的NaOH固体,当溶液的pH= 2.5时,溶液中c(C2O42-) :c(H2C2O4)=_______ (保留两位有效数字)。
(1)“焙烧”时V2O5、Cr2O3转化为NaVO3和Na2CrO4,SiO2、Al2O3转化为
(2)滤渣1中主要含
(3)“沉钒”时的离子方程式是
(4)“还原”时溶液的pH在2.5左右,反应的离子方程式是
(5)已知:25 °C时,H2C2O4的电离常数Ka1=5.9×10-2,Ka2=6. 4×10-5,则25° C时,0.1 mol·L-1NaHC2O4溶液中各离子浓度由大到小的顺序为
您最近一年使用:0次



