1 . 以硫铁矿(主要成分为FeS2)为原料制备硫酸亚铁晶体(FeSO4∙7H2O)的工艺流程如下:
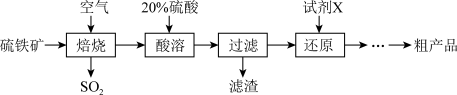
(1)已知焙烧后得到的固体主要成分为Fe2O3。写出焙烧过程主要反应的化学方程式________ 。若生成5.12g的SO2,则反应中转移电子的物质的量为___________ 。
(2)试剂X是(写化学式)____________ 。
(3)可用标准的酸性高锰酸钾溶液测定产品中FeSO4的纯度,反应的离子方程式为:___________ 。
(4)工业上还可在硫杆菌的催化作用下,能利用空气中的氧气将FeS2氧化为Fe2(SO4)3,并使溶液酸性增强。该过程反应的离子方程式为____________ 。
(5)将8.34g FeSO4·7H2O晶体隔绝空气加热,晶体受热脱水过程的热重曲线(固体质量随温度变化的曲线)如图所示。
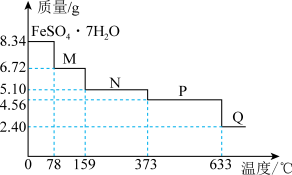
①在隔绝空气条件下,N得到P的化学方程式为________________ 。
②温度为633℃时固体物质Q的化学式为___________ 。

(1)已知焙烧后得到的固体主要成分为Fe2O3。写出焙烧过程主要反应的化学方程式
(2)试剂X是(写化学式)
(3)可用标准的酸性高锰酸钾溶液测定产品中FeSO4的纯度,反应的离子方程式为:
(4)工业上还可在硫杆菌的催化作用下,能利用空气中的氧气将FeS2氧化为Fe2(SO4)3,并使溶液酸性增强。该过程反应的离子方程式为
(5)将8.34g FeSO4·7H2O晶体隔绝空气加热,晶体受热脱水过程的热重曲线(固体质量随温度变化的曲线)如图所示。

①在隔绝空气条件下,N得到P的化学方程式为
②温度为633℃时固体物质Q的化学式为
您最近一年使用:0次
名校
2 . 某兴趣小组用部分氧化的FeSO4为原料,制取高纯度的Fe2O3。主要操作步骤如下:
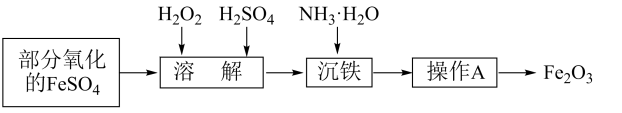
(1)在溶解过程中,H2O2做氧化剂,试写出加入H2O2发生反应的离子方程式___________ ;
(2)简述检验溶解过程中Fe2+是否已被完全氧化成Fe3+的实验操作:___________ (可供选择的试剂:酸性KMnO4溶液、KSCN溶液、氯水)。
(3)“沉铁”过程中产生红褐色沉淀,试写出相关的化学方程式___________ ;
(4)操作A包括___________ 、洗涤、___________ ;写出操作A中发生反应的化学方程式___________ 。

(1)在溶解过程中,H2O2做氧化剂,试写出加入H2O2发生反应的离子方程式
(2)简述检验溶解过程中Fe2+是否已被完全氧化成Fe3+的实验操作:
(3)“沉铁”过程中产生红褐色沉淀,试写出相关的化学方程式
(4)操作A包括
您最近一年使用:0次
3 . 铁是目前用途最广,用量最大的金属。运用所学知识,回答下列问题。
(1)鉴别Fe(OH)3胶体和FeCl3溶液的方法是_____________________ 。
(2)电子工业用FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:________________________ 。
(3)工程师欲从制造印刷电路板的废水中回收铜,并获得FeCl3溶液,设计如下方案:

①滤渣C的化学式为____________ ;
②试剂F宜选用______ (填选项序号),通入F的目的是_______________ ;
A.酸性KMnO4溶液 B.氯水 C.溴水
(4)某研究性学习小组为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:
①取少量待测溶液,滴入KSCN溶液呈红色,则待测液中含有的金属阳离子是________ ;②溶液组成的测定:取30.0mL待测溶液,加入足量的AgNO3溶液,得25.83g白色沉淀。则溶液中c(Cl-)=__________ 。
(1)鉴别Fe(OH)3胶体和FeCl3溶液的方法是
(2)电子工业用FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:
(3)工程师欲从制造印刷电路板的废水中回收铜,并获得FeCl3溶液,设计如下方案:

①滤渣C的化学式为
②试剂F宜选用
A.酸性KMnO4溶液 B.氯水 C.溴水
(4)某研究性学习小组为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:
①取少量待测溶液,滴入KSCN溶液呈红色,则待测液中含有的金属阳离子是
您最近一年使用:0次
2016-12-09更新
|
219次组卷
|
2卷引用:2014-2015福建省八县一中高一上学期期末考试化学试卷
21-22高一上·江苏苏州·期中
名校
4 . 碘是人体不可缺少的微量元素,也是制造各种无机及有机碘化物的重要原料,利用卤水(含有I-)可提取碘。
(1)采用离子交换法从卤水中提取碘的工艺流程如下:
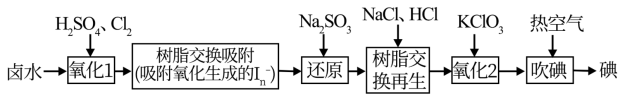
①工业上获取氯气的方法为(用化学方程式表示)___________ 。
②“氧化1”中生成I ,其反应的离子方程式为
,其反应的离子方程式为___________ 。
③“还原”中溶液里含有SO ,检验SO
,检验SO 的实验操作是
的实验操作是___________ 。
④“吹碘”中通入热空气,利用了碘具有___________ 的性质。
(2)某实验小组采用如图所示装置、40℃水浴加热制取碘。
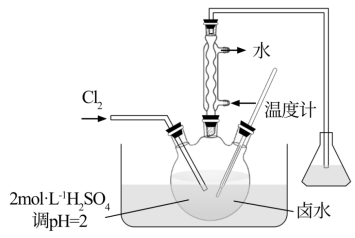
实验过程中需要控制Cl2用量,否则酸性条件下过量Cl2能将I2进一步氧化成IO 。请补充完整检验反应后的三颈烧瓶中溶液是否含有IO
。请补充完整检验反应后的三颈烧瓶中溶液是否含有IO 的实验方案:取适量三颈烧瓶中的溶液,
的实验方案:取适量三颈烧瓶中的溶液,___________ 。已知反应:IO +5I-+6H+=3I2+3H2O。实验中可选用的试剂:2mol·L-1硫酸、1mol·L-1KI溶液、淀粉溶液、CCl4。
+5I-+6H+=3I2+3H2O。实验中可选用的试剂:2mol·L-1硫酸、1mol·L-1KI溶液、淀粉溶液、CCl4。
(1)采用离子交换法从卤水中提取碘的工艺流程如下:

①工业上获取氯气的方法为(用化学方程式表示)
②“氧化1”中生成I
 ,其反应的离子方程式为
,其反应的离子方程式为③“还原”中溶液里含有SO
 ,检验SO
,检验SO 的实验操作是
的实验操作是④“吹碘”中通入热空气,利用了碘具有
(2)某实验小组采用如图所示装置、40℃水浴加热制取碘。

实验过程中需要控制Cl2用量,否则酸性条件下过量Cl2能将I2进一步氧化成IO
 。请补充完整检验反应后的三颈烧瓶中溶液是否含有IO
。请补充完整检验反应后的三颈烧瓶中溶液是否含有IO 的实验方案:取适量三颈烧瓶中的溶液,
的实验方案:取适量三颈烧瓶中的溶液, +5I-+6H+=3I2+3H2O。实验中可选用的试剂:2mol·L-1硫酸、1mol·L-1KI溶液、淀粉溶液、CCl4。
+5I-+6H+=3I2+3H2O。实验中可选用的试剂:2mol·L-1硫酸、1mol·L-1KI溶液、淀粉溶液、CCl4。
您最近一年使用:0次
解题方法
5 . 硫酸镁广泛应用于建材、医药、工业、农业等方面,工业上常用纯橄岩制硫酸镁。纯橄岩是含镁的硅酸盐矿物,含有 、
、 、
、 、
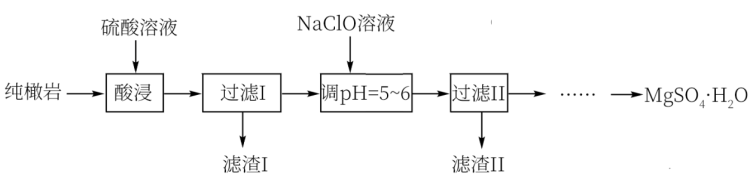
、 和一些有机物等杂质,其制备工艺流程如下:
和一些有机物等杂质,其制备工艺流程如下:
已知:① 不溶于水,可溶于硫酸溶液②
不溶于水,可溶于硫酸溶液② 不溶于稀硫酸
不溶于稀硫酸
③ 时,
时, 以
以 形式完全沉淀
形式完全沉淀
(1)酸浸时,将纯橄岩粉碎的目的是_______ 。
(2)酸浸时温度控制在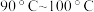 ,可采用的合适加热方式是
,可采用的合适加热方式是_______ 。
(3)滤渣Ⅰ中的主要成分是_______ ,实验室中过滤操作所需玻璃仪器有烧杯、漏斗、_______ 。
(4)加入 溶液,可将滤液I中的
溶液,可将滤液I中的 氧化成
氧化成 ,同时也将
,同时也将 氧化成
氧化成 。生成
。生成 反应的离子方程式是
反应的离子方程式是_______ 。检验滤液Ⅱ是否还含有 :取适量溶液于试管中,加入试剂
:取适量溶液于试管中,加入试剂 ,观察现象。X最好选择
,观察现象。X最好选择_______ (填正确选项的字母编号)。
A. 溶液 B.酸性
溶液 B.酸性 溶液 C.
溶液 C. 溶液
溶液
(5)取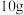 洗净并已干燥的滤渣II,加入足量稀硫酸,充分反应后得4.65g固体,则滤渣II中铁元素的质量分数为
洗净并已干燥的滤渣II,加入足量稀硫酸,充分反应后得4.65g固体,则滤渣II中铁元素的质量分数为_______ 。
 、
、 、
、 、
、 和一些有机物等杂质,其制备工艺流程如下:
和一些有机物等杂质,其制备工艺流程如下:
已知:①
 不溶于水,可溶于硫酸溶液②
不溶于水,可溶于硫酸溶液② 不溶于稀硫酸
不溶于稀硫酸③
 时,
时, 以
以 形式完全沉淀
形式完全沉淀(1)酸浸时,将纯橄岩粉碎的目的是
(2)酸浸时温度控制在
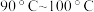 ,可采用的合适加热方式是
,可采用的合适加热方式是(3)滤渣Ⅰ中的主要成分是
(4)加入
 溶液,可将滤液I中的
溶液,可将滤液I中的 氧化成
氧化成 ,同时也将
,同时也将 氧化成
氧化成 。生成
。生成 反应的离子方程式是
反应的离子方程式是 :取适量溶液于试管中,加入试剂
:取适量溶液于试管中,加入试剂 ,观察现象。X最好选择
,观察现象。X最好选择A.
 溶液 B.酸性
溶液 B.酸性 溶液 C.
溶液 C. 溶液
溶液(5)取
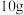 洗净并已干燥的滤渣II,加入足量稀硫酸,充分反应后得4.65g固体,则滤渣II中铁元素的质量分数为
洗净并已干燥的滤渣II,加入足量稀硫酸,充分反应后得4.65g固体,则滤渣II中铁元素的质量分数为
您最近一年使用:0次
解题方法
6 . 某兴趣小组用部分氧化的FeSO4为原料,制取高纯度的Fe2O3,并测定产品中铁元素含量,主要操作步骤如下∶
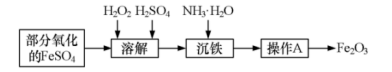
(1)写出加入H2O2发生反应的离子方程式∶___________ 。
(2)简述检验溶解过程中Fe2+是否已被完全氧化成Fe3+的实验操作∶___________ (可选择的试剂∶ 酸性KMnO4溶液、KSCN 溶液、氯水)。
(3)操作A包括___________ 、洗涤、___________ ; 简述检验Fe(OH)3是否洗净的操作∶___________ 。
(4)准确称取4.00gFe2O3产品,经酸溶、还原为Fe2+,准确配成100mL溶液。取25.00mL于锥形瓶中,加入20.50mL 0.10 mol·L-1 K2Cr2O7溶液恰好完全反应。(假设K2Cr2O7不与杂质反应,与Fe2+反应为∶ )
)
① 配成 100mL 溶液所用的主要仪器有∶玻璃棒、烧杯、___________ 。
②产品中铁元素的含量为___________ 。

(1)写出加入H2O2发生反应的离子方程式∶
(2)简述检验溶解过程中Fe2+是否已被完全氧化成Fe3+的实验操作∶
(3)操作A包括
(4)准确称取4.00gFe2O3产品,经酸溶、还原为Fe2+,准确配成100mL溶液。取25.00mL于锥形瓶中,加入20.50mL 0.10 mol·L-1 K2Cr2O7溶液恰好完全反应。(假设K2Cr2O7不与杂质反应,与Fe2+反应为∶
 )
)① 配成 100mL 溶液所用的主要仪器有∶玻璃棒、烧杯、
②产品中铁元素的含量为
您最近一年使用:0次
2021-02-23更新
|
311次组卷
|
2卷引用:江苏省海安市2020-2021学年高一上学期期末考试化学试题
名校
7 . 工业上可用黄铜矿(CuFeS2)冶炼铜,同时还可得到多种物质。工业冶炼铜的化学方程式是:8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2
(1)CuFeS2中Fe的化合价为+2,反应中被还原的元素是氧元素和____________ 。
(2)用少量黄铜矿冶炼铜产生的炉渣(主要含Fe2O3、FeO、SiO2、Al2O3)模拟制铁红(Fe2O3),进行如下实验。

①滤液中的阳离子有Fe3+、Fe2+、H+、_____________ 。
②为确认滤液中含Fe2+,下列实验方案和预期现象正确的是____ (填序号)。
③滤液在酸性条件下,与H2O2反应的离子方程式是_________________________ 。
(3)m克铝热剂(氧化铁与铝)恰好完全反应,则该反应中氧化产物与还原产物的质量比是________________________ 。
 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2(1)CuFeS2中Fe的化合价为+2,反应中被还原的元素是氧元素和
(2)用少量黄铜矿冶炼铜产生的炉渣(主要含Fe2O3、FeO、SiO2、Al2O3)模拟制铁红(Fe2O3),进行如下实验。

①滤液中的阳离子有Fe3+、Fe2+、H+、
②为确认滤液中含Fe2+,下列实验方案和预期现象正确的是
实验方案 | 预期现象 | |
a | 加NaOH溶液 | 产生白色沉淀,变灰绿再变红褐 |
b | 先加KSCN溶液,再加氯水 | 先无明显现象,后变红 |
c | 加酸性KMnO4溶液 | 紫色褪去 |
d | 先加氯水,再加KSCN溶液 | 溶液先变黄,再变红 |
(3)m克铝热剂(氧化铁与铝)恰好完全反应,则该反应中氧化产物与还原产物的质量比是
您最近一年使用:0次
名校
8 . 硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,另含少量杂质FeCO3和SiO2等)为原料制备高纯氧化镁的实验流程如下:
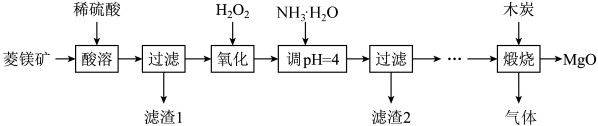
(1)MgCO3与稀硫酸反应的离子方程式是____________ 。
(2)加入H2O2氧化时,发生反应的离子方程式为____________________ 。
(3)煅烧过程存在以下反应:
2MgSO4+C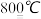 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑
MgSO4+C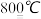 MgO+SO2↑+CO↑
MgO+SO2↑+CO↑
MgSO4+3C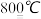 MgO+S↑+3CO↑
MgO+S↑+3CO↑
利用下图装置对煅烧产生的气体进行分步吸收或收集。
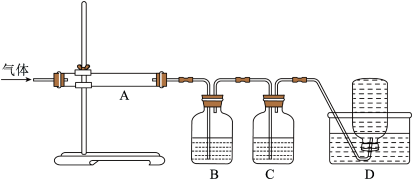
①A中现象是________ ,A中收集的物质可用热的NaOH溶液去除,写出该反应的化学反应方程式:__________________ 。
②B中盛放的溶液可以是_________ (填字母)。
a.NaOH溶液 b.Na2CO3溶液 c.稀硝酸 d.品红溶液 e.酸性KMnO4溶液
③D中收集的气体可以是________ (填化学式)。

(1)MgCO3与稀硫酸反应的离子方程式是
(2)加入H2O2氧化时,发生反应的离子方程式为
(3)煅烧过程存在以下反应:
2MgSO4+C
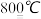 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑MgSO4+C
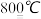 MgO+SO2↑+CO↑
MgO+SO2↑+CO↑MgSO4+3C
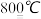 MgO+S↑+3CO↑
MgO+S↑+3CO↑利用下图装置对煅烧产生的气体进行分步吸收或收集。

①A中现象是
②B中盛放的溶液可以是
a.NaOH溶液 b.Na2CO3溶液 c.稀硝酸 d.品红溶液 e.酸性KMnO4溶液
③D中收集的气体可以是
您最近一年使用:0次
名校
解题方法
9 . 某工业废水中主要含有Cr3+,同时还含有少量的Fe2+、Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强。为回收利用铬,通常采用如下流程处理:
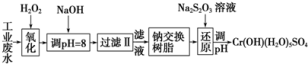
注:部分阳离子常温下沉淀时的pH见下表
(1)氧化过程主要是氧化Fe2+和Cr3+,氧化Fe2+的目的是:________________ ;其中Cr3+被氧化为Cr2O72-,该反应的离子方程式为:____________ ,氧化Cr3+的目的是__________ 。
(2)选择以下合适选项填空:加入NaOH溶液调整溶液pH=8时,除去的离子是________ ;已知钠离子交换树脂的原理:Mn++nNaR→MRn+nNa+,此步操作被交换除去的杂质离子是_____ 。
A.Fe3+ B.Al3+ C.Ca2+ D.Mg2+
(3)还原过程中,氧化剂和还原剂的物质的量之比为:_________________ 。

注:部分阳离子常温下沉淀时的pH见下表
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
| 开始沉淀pH | 1.4 | 7 | 9.1 | 3.4 | 4.3 |
| 完全沉淀pH | 3.7 | 9.6 | 11.1 | 5.4(>8溶解) | 9(>9溶解) |
(1)氧化过程主要是氧化Fe2+和Cr3+,氧化Fe2+的目的是:
(2)选择以下合适选项填空:加入NaOH溶液调整溶液pH=8时,除去的离子是
A.Fe3+ B.Al3+ C.Ca2+ D.Mg2+
(3)还原过程中,氧化剂和还原剂的物质的量之比为:
您最近一年使用:0次
名校
解题方法
10 . 常用于印染工业的连二亚硫酸钠(Na2S2O4)俗称保险粉,可溶于水,但不溶于甲醇,其固体受热、遇水都会发生反应放出大量的热,甚至引起燃烧,工业制备流程如下:
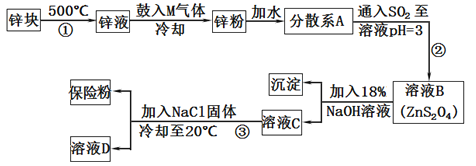
请回答下列问题:
(1)保险粉应如何保存?_______________________ (填一个注意事项)。
(2)由锌块制备锌粉的目的是___________ ;向液锌中鼓入M气体,使液态锌雾化,冷却得到粒度约为180μm(1m=106μm)的锌粉.鼓入气体M为常见的双原子单质分子,则M的化学式为___________ ;分散系A为____________ (填“溶液”“胶体”或“悬浊液”)。
(3)流程②的化学方程式为_____________________ 。
(4)流程③的分离方法步骤为___________ 、洗涤、干燥,其中洗涤所用试剂是__________ ;实验室加入NaCl固体的作用是_____________ 。
(5)保险粉可以用于除去废水中的重铬酸根离子(Cr2O72-被转化为Cr3+,S2O42-被转化为SO42-),这是目前除去酸性废水中重铬酸根离子的有效方法之一,写出该反应的离子方程式____________________ 。
(6)保险粉在空气中容易吸收氧气而发生氧化。其方程式为:
①2Na2S2O4+O2+H2O=4NaHSO3或②2Na2S2O4+O2+H2O==4NaHSO3+NaHSO4
若在此条件下NaHSO3不会被氧化,请设计实验证明氧化时发生的反应是②__________________ 。

请回答下列问题:
(1)保险粉应如何保存?
(2)由锌块制备锌粉的目的是
(3)流程②的化学方程式为
(4)流程③的分离方法步骤为
(5)保险粉可以用于除去废水中的重铬酸根离子(Cr2O72-被转化为Cr3+,S2O42-被转化为SO42-),这是目前除去酸性废水中重铬酸根离子的有效方法之一,写出该反应的离子方程式
(6)保险粉在空气中容易吸收氧气而发生氧化。其方程式为:
①2Na2S2O4+O2+H2O=4NaHSO3或②2Na2S2O4+O2+H2O==4NaHSO3+NaHSO4
若在此条件下NaHSO3不会被氧化,请设计实验证明氧化时发生的反应是②
您最近一年使用:0次
2017-02-17更新
|
1264次组卷
|
2卷引用:青海湟川中学2020-2021学年高一下学期3月考化学试题



