名校
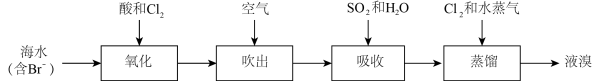
1 . 海洋是一个巨大的化学资源宝库。一种工业上从海水中提取溴的工艺流程如下图所示: ;
;
吸收环节发生的主要反应为: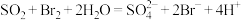 。
。
请回答下列问题:
(1)在吸收环节发生的主要反应中, 是
是___________ (填“氧化剂”或“还原剂”)。
(2)常温下, 为深红棕色液体,说明
为深红棕色液体,说明 的沸点比
的沸点比 的
的___________ (填“高”或“低”)。
(3)该工艺通过氧化、吹出、吸收、蒸馏等环节获得 (溴元素经历了“
(溴元素经历了“ ”的转化),而不是在氧化环节后直接蒸馏得到
”的转化),而不是在氧化环节后直接蒸馏得到 ,其原因是
,其原因是___________ (填字母)。
a.海水中 浓度较低,需富集 b.海水中
浓度较低,需富集 b.海水中 浓度很高,需稀释
浓度很高,需稀释
 ;
;吸收环节发生的主要反应为:
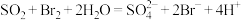 。
。请回答下列问题:
(1)在吸收环节发生的主要反应中,
 是
是(2)常温下,
 为深红棕色液体,说明
为深红棕色液体,说明 的沸点比
的沸点比 的
的(3)该工艺通过氧化、吹出、吸收、蒸馏等环节获得
 (溴元素经历了“
(溴元素经历了“ ”的转化),而不是在氧化环节后直接蒸馏得到
”的转化),而不是在氧化环节后直接蒸馏得到 ,其原因是
,其原因是a.海水中
 浓度较低,需富集 b.海水中
浓度较低,需富集 b.海水中 浓度很高,需稀释
浓度很高,需稀释
您最近半年使用:0次
名校
2 . 碳、硅及其化合物的开发由来已久,在现代生活中有广泛应用。
(1)SiO2是玻璃的主要成分之一,保存氢氟酸溶液不能使用玻璃瓶的原因是______________ (用化学方程式表示)。
(2)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如图:
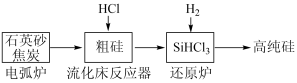
①用石英砂和焦炭在电弧炉中制粗硅,该反应的化学方程式为___________________________ 。
②在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,有关物质的沸点数据如表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和___________________ 。
(3)某同学为了验证碳和硅两种元素非金属性的相对强弱,用如图所示装置进行实验(夹持仪器已略去,气密性已检验),实验操作步骤:
Ⅰ.打开弹簧夹1,关闭弹簧夹2,并打开活塞a,滴加盐酸。
Ⅱ.A中看到白色沉淀时,关闭弹簧夹1,打开弹簧夹2,关闭活塞a。
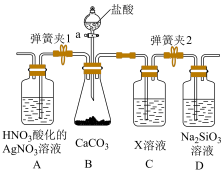
①通过步骤Ⅰ得知盐酸具有的性质是___________ (填字母)。
A.挥发性 B.还原性 C.氧化性 D.酸性
②C装置中的试剂X是______________ (写化学式)。
(1)SiO2是玻璃的主要成分之一,保存氢氟酸溶液不能使用玻璃瓶的原因是
(2)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如图:

①用石英砂和焦炭在电弧炉中制粗硅,该反应的化学方程式为
②在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,有关物质的沸点数据如表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和
物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
(3)某同学为了验证碳和硅两种元素非金属性的相对强弱,用如图所示装置进行实验(夹持仪器已略去,气密性已检验),实验操作步骤:
Ⅰ.打开弹簧夹1,关闭弹簧夹2,并打开活塞a,滴加盐酸。
Ⅱ.A中看到白色沉淀时,关闭弹簧夹1,打开弹簧夹2,关闭活塞a。

①通过步骤Ⅰ得知盐酸具有的性质是
A.挥发性 B.还原性 C.氧化性 D.酸性
②C装置中的试剂X是
您最近半年使用:0次
名校
3 . 下列选项中除杂试剂或操作正确的是
选项 | 物质(杂质) | 除杂试剂或操作 |
A | 甲烷(丙烯) | 酸性高锰酸钾溶液 |
B | 乙酸乙酯(乙醇) | 浓硫酸、乙酸、加热 |
C | 二氧化硫(乙烯) | 溴水 |
D | 蛋白质溶液(NaCl) | 渗析 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
4 . 回答下列问题:
(1)某化学社团为证实Ba(OH)2溶液和H2SO4溶液的反应是离子反应,设计了如下实验。
已知:溶液的导电性由溶液中离子的浓度及离子电荷数决定,可通过观察实验现象,判断溶液中离子浓度的变化,从而证明反应是离子反应。实验装置如图所示:
(2)写出下列情况发生反应的离子方程式:向NaHSO4液中逐滴加入Ba(OH)2溶液至溶液显中性___________ 。
(3)某化工厂排出的废水呈酸性,且其中含大量的Na+、Cu2+、Cl-、 ,为除去废水样品中的Cu2+和
,为除去废水样品中的Cu2+和 ,最终得到中性溶液,设计的方案流程如下图:
,最终得到中性溶液,设计的方案流程如下图:___________ (用离子符号表示)。
②上述流程中,试剂c为___________ (写化学式)。
(1)某化学社团为证实Ba(OH)2溶液和H2SO4溶液的反应是离子反应,设计了如下实验。
已知:溶液的导电性由溶液中离子的浓度及离子电荷数决定,可通过观察实验现象,判断溶液中离子浓度的变化,从而证明反应是离子反应。实验装置如图所示:
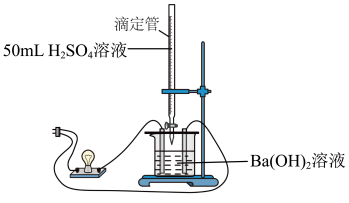
| 实验步骤 | 实验现象 | 实验结论 |
| 连接好装置,向烧杯中加入一定浓度的Ba(OH)2溶液,逐滴滴加H2SO4溶液直至过量,边滴边振荡 | Ba(OH)2溶液和H2SO4溶液的反应是离子反应 |
(2)写出下列情况发生反应的离子方程式:向NaHSO4液中逐滴加入Ba(OH)2溶液至溶液显中性
(3)某化工厂排出的废水呈酸性,且其中含大量的Na+、Cu2+、Cl-、
 ,为除去废水样品中的Cu2+和
,为除去废水样品中的Cu2+和 ,最终得到中性溶液,设计的方案流程如下图:
,最终得到中性溶液,设计的方案流程如下图: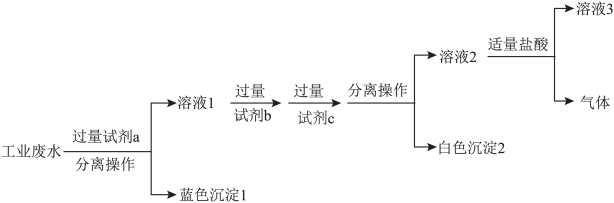
②上述流程中,试剂c为
您最近半年使用:0次
5 . 已知“氨碱法”的部分工艺流程如下: 转化为
转化为 ,再加入NaCl细粉的方式获得
,再加入NaCl细粉的方式获得 晶体,从而提高了母液的利用率。下列有关“联合制碱法”说法正确的是
晶体,从而提高了母液的利用率。下列有关“联合制碱法”说法正确的是
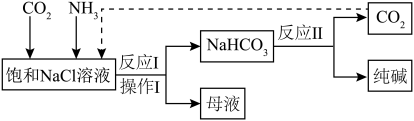
 转化为
转化为 ,再加入NaCl细粉的方式获得
,再加入NaCl细粉的方式获得 晶体,从而提高了母液的利用率。下列有关“联合制碱法”说法正确的是
晶体,从而提高了母液的利用率。下列有关“联合制碱法”说法正确的是A.母液中存在的主要离子有: 、 、 、 、 、 、 |
B.反应1析出的 晶体表面附有的 晶体表面附有的 可以通过加热除去 可以通过加热除去 |
C.向母液中加入NaCl细粉时发生的反应: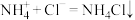 |
D.将析出 晶体后的溶液蒸发浓缩、冷却结晶,可获得更多的 晶体后的溶液蒸发浓缩、冷却结晶,可获得更多的 晶体 晶体 |
您最近半年使用:0次
名校
6 . 回答下列问题。
I.以铝土矿、硫铁矿烧渣为配料(主要成分为Al2O3、Fe2O3,含少量FeO、SiO2等)制备无机高分子絮凝剂聚合碱式氯化铝铁的流程如图(提示:SiO2为难溶于盐酸的固体)。
(1)实验前,要将铝土矿粉碎的目的是_______ 。
(2)“滤渣1”的主要成分为_______ (填化学式)。
(3)步骤Ⅳ加入双氧水发生反应的离子方程式为_______ 。
(4)步骤V发生反应时溶液的pH=3,若pH过大,可能造成的影响是_______ 。
(5)测定聚合碱式氯化铝铁可表示为{[FeaAlb(OH)xCly]n}中 的比值的步骤如下:
的比值的步骤如下:
步骤1:准确称取产品5.710g溶于水,加入足量的稀氨水,过滤,将滤渣灼烧至质量不再变化,得到3.350g固体。
步骤2:另准确称取相同质量样品,溶于足量NaOH溶液讨滤,充分洗涤,将滤渣灼烧全质量不再变化,得到固体0.800g。
则产品中 为
为_______ (填最简整数比)。
Ⅱ.向一定量 、
、 溶液中滴加常用试剂
溶液中滴加常用试剂 与盐酸
与盐酸 点之前滴加的试剂为
点之前滴加的试剂为 点之后改滴试剂
点之后改滴试剂 ,沉淀的物质的量
,沉淀的物质的量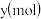 与试剂体积
与试剂体积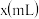 间的关系曲线如图所示:
间的关系曲线如图所示:____ ;CD段所表示的反应的离子方程式是_____ 。
(7)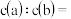
_______ ;原混合液中,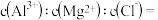
_______ 。
I.以铝土矿、硫铁矿烧渣为配料(主要成分为Al2O3、Fe2O3,含少量FeO、SiO2等)制备无机高分子絮凝剂聚合碱式氯化铝铁的流程如图(提示:SiO2为难溶于盐酸的固体)。
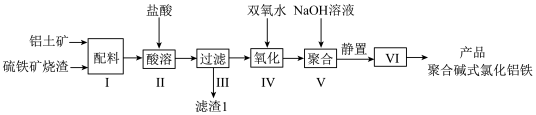
(1)实验前,要将铝土矿粉碎的目的是
(2)“滤渣1”的主要成分为
(3)步骤Ⅳ加入双氧水发生反应的离子方程式为
(4)步骤V发生反应时溶液的pH=3,若pH过大,可能造成的影响是
(5)测定聚合碱式氯化铝铁可表示为{[FeaAlb(OH)xCly]n}中
 的比值的步骤如下:
的比值的步骤如下:步骤1:准确称取产品5.710g溶于水,加入足量的稀氨水,过滤,将滤渣灼烧至质量不再变化,得到3.350g固体。
步骤2:另准确称取相同质量样品,溶于足量NaOH溶液讨滤,充分洗涤,将滤渣灼烧全质量不再变化,得到固体0.800g。
则产品中
 为
为Ⅱ.向一定量
 、
、 溶液中滴加常用试剂
溶液中滴加常用试剂 与盐酸
与盐酸 点之前滴加的试剂为
点之前滴加的试剂为 点之后改滴试剂
点之后改滴试剂 ,沉淀的物质的量
,沉淀的物质的量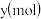 与试剂体积
与试剂体积 间的关系曲线如图所示:
间的关系曲线如图所示: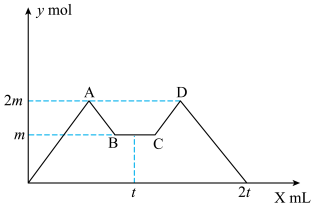
(7)
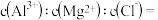
您最近半年使用:0次
7 . 某工业废水中存在大量的 、
、 、
、 和
和 ,欲除去废水中的
,欲除去废水中的 和
和 ,设计工艺流程如下:
,设计工艺流程如下:
 、
、 、
、 和
和 ,欲除去废水中的
,欲除去废水中的 和
和 ,设计工艺流程如下:
,设计工艺流程如下:
| A.加入试剂a,可观察到溶液A中有白色沉淀生成 |
B.加入试剂b,发生反应的离子方程式为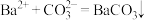 |
| C.试剂c为盐酸 |
D.溶液C中只含有 、 、 、 、 |
您最近半年使用:0次
名校
解题方法
8 . 碱式氧化镍是镍电池的正极活性材料。利用镍渣(主要含NiO,及少量 、CuO、CaO、
、CuO、CaO、 等杂质)制备碱式氧化镍的流程如下:
等杂质)制备碱式氧化镍的流程如下:
(2)浸渣的主要成分是_______ 。
(3)“沉铜”过程中生成单质S的离子方程式为______ 。
(4)“氧化”中的目的是将 氧化为
氧化为 ,试剂R可选用
,试剂R可选用_____ (填标号)。写出“氧化”时反应的离子方程式:_____ 。
A.氯水 B. 酸性溶液 C.
酸性溶液 C.
(5)碱式氧化镍(NiOOH)可用作镍氢电池的正极材料,电池的总反应为
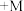 ,其工作时的正极电极反应式为
,其工作时的正极电极反应式为_______ 。
(6)若用2.0t废料(含NiO75%)制得NiOOH 0.92 t,则NiOOH的产率为_____ %。
 、CuO、CaO、
、CuO、CaO、 等杂质)制备碱式氧化镍的流程如下:
等杂质)制备碱式氧化镍的流程如下: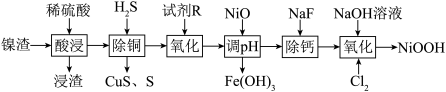
| A.研磨废料 | B.加入大量水 | C.搅拌 | D.适当升高温度 |
(2)浸渣的主要成分是
(3)“沉铜”过程中生成单质S的离子方程式为
(4)“氧化”中的目的是将
 氧化为
氧化为 ,试剂R可选用
,试剂R可选用A.氯水 B.
 酸性溶液 C.
酸性溶液 C.
(5)碱式氧化镍(NiOOH)可用作镍氢电池的正极材料,电池的总反应为

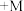 ,其工作时的正极电极反应式为
,其工作时的正极电极反应式为(6)若用2.0t废料(含NiO75%)制得NiOOH 0.92 t,则NiOOH的产率为
您最近半年使用:0次
名校
解题方法
9 . 已知:溴苯的沸点为 ,苯的沸点为
,苯的沸点为 。实验室用苯和液溴制取溴苯并验证反应类型的实验装置如图:
。实验室用苯和液溴制取溴苯并验证反应类型的实验装置如图:
(1)冷凝管的进水口为__________ (填“A”或“B”);冷凝管的作用:__________ 。
(2)d中盛放的试剂是__________ 。
(3)有同学认为苯与溴的反应为取代反应,请根据该实验装置特点和实验现象。叙述得出这一结论的实验现象:_____________ 。
(4)分离提纯:
①反应后a瓶中的溴苯中因溶有溴而显褐色,提纯溴苯的过程中,除去溴苯中的溴可加入__________ 溶液,振荡,再通过__________ (填分离方法)分离提纯;
②苯与溴还可能发生副反应生成对二溴苯(沸点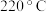 )和邻二溴苯(沸点
)和邻二溴苯(沸点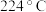 ),因此最后再经
),因此最后再经_______ (填分离方法)即可得到较纯净的溴苯,该过程中为了受热均匀和易于控制温度,可采用_______ (填“水浴”或“油浴”)加热
(5)检验鉴别:充分反应后,三颈烧瓶中的粗产品经水洗、分液后得到水洗液,为验证水洗液中是否存在 不能选用的试剂是__________(填字母)
不能选用的试剂是__________(填字母)
 ,苯的沸点为
,苯的沸点为 。实验室用苯和液溴制取溴苯并验证反应类型的实验装置如图:
。实验室用苯和液溴制取溴苯并验证反应类型的实验装置如图: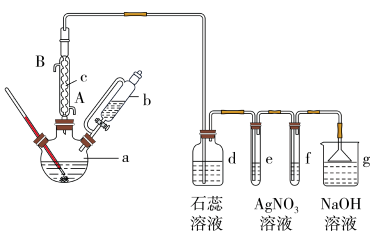
(1)冷凝管的进水口为
(2)d中盛放的试剂是
(3)有同学认为苯与溴的反应为取代反应,请根据该实验装置特点和实验现象。叙述得出这一结论的实验现象:
(4)分离提纯:
①反应后a瓶中的溴苯中因溶有溴而显褐色,提纯溴苯的过程中,除去溴苯中的溴可加入
②苯与溴还可能发生副反应生成对二溴苯(沸点
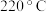 )和邻二溴苯(沸点
)和邻二溴苯(沸点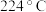 ),因此最后再经
),因此最后再经(5)检验鉴别:充分反应后,三颈烧瓶中的粗产品经水洗、分液后得到水洗液,为验证水洗液中是否存在
 不能选用的试剂是__________(填字母)
不能选用的试剂是__________(填字母)A. 溶液 溶液 | B. 溶液 溶液 | C. 溶液 溶液 | D.苯酚溶液 |
您最近半年使用:0次
10 . 黑木耳富含蛋白质、铁、具有还原性的维生素C等,每100 g黑木耳含铁量高达185 mg。
I.为了确定黑木耳中含有铁元素,甲同学设计实验方案如下。____________ 。
(2)步骤④检验Fe3+所用试剂是_____________ (填化学式)溶液。
(3)已知:3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓,则滤液A中大量含有的阳离子 的离子符号为____________ 。
II.紫色的KMnO4溶液在酸性条件下具有强氧化性,其还原产物是无色的Mn2+。本实验用KMnO4酸性溶液来测定黑木耳中铁元素的含量,乙同学设计实验方案如下。_______ (填序号)。
a.Na b.Cu c.Fe
(5)步骤⑥的离子方程式为_______________ 。
(6)若乙同学实验操作规范,但测得含铁量远远偏高,其可能的原因是_______________ 。
I.为了确定黑木耳中含有铁元素,甲同学设计实验方案如下。
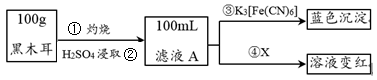
(2)步骤④检验Fe3+所用试剂是
(3)已知:3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓,则滤液A中大量含有的
II.紫色的KMnO4溶液在酸性条件下具有强氧化性,其还原产物是无色的Mn2+。本实验用KMnO4酸性溶液来测定黑木耳中铁元素的含量,乙同学设计实验方案如下。
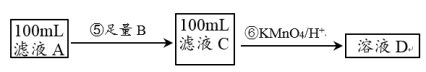
a.Na b.Cu c.Fe
(5)步骤⑥的离子方程式为
(6)若乙同学实验操作规范,但测得含铁量远远偏高,其可能的原因是
您最近半年使用:0次



