名校
解题方法
1 . Ⅰ.工业生产纯碱的工艺流程示意图如图:
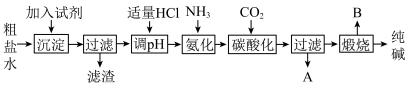
(1)为除去粗盐水中的
 、
、 、
、 等杂质离子,加入试剂顺序合理的是______。
等杂质离子,加入试剂顺序合理的是______。| A.碳酸钠、氢氧化钠、氯化钡 | B.碳酸钠、氯化钡、氢氧化钠 |
| C.氢氧化钠、碳酸钠、氯化钡 | D.氯化钡、氢氧化钠、碳酸钠 |
(2)工业生产纯碱工艺流程中,碳酸化时产生的现象是
(3)工业生产纯碱工艺流程中,先“氨化”后“碳酸化”的目的是
(4)碳酸化后过滤,滤液A最主要的成分是
Ⅱ.纯碱在生产生活中有广泛的用途。
(5)工业上,可用纯碱代替烧碱生产某些化工产品。如用饱和纯碱溶液与氯气反应可制得有效成分为次氯酸钠的消毒液,其反应的离子方程式为
您最近一年使用:0次
名校
2 . 通过海水晾晒可以得到粗盐,粗盐除还有 NaCl 外,还含有 MgCl2 、 CaCl2 、 Na2 SO4以及泥沙等杂质。以下是某兴趣小组制备精盐的实验方案,各步操作流程如图。下列说法不正确的是
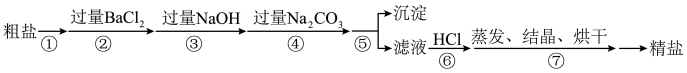
A.步骤②的目的是除去溶液中的 SO |
| B.步骤③的目的是除去溶液中的 Mg2+ |
| C.步骤④仅除去溶液中的 Ca2+ |
| D.步骤⑥可同时除去溶液中过量的 NaOH 和 Na2CO3 |
您最近一年使用:0次
2024-02-01更新
|
56次组卷
|
2卷引用:重庆市黔江中学校2021-2022年度高一上11月考试化学试题
名校
解题方法
3 . 粗盐水经过滤后仍含有少量 、Mg2+、Ca2+等杂质离子。为除掉这些杂质离子,常采用以下实验步骤:
、Mg2+、Ca2+等杂质离子。为除掉这些杂质离子,常采用以下实验步骤:
①加入过量BaCl2溶液,沉淀后过滤;
②在步骤①所得滤液中加入过量NaOH溶液,沉淀后过滤;
③在步骤②所得滤液中加入过量Na2CO3溶液,沉淀后过滤;
④在步骤③所得滤液中加入适量盐酸,即可得到纯净的NaCl溶液。
(1)步骤①中加入BaCl2溶液的目的是除去___________ (填“ ”“Mg2+”或“Ca2+”)。
”“Mg2+”或“Ca2+”)。
(2)步骤②中加入NaOH溶液必须过量,其目的是___________ 。
(3)步骤③发生反应的离子方程式为___________ 、Ba2++ =BaCO3↓。
=BaCO3↓。
(4)写出下列反应的离子方程式:
①大理石与盐酸反应___________ ;
②二氧化碳通入足量澄清石灰水中___________ ;
③小苏打(NaHCO3)与盐酸反应___________ 。
(5)写出下列物质在水溶液中的电离方程式:
①碳酸氢钠:___________ ;
②硫酸铝:___________ ;
③氢氧化钡:___________ ;
④硫酸氢钾:___________ 。
 、Mg2+、Ca2+等杂质离子。为除掉这些杂质离子,常采用以下实验步骤:
、Mg2+、Ca2+等杂质离子。为除掉这些杂质离子,常采用以下实验步骤:①加入过量BaCl2溶液,沉淀后过滤;
②在步骤①所得滤液中加入过量NaOH溶液,沉淀后过滤;
③在步骤②所得滤液中加入过量Na2CO3溶液,沉淀后过滤;
④在步骤③所得滤液中加入适量盐酸,即可得到纯净的NaCl溶液。
(1)步骤①中加入BaCl2溶液的目的是除去
 ”“Mg2+”或“Ca2+”)。
”“Mg2+”或“Ca2+”)。(2)步骤②中加入NaOH溶液必须过量,其目的是
(3)步骤③发生反应的离子方程式为
 =BaCO3↓。
=BaCO3↓。(4)写出下列反应的离子方程式:
①大理石与盐酸反应
②二氧化碳通入足量澄清石灰水中
③小苏打(NaHCO3)与盐酸反应
(5)写出下列物质在水溶液中的电离方程式:
①碳酸氢钠:
②硫酸铝:
③氢氧化钡:
④硫酸氢钾:
您最近一年使用:0次
名校
4 . “以废治废”是基于“绿色化学”观念治理污染的思路。用工业废碱渣(主要成分为Na2CO3)吸收烟气中的SO2,得到亚硫酸钠(Na2SO3)粗品。其流程如下:

(1)为加快工业废碱渣中Na2CO3的溶解,可采取的措施是___________ (写出一种即可)。
(2)将碳酸钠溶液吸收烟气中的SO2的化学方程式补充完整:___________ 。
SO2+Na2CO3+______=NaHSO3+CO2
(3)上述流程中,加入NaOH后,发生反应的化学方程式为___________ 。
(4)亚硫酸钠(Na2SO3)中硫的化合价是___________ 。亚硫酸钠粗品中常含有少量的硫酸钠,可能的原因是___________ 。

(1)为加快工业废碱渣中Na2CO3的溶解,可采取的措施是
(2)将碳酸钠溶液吸收烟气中的SO2的化学方程式补充完整:
SO2+Na2CO3+______=NaHSO3+CO2
(3)上述流程中,加入NaOH后,发生反应的化学方程式为
(4)亚硫酸钠(Na2SO3)中硫的化合价是
您最近一年使用:0次
5 . 某小组以Ba(OH)2、水、H2SO4为实验对象探究离子反应发生的条件
(1)Ba(OH)2与H2SO4在溶液中能发生___________ 反应。
a.复分解反应 b.氧化还原反应 c.置换反应
(2)加H2O后,灯泡变亮的原因是Ba(OH)2发生了___________ 。
(3)用离子方程式解释过程Ⅰ中灯泡变暗的原因___________ 。
(4)实验2:用Na2SO4溶液替代稀H2SO4,重复实验进行对照,加入Na2SO4溶液过程中灯泡不熄灭,原因是___________ 。
通过实验1和2可知:离子反应发生的条件之一是生成沉淀。
(5)在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。
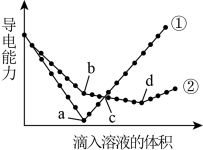
下列说法不正确的是__________
(6)食盐是日常生活的必需品,也是重要的化工原料。粗盐中食盐是日常生活的必需品,也是重要的化工原料。粗盐中常含有少量泥沙及Ca2+、Mg2+、SO 等杂质离子。为除去粗严重的Ca2+、Mg2+、SO
等杂质离子。为除去粗严重的Ca2+、Mg2+、SO 以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下:
以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下:
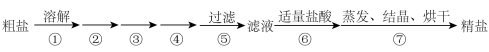
为除去Ca2+、Mg2+、SO ,步骤②~④需加入以下三种溶液(用于沉淀的试剂稍过量);加入的顺序为
,步骤②~④需加入以下三种溶液(用于沉淀的试剂稍过量);加入的顺序为___________ (填字母标号)。
A.Na2CO3 B.BaCl2
| 实验1:向烧杯中依次加入下列试剂,记录灯泡变化 | |
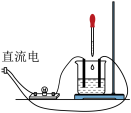 | ①Ba(OH)2粉末:灯泡不亮 ②加入蒸馏水:灯泡变亮 ③逐滴滴加0.1mol/LH2SO4,灯泡变化如下: 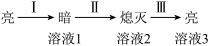 |
(1)Ba(OH)2与H2SO4在溶液中能发生
a.复分解反应 b.氧化还原反应 c.置换反应
(2)加H2O后,灯泡变亮的原因是Ba(OH)2发生了
(3)用离子方程式解释过程Ⅰ中灯泡变暗的原因
(4)实验2:用Na2SO4溶液替代稀H2SO4,重复实验进行对照,加入Na2SO4溶液过程中灯泡不熄灭,原因是
通过实验1和2可知:离子反应发生的条件之一是生成沉淀。
(5)在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。

下列说法不正确的是__________
| A.①代表滴加H2SO4溶液的变化曲线 |
| B.①代表滴加NaHSO4溶液的变化曲线 |
| C.a点对应的溶液显中性 |
| D.b点对应的溶液显中性 |
(6)食盐是日常生活的必需品,也是重要的化工原料。粗盐中食盐是日常生活的必需品,也是重要的化工原料。粗盐中常含有少量泥沙及Ca2+、Mg2+、SO
 等杂质离子。为除去粗严重的Ca2+、Mg2+、SO
等杂质离子。为除去粗严重的Ca2+、Mg2+、SO 以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下:
以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下:
为除去Ca2+、Mg2+、SO
 ,步骤②~④需加入以下三种溶液(用于沉淀的试剂稍过量);加入的顺序为
,步骤②~④需加入以下三种溶液(用于沉淀的试剂稍过量);加入的顺序为A.Na2CO3 B.BaCl2
您最近一年使用:0次
名校
6 . 由粗SiO2制备纯SiO2的流程如图所示,下列说法不正确的是
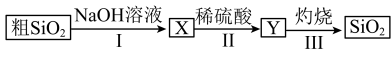
| A.X可用作木材防火剂 |
B.步骤Ⅱ的反应是 |
| C.步骤Ⅱ中的稀硫酸不可用CO2替代 |
| D.若在实验室中完成步骤Ⅲ,一般在蒸发皿中进行 |
您最近一年使用:0次
2023-09-24更新
|
60次组卷
|
16卷引用:江苏省南京市中华中学2020-2021学年高一下学期期中考试化学试题
江苏省南京市中华中学2020-2021学年高一下学期期中考试化学试题2015-2016学年北京市朝阳区高一上学期期末考试化学试卷安徽省定远重点中学2018-2019学年高一下学期开学考试化学试题【全国百强校】四川省阆中中学2018-2019学年高一下学期期中考试化学试题必修第二册RJ第5章第三节 无机非金属材料 易错疑难集训(三)人教版(2019)必修第二册第五章第三节 易错疑难集训广东省佛山市顺德区容山中学2022-2023学年高一下学期3月月考化学试题陕西省横山清源中学2022-2023学年高一下学期3月月考化学试题吉林省长春市新解放学校2022-2023学年高一下学期4月月考化学试题浙江台州市永宁中学(筹)2022-2023学年高一下学期3月月考化学试题河南省洛阳市第一高级中学2022-2023学年高一下学期3月月考化学试题江西省乐安县第二中学2022-2023学年高一下学期5月期中考试化学试题(已下线)合格考汇编8硅及其化合物安徽省芜湖市第一中学2022-2023学年高一下学期3月份教学质量诊断测试化学试卷黑龙江省哈尔滨市第三中学校2022-2023学年高二上学期开学验收考试化学试题新疆维吾尔自治区乌鲁木齐市第101中学2023-2024学年高二上学期开学考试化学试题
名校
解题方法
7 . 某废旧金属材料中主要为铜、铝、铁及其氧化物的混合物。利用该废旧金属材料分离金属化合物的一种流程如下:
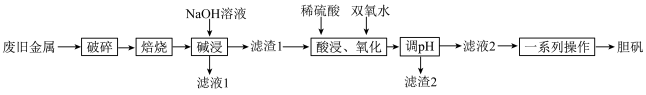
已知:调pH可将Fe3+与Cu2+分离,但不能将Fe2+与Cu2+分离。回答下列问题:
(1)流程中“破碎”的目的是_____________________ 。
(2)“碱浸”时发生反应的离子方程式为________________________ 。
(3)“酸浸”后“氧化”时发生反应的离子方程式为________________________ ;该过程温度不宜过高,原因为_____________________ 。
(4)下列选项中可以检验酸浸、氧化的溶液里是否含有Fe2+的是 。
(5)若无“氧化”过程,向滤液2中则会混有Fe2+,若向Fe2+的盐溶液中加入NaOH溶液的现象是____________________ ,产生该现象的有关的离子方程式为___________________ 。

已知:调pH可将Fe3+与Cu2+分离,但不能将Fe2+与Cu2+分离。回答下列问题:
(1)流程中“破碎”的目的是
(2)“碱浸”时发生反应的离子方程式为
(3)“酸浸”后“氧化”时发生反应的离子方程式为
(4)下列选项中可以检验酸浸、氧化的溶液里是否含有Fe2+的是 。
| A.KSCN溶液,新制氯水 | B.酸性高锰酸钾溶液 |
| C.NaOH溶液 | D.淀粉-KI试纸 |
您最近一年使用:0次
名校
解题方法
8 . 实验室用 和浓盐酸制取
和浓盐酸制取 并回收
并回收 ,下列装置不能达到实验目的的是
,下列装置不能达到实验目的的是
 和浓盐酸制取
和浓盐酸制取 并回收
并回收 ,下列装置不能达到实验目的的是
,下列装置不能达到实验目的的是A.制备氯气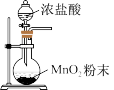 | B.收集氯气 |
C.过滤除MnO2 | D.浓缩滤液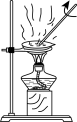 |
您最近一年使用:0次
2023-08-21更新
|
143次组卷
|
5卷引用:广东省连州市连州中学2021-2022学年高一上学期期中考试化学试题
解题方法
9 . 某化学兴趣小组用铁矿石(主要成分为 ,还有
,还有 、
、 等杂质)提取铁红。操作过程如下:
等杂质)提取铁红。操作过程如下:
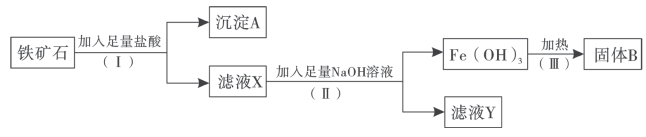
(1)沉淀A中主要含有_______ (填化学式,下同),固体B是_______ 。
(2)向滤液Y中通入过量 ,可观察到的现象是
,可观察到的现象是_______ 。
(3)写出步骤(Ⅱ)中生成 的离子反应方程式
的离子反应方程式_______ 。
(4)向小烧杯中加入30mL蒸馏水,加热至沸腾后,向沸水中滴入2mL饱和 溶液,继续加热至液体呈透明的
溶液,继续加热至液体呈透明的_______ 色,停止加热,证明所得分散系类型的最常用方法为_______ 。
(5)以铁红为原料,可制备 溶液,写出所选试剂的化学式
溶液,写出所选试剂的化学式_______ (按添加顺序写出),写出其中发生的氧化还原反应的离子方程式_______ 。
 ,还有
,还有 、
、 等杂质)提取铁红。操作过程如下:
等杂质)提取铁红。操作过程如下:
(1)沉淀A中主要含有
(2)向滤液Y中通入过量
 ,可观察到的现象是
,可观察到的现象是(3)写出步骤(Ⅱ)中生成
 的离子反应方程式
的离子反应方程式(4)向小烧杯中加入30mL蒸馏水,加热至沸腾后,向沸水中滴入2mL饱和
 溶液,继续加热至液体呈透明的
溶液,继续加热至液体呈透明的(5)以铁红为原料,可制备
 溶液,写出所选试剂的化学式
溶液,写出所选试剂的化学式
您最近一年使用:0次
名校
解题方法
10 . 经检测,某化工厂排出的废水呈酸性,且其中含有大量  、
、 、
、 、
、 、
、 。回答下列问题:
。回答下列问题:
(1)下列离子中,能大量存在于该废水中的是_______ 填标号
填标号
(2)取 该废水于烧杯,逐滴加入
该废水于烧杯,逐滴加入 溶液至呈碱性过程中,原废水中存在的离子的量会发生变化的是
溶液至呈碱性过程中,原废水中存在的离子的量会发生变化的是 、
、____  用离子符号表示
用离子符号表示 。
。
(3)某化学社团小组成员欲除去废水样品中的 和
和 ,最终得到中性溶液,设计的方案流程如图:
,最终得到中性溶液,设计的方案流程如图:
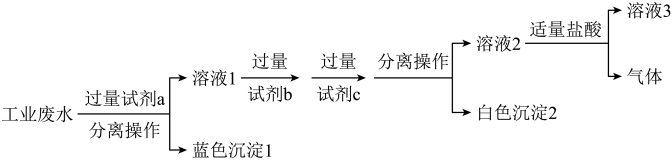
 试剂
试剂 为
为_______  写化学式
写化学式 ;溶液
;溶液 所含溶质离子有
所含溶质离子有 、
、________ 。
 “分离操作”的名称是
“分离操作”的名称是______ ,需用到的玻璃仪器主要有______ 。
 向“白色沉淀
向“白色沉淀 ”中加入足量盐酸,发生反应的离子方程式为
”中加入足量盐酸,发生反应的离子方程式为______ 。
 、
、 、
、 、
、 、
、 。回答下列问题:
。回答下列问题:(1)下列离子中,能大量存在于该废水中的是_______
 填标号
填标号
A. | B. | C. | D. |
 该废水于烧杯,逐滴加入
该废水于烧杯,逐滴加入 溶液至呈碱性过程中,原废水中存在的离子的量会发生变化的是
溶液至呈碱性过程中,原废水中存在的离子的量会发生变化的是 、
、 用离子符号表示
用离子符号表示 。
。(3)某化学社团小组成员欲除去废水样品中的
 和
和 ,最终得到中性溶液,设计的方案流程如图:
,最终得到中性溶液,设计的方案流程如图:
 试剂
试剂 为
为 写化学式
写化学式 ;溶液
;溶液 所含溶质离子有
所含溶质离子有 、
、 “分离操作”的名称是
“分离操作”的名称是 向“白色沉淀
向“白色沉淀 ”中加入足量盐酸,发生反应的离子方程式为
”中加入足量盐酸,发生反应的离子方程式为
您最近一年使用:0次
2023-07-30更新
|
524次组卷
|
8卷引用:河南省洛阳市豫西名校2021-2022学年高一上学期第一次联考化学试题



