2022高一·上海·专题练习
名校
解题方法
1 . 提纯下列物质除去其中的杂质(括号中为杂质),所用试剂和方法正确的是
| A.H2SO4(HCl):AgNO3溶液、过滤 | B.KNO3(K2SO4):BaCl2溶液、过滤 |
| C.Cu(CuO):盐酸、过滤 | D.CaCO3(沙子):水、过滤 |
您最近一年使用:0次
名校
解题方法
2 . 废水中的氨氮(NH3、NH )采用微生物脱氮法、化学沉淀法均可除去,具体原理如下:
)采用微生物脱氮法、化学沉淀法均可除去,具体原理如下:
①微生物脱氮法:NH
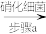 NO
NO
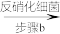 N2
N2
②化学沉淀法:向废水中加入含MgCl2、Na3PO4的溶液,生成MgNH4PO4•6H2O沉淀从而去除氨氮。
下列有关说法正确的是
 )采用微生物脱氮法、化学沉淀法均可除去,具体原理如下:
)采用微生物脱氮法、化学沉淀法均可除去,具体原理如下:①微生物脱氮法:NH

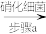 NO
NO
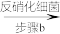 N2
N2②化学沉淀法:向废水中加入含MgCl2、Na3PO4的溶液,生成MgNH4PO4•6H2O沉淀从而去除氨氮。
下列有关说法正确的是
A.步骤a发生反应:NH +O2=NO +O2=NO +H2O+H+ +H2O+H+ |
| B.含氨氮的废水直接大量排放,对水体的影响不大 |
| C.化学沉淀法脱氯时,溶液的碱性过强,氨氮的去除率将下降 |
| D.微生物脱氮可在高温条件下进行,以加快脱氮的速率 |
您最近一年使用:0次
2022-07-12更新
|
750次组卷
|
14卷引用:人教版2019必修第二册 第八章 第一?三节综合拔高练
人教版2019必修第二册 第八章 第一?三节综合拔高练江苏省南通市如皋中学2020-2021学年高一下学期第二次阶段考试化学试题江苏省淮安市金湖中学、洪泽中学等六校2020-2021学年高一下学期第七次学情调查化学试题(已下线)期末综合检测卷01【综合检测】-2020-2021学年高一化学下学期期末专项复习(人教版2019必修第二册)浙江省宁波市北仑中学2021-2022学年高一上学期期中考试化学(育英班)试题专题7 本专题达标检测-高中化学必修第二册苏教版2019(已下线)考点12 氮及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点12 氮及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)江西省抚州市2021-2022学年高一下学期期末考化学试题湖南省2022-2023学年第十五届中学生数理化生综合实践活动高一化学应用知识展示A卷江苏省常州市北郊高级中学2022-2023学年高一下学期3月调研化学试题7.3.1铵盐的性质(课中)-2019苏教版必修2课前课中课后黑龙江省双鸭山市第一中学2022-2023学年高二上学期开学考试化学试题 湖南省永州市第一中学2022-2023学年高三上学期第三次月考化学试题
名校
解题方法
3 . 以硅藻土为载体的五氧化二钒( )是接触法生成硫酸的催化剂。从废钒催化剂中回收
)是接触法生成硫酸的催化剂。从废钒催化剂中回收 既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
以下是一种废钒催化剂回收工艺路线:
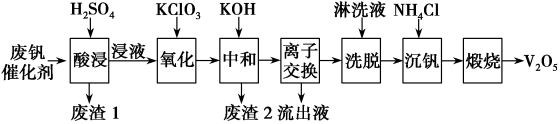
回答下列问题:
(1)“酸浸”时 转化为
转化为 ,反应的离子方程式为
,反应的离子方程式为_______ ,同时 转化为
转化为 。“废渣1”的主要成分是
。“废渣1”的主要成分是_______ 。
(2)“氧化”中使 变为
变为 ,则“氧化”环节中还原剂与氧化剂的物质的量之比为
,则“氧化”环节中还原剂与氧化剂的物质的量之比为_______ 。
(3)“离子交换”和“洗脱”可简单表示为: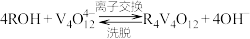 (以ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈
(以ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈_______ 性(填“酸”或“碱”)。
(4)检验“流出液”中含量最多的阳离子,其实验操作称为_______ 。
(5)“煅烧”中发生反应的化学方程式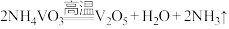 ,写出“沉钒”过程的离子方程式
,写出“沉钒”过程的离子方程式_______ 。
(6)若有1000kg该废钒催化剂,若转化中钒元素利用率为80%,则最多可回收到
_______ kg(保留小数点后一位)。
 )是接触法生成硫酸的催化剂。从废钒催化剂中回收
)是接触法生成硫酸的催化剂。从废钒催化剂中回收 既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:| 物质 |  |  |  |  |  |  |
| 质量分数/% | 2.20~2.90 | 2.8~3.32 | 22~28 | 60~65 | 1~2 | <1 |
以下是一种废钒催化剂回收工艺路线:

回答下列问题:
(1)“酸浸”时
 转化为
转化为 ,反应的离子方程式为
,反应的离子方程式为 转化为
转化为 。“废渣1”的主要成分是
。“废渣1”的主要成分是(2)“氧化”中使
 变为
变为 ,则“氧化”环节中还原剂与氧化剂的物质的量之比为
,则“氧化”环节中还原剂与氧化剂的物质的量之比为(3)“离子交换”和“洗脱”可简单表示为:
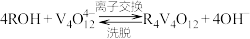 (以ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈
(以ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈(4)检验“流出液”中含量最多的阳离子,其实验操作称为
(5)“煅烧”中发生反应的化学方程式
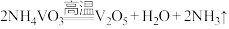 ,写出“沉钒”过程的离子方程式
,写出“沉钒”过程的离子方程式(6)若有1000kg该废钒催化剂,若转化中钒元素利用率为80%,则最多可回收到

您最近一年使用:0次
4 . 工业上用铝土矿(主要成分是Al2O3以及少量Fe2O3、SiO2等),提取纯Al2O3作冶炼铝的原料。提取流程如图表示:

(1)操作I的名称是____ ,此操作所需要的主要玻璃仪器除了漏斗、烧杯外还有____ 。
(2)写出溶液A中加入过量NaOH溶液生成溶液B的离子方程式:____ ;滤渣B的主要成分是____ (填化学式)。
(3)写出溶液B中通入过量CO2产生沉淀的化学方程式:____ ;该步骤中____ (填“能”或“不能”)改用盐酸代替通入CO2,原因是____ 。
(4)若提取的过程中省略了操作I,将对所得的最后产品(Al2O3)产生的影响是_____ 。

(1)操作I的名称是
(2)写出溶液A中加入过量NaOH溶液生成溶液B的离子方程式:
(3)写出溶液B中通入过量CO2产生沉淀的化学方程式:
(4)若提取的过程中省略了操作I,将对所得的最后产品(Al2O3)产生的影响是
您最近一年使用:0次
名校
解题方法
5 . 含钴催化剂废料(含Fe3O4、Co2O3、Al2O3、CaO及SiO2为原料制取Co3O4的一种工艺流程如图:

回答下列问题:
(1)步骤①中将废料磨碎的目的是____ 。
(2)步骤②经溶解后过滤,滤渣1的主要成分为____ (填化学式),滤液中含有____ 种阳离子。
(3)步骤③氧化将Fe2+全部转化为Fe3+,反应的离子方程式为____ 。
(4)步骤⑤灼烧过程中用到的主要仪器为____ ,滤渣2中含有Na2Fe6(SO4)4(OH)x,则x=____ 。

回答下列问题:
(1)步骤①中将废料磨碎的目的是
(2)步骤②经溶解后过滤,滤渣1的主要成分为
(3)步骤③氧化将Fe2+全部转化为Fe3+,反应的离子方程式为
(4)步骤⑤灼烧过程中用到的主要仪器为
您最近一年使用:0次
名校
6 . 精制粗盐(杂质是 、
、 和
和 ),选用NaOH溶液、
),选用NaOH溶液、 溶液、
溶液、 溶液作为除杂试剂,最后用盐酸调节溶液pH,得到精制NaCl。下列说法正确的是
溶液作为除杂试剂,最后用盐酸调节溶液pH,得到精制NaCl。下列说法正确的是
 、
、 和
和 ),选用NaOH溶液、
),选用NaOH溶液、 溶液、
溶液、 溶液作为除杂试剂,最后用盐酸调节溶液pH,得到精制NaCl。下列说法正确的是
溶液作为除杂试剂,最后用盐酸调节溶液pH,得到精制NaCl。下列说法正确的是A.依次向粗盐溶液中加入NaOH、 、 、 溶液 溶液 |
B.用 酸化的 酸化的 溶液检验 溶液检验 是否除尽 是否除尽 |
C.除去 的主要反应是 的主要反应是 |
| D.调节pH后,采用蒸发结晶的方法获得精制NaCl |
您最近一年使用:0次
2022-05-04更新
|
196次组卷
|
7卷引用:北京市中国人民大学附属中学2020-2021学年高一下学期第一次检测化学试题
北京市中国人民大学附属中学2020-2021学年高一下学期第一次检测化学试题2015-2016学年北京市朝阳区高一上学期期末考试化学试卷北京中国人民大学附属中学2020-2021学年高一上学期第一次检测化学试题青海省海东市第二中学2020-2021学年高一上学期期中考试化学试题山东省泰安肥城市2020-2021学年高一上学期期中考试化学试题江西省临川第一中学暨临川一博中学2021-2022学年高一下学期期中检测化学试题(已下线)第14单元 物质的分离、提纯与检验(A卷 基础过关检测)-2021年高考化学一轮复习单元滚动双测卷
解题方法
7 . 溴元素主要以Br-的形式存在于海水中,但浓度很低,提取时需要不断地富集以提高其浓度。利用海水晒盐所得的卤水进行提取,是常用的提溴方法,其过程如图所示。

(1)溴元素的性质与氯元素接近,HBr气体极易溶于水,推测HBr气体在空气中产生的现象为____ ;若要收集HBr气体,应使用向____ (填“上”或“下”)排空气法。
(2)步骤②的离子方程式为____ 。
(3)假设最后在蒸馏时获得1molBr2,理论上从酸化的海水开始至少消耗____ LCl2(标准状况下)。
(4)步骤②所得含Br2的海水不能直接蒸馏获取液溴,而是经过步骤③、④、⑤得到含Br2的溶液再进行蒸馏,其目的是____ 。
(5)Br2与碱反应可生成NaBr和NaBrO3.工业上为了降低成本,将含Br2的空气用Na2CO3溶液吸收,得到NaBr和NaBrO3的混合溶液;再加入稀H2SO4,也可以获得含Br2的溶液,起到步骤④和⑤的效果。加入稀H2SO4酸化所发生反应的离子方程式为____ 。
(6)已知常压下Br2的沸点是59℃。步骤⑥的蒸馏过程中,温度应控制在____ 的范围内较合适。.

(1)溴元素的性质与氯元素接近,HBr气体极易溶于水,推测HBr气体在空气中产生的现象为
(2)步骤②的离子方程式为
(3)假设最后在蒸馏时获得1molBr2,理论上从酸化的海水开始至少消耗
(4)步骤②所得含Br2的海水不能直接蒸馏获取液溴,而是经过步骤③、④、⑤得到含Br2的溶液再进行蒸馏,其目的是
(5)Br2与碱反应可生成NaBr和NaBrO3.工业上为了降低成本,将含Br2的空气用Na2CO3溶液吸收,得到NaBr和NaBrO3的混合溶液;再加入稀H2SO4,也可以获得含Br2的溶液,起到步骤④和⑤的效果。加入稀H2SO4酸化所发生反应的离子方程式为
(6)已知常压下Br2的沸点是59℃。步骤⑥的蒸馏过程中,温度应控制在
| A.20℃~30℃ | B.45℃~55℃ | C.75℃~85℃ | D.100℃~110℃ |
您最近一年使用:0次
名校
解题方法
8 . 某铝土矿中主要含有 ,还含有
,还含有 等杂质。利用拜耳法生产氧化铝的流程如图所示:
等杂质。利用拜耳法生产氧化铝的流程如图所示:

回答下列问题:
(1)将铝土矿粉碎后再进行碱浸,原因是_______ 。
(2)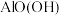 与NaOH溶液反应的化学方程式为
与NaOH溶液反应的化学方程式为_______ 。
(3)滤渣1的主要成分是_______ ,写出它的一种用途_______ 。
(4)加 晶核的目的是促进
晶核的目的是促进 的析出。上述稀释、结晶工艺,也可用通入足量的
的析出。上述稀释、结晶工艺,也可用通入足量的_____ 气体的方法来代替。
(5)实验室中进行焙烧时最适合用来盛放 固体的仪器的名称是
固体的仪器的名称是_______ 。
(6)浓缩所得的NaOH溶液由于吸收了空气中的 而含有杂质,该杂质可通过苛化反应除去,写出苛化反应的化学方程式:
而含有杂质,该杂质可通过苛化反应除去,写出苛化反应的化学方程式:_______ 。
(7)该生产流程能实现_______ (填化学式)的循环利用。
 ,还含有
,还含有 等杂质。利用拜耳法生产氧化铝的流程如图所示:
等杂质。利用拜耳法生产氧化铝的流程如图所示:
回答下列问题:
(1)将铝土矿粉碎后再进行碱浸,原因是
(2)
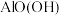 与NaOH溶液反应的化学方程式为
与NaOH溶液反应的化学方程式为(3)滤渣1的主要成分是
(4)加
 晶核的目的是促进
晶核的目的是促进 的析出。上述稀释、结晶工艺,也可用通入足量的
的析出。上述稀释、结晶工艺,也可用通入足量的(5)实验室中进行焙烧时最适合用来盛放
 固体的仪器的名称是
固体的仪器的名称是(6)浓缩所得的NaOH溶液由于吸收了空气中的
 而含有杂质,该杂质可通过苛化反应除去,写出苛化反应的化学方程式:
而含有杂质,该杂质可通过苛化反应除去,写出苛化反应的化学方程式:(7)该生产流程能实现
您最近一年使用:0次
2022-05-01更新
|
425次组卷
|
6卷引用:黑龙江省哈尔滨市第十三中学2020-2021学年高一上学期期末考试化学(理)试题
黑龙江省哈尔滨市第十三中学2020-2021学年高一上学期期末考试化学(理)试题湖南省湘潭市湘潭县第一中学2021-2022学年高三下学期期中考试化学试题(已下线)考点15 铝及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)安徽省亳州市蒙城第一中学东校区2022-2023学年高三上学期第四次月考化学试题(已下线)2023年高考浙江卷化学真题(6月)变式题(工业流程题)(已下线)考点15 铝及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
9 . Ⅰ.某工厂的酸性废水中主要含有Fe3+、Cu2+等离子,为了减少污染并变废为宝,工程师们设计了如图流程,回收铜和绿矾(FeSO4·7H2O)。
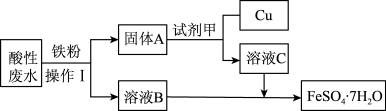
(1)操作1是_______ ;试剂甲是_______ (填化学式)。
(2)获得的FeSO4·7H2O需密闭保存,原因是_______ 。
(3)绿矾可消除某种酸性工业废水中+6价铬( )的污染,使之转化为毒性较小的Cr3+,该反应的离子方程式是
)的污染,使之转化为毒性较小的Cr3+,该反应的离子方程式是_______ 。
(4)黄铜是铜锌合金,是用来制造铜钱的原料,能鉴别黄铜中有金属锌的试剂是_______ (填化学式)。
Ⅱ.某小组为探究Cl2、Br2、I2的氧化性强弱,设计实验如下:
【查阅资料】稀溴水呈黄色;浓溴水呈红棕色;碘水呈棕黄色。
氧化性强弱探究:
【分析与解释】
(5)实验Ⅰ中a试管中反应的离子方程式是_______ 。
(6)通过实验Ⅰ可以得出的结论是_______ 。
(7)①甲同学认为:实验Ⅱ观察到_______ 现象,得出氧化性Br2>I2。
②乙同学对上述实验进行反思,认为实验Ⅱ不能充分证明氧化性Br2>I2,他补做了实验Ⅲ。
补做实验Ⅲ的目的是_______ 。

(1)操作1是
(2)获得的FeSO4·7H2O需密闭保存,原因是
(3)绿矾可消除某种酸性工业废水中+6价铬(
 )的污染,使之转化为毒性较小的Cr3+,该反应的离子方程式是
)的污染,使之转化为毒性较小的Cr3+,该反应的离子方程式是(4)黄铜是铜锌合金,是用来制造铜钱的原料,能鉴别黄铜中有金属锌的试剂是
Ⅱ.某小组为探究Cl2、Br2、I2的氧化性强弱,设计实验如下:
【查阅资料】稀溴水呈黄色;浓溴水呈红棕色;碘水呈棕黄色。
氧化性强弱探究:
| 实验Ⅰ | 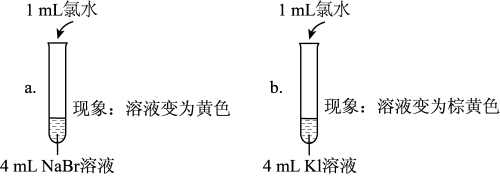 |
| 实验Ⅱ | 取a中的黄色溶液少许,加入KI溶液,再加入淀粉溶液 |
(5)实验Ⅰ中a试管中反应的离子方程式是
(6)通过实验Ⅰ可以得出的结论是
(7)①甲同学认为:实验Ⅱ观察到
②乙同学对上述实验进行反思,认为实验Ⅱ不能充分证明氧化性Br2>I2,他补做了实验Ⅲ。
| 实验Ⅲ | 另取a中的黄色溶液少许,先加入足量的NaBr固体,充分振荡,然后加入KI溶液和淀粉溶液 |
您最近一年使用:0次
2022-04-15更新
|
102次组卷
|
2卷引用:河北省衡水市武强中学2021-2022学年高一上学期第三次月考化学试题
名校
解题方法
10 . 从某含有FeCl2、FeCl3、CuCl2的工业废液中回收铜并制备氯化铁晶体的流程如下:
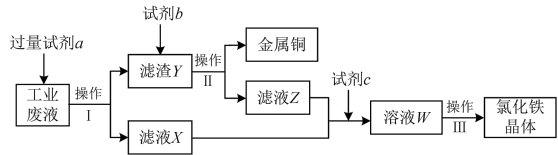
则下列说法正确的是

则下列说法正确的是
| A.试剂a是铁、试剂b是稀硫酸 |
| B.操作Ⅰ、操作Ⅱ、操作Ⅲ所用仪器相同 |
| C.试剂c是氯气,相应的反应为2Fe2++Cl2=2Fe3++2Cl- |
| D.用NaOH溶液可检验溶液W中是否含有Fe2+ |
您最近一年使用:0次



