解题方法
1 . 我国化学家侯德榜发明了联合制碱法,对世界制碱工业做出了巨大贡献。联合制碱法的主要过程如下图所示(部分物质已略去,溶液B中还含有未反应完的NaCl和未完全结晶的NH4Cl)。

(1)① ~ ③所涉及的操作方法中,包含过滤的是_______ (填序号),过滤所用到的玻璃仪器有_______ 。
(2)制备NaHCO3固体时,应向饱和食盐水中先通入_______ (填“NH3”或“CO2”),生成NaHCO3固体的化学方程式:_______ 。
(3)煅烧NaHCO3固体的化学方程式是_______ 。
(4)关于上述过程,下列说法中正确的是_______ (填字母)。
a.侯氏制碱法的工艺过程中应用了物质溶解度的差异
b.副产物NH4Cl可用作肥料
c.煅烧NaHCO3产生的气体和溶液B均可循环使用,提高原料利用率

(1)① ~ ③所涉及的操作方法中,包含过滤的是
(2)制备NaHCO3固体时,应向饱和食盐水中先通入
(3)煅烧NaHCO3固体的化学方程式是
(4)关于上述过程,下列说法中正确的是
a.侯氏制碱法的工艺过程中应用了物质溶解度的差异
b.副产物NH4Cl可用作肥料
c.煅烧NaHCO3产生的气体和溶液B均可循环使用,提高原料利用率
您最近一年使用:0次
解题方法
2 . 为了除去粗盐中的Ca2+、Mg2+、SO 、泥沙等杂质,进行下列五项操作:①过滤 ②加过量NaOH溶液 ③加适量HCl ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液 ⑥溶解 ⑦蒸发,回答下列问题:
、泥沙等杂质,进行下列五项操作:①过滤 ②加过量NaOH溶液 ③加适量HCl ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液 ⑥溶解 ⑦蒸发,回答下列问题:
(1)以上五项操作的步骤为:⑥→①→②→_______→_______→_______→_______→⑦,_______ 。其中加入BaCl2溶液发生的离子反应方程式为:_______ ,加入过量Na2CO3溶液的目的是_______ 。
(2)关于上述过程,错误的是_______
A.溶解粗盐时,加水越多越好
B.NaOH溶液不可用KOH溶液替代
C.滤去沉淀以后,将滤液移至坩埚内加热蒸发
D.当蒸发到剩有少量液体时,停止加热,利用余热将液体蒸干
E.将制得的晶体转移到过滤器中用大量水进行洗涤
(3)NaCl的焰色反应为_______ 色,验证提纯后的NaCl固体中不含KCl的操作及现象是:_______ 。
 、泥沙等杂质,进行下列五项操作:①过滤 ②加过量NaOH溶液 ③加适量HCl ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液 ⑥溶解 ⑦蒸发,回答下列问题:
、泥沙等杂质,进行下列五项操作:①过滤 ②加过量NaOH溶液 ③加适量HCl ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液 ⑥溶解 ⑦蒸发,回答下列问题:(1)以上五项操作的步骤为:⑥→①→②→_______→_______→_______→_______→⑦,
(2)关于上述过程,错误的是
A.溶解粗盐时,加水越多越好
B.NaOH溶液不可用KOH溶液替代
C.滤去沉淀以后,将滤液移至坩埚内加热蒸发
D.当蒸发到剩有少量液体时,停止加热,利用余热将液体蒸干
E.将制得的晶体转移到过滤器中用大量水进行洗涤
(3)NaCl的焰色反应为
您最近一年使用:0次
3 . 某工厂的工业废水中含有大量的FeSO4、较多的Cu2+和少量的Fe3+。为减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。请根据流程图填空,完成回收硫酸亚铁和铜的简单实验方案(成分A、B、C、D既可能是纯净物也可能是混合物,且可相同)。

(1)用化学式填空:试剂1为_______ 、试剂2为_______ 。
(2)操作1、2是同一分离操作,需要用到的玻璃仪器有_______ 。
(3)写出加入试剂1后所发生的离子方程式:_______ ,_______ 。
(4)若取B中溶液2mL,然后滴入NaOH溶液,产生的现象是_______ ,所涉及到的方程式是_______ (如果是是离子反应必须书写离子方程式)
(5)已知FeSO4溶液在近100℃进行蒸发时,FeSO4会因温度过高而与空气中的氧反应导致变质,而溶液沸点随压强减小而下降。为了得到未变质的FeSO4•7H2O固体,“操作3”应采取的操作为:_______ 。
(6)将FeSO4•7H2O 隔绝空气加强热,得到砖红色固体,并放出有刺激性气味的气体,且产物均为化合物。写出反应的方程式:_______ 。

(1)用化学式填空:试剂1为
(2)操作1、2是同一分离操作,需要用到的玻璃仪器有
(3)写出加入试剂1后所发生的离子方程式:
(4)若取B中溶液2mL,然后滴入NaOH溶液,产生的现象是
(5)已知FeSO4溶液在近100℃进行蒸发时,FeSO4会因温度过高而与空气中的氧反应导致变质,而溶液沸点随压强减小而下降。为了得到未变质的FeSO4•7H2O固体,“操作3”应采取的操作为:
(6)将FeSO4•7H2O 隔绝空气加强热,得到砖红色固体,并放出有刺激性气味的气体,且产物均为化合物。写出反应的方程式:
您最近一年使用:0次
解题方法
4 . 选用化学方法除去下列物质中混有的少量杂质,写出有关反应的离子方程式。
(1)氧化铁中混有氧化铝_______ ,_______ 。
(2)氧化铜中混有氧化钠_______ ,_______ 。
(3)铜粉中混有氧化铜_______ ,_______ 。
(4)铁粉中混有氧化亚铁_______ ,_______ 。
(1)氧化铁中混有氧化铝
(2)氧化铜中混有氧化钠
(3)铜粉中混有氧化铜
(4)铁粉中混有氧化亚铁
您最近一年使用:0次
解题方法
5 . 某工厂的工业废水中含有大量的FeSO4、较多的Cu2+和少量的Na+。为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。回收硫酸亚铁和铜的简单实验方案如以下流程图所示。

(1)写出所发生的离子方程式
①加入铁粉:_______
②加入A:_______
(2)写出流程中甲对应的化学物质的化学式_______
(3)流程中操作3包括:_______ 、过滤、洗涤、干燥等系列操作。
(4)操作1需要的玻璃仪器除了烧杯外,还需要_______ 。
(5)FeSO4中的Fe2+极易被空气中氧气氧化为Fe3+,写出检验FeSO4溶液含有Fe3+存在的实验操作_______ 。

(1)写出所发生的离子方程式
①加入铁粉:
②加入A:
(2)写出流程中甲对应的化学物质的化学式
(3)流程中操作3包括:
(4)操作1需要的玻璃仪器除了烧杯外,还需要
(5)FeSO4中的Fe2+极易被空气中氧气氧化为Fe3+,写出检验FeSO4溶液含有Fe3+存在的实验操作
您最近一年使用:0次
名校
解题方法
6 . “侯氏制碱法”是我国化工专家侯德榜为世界制碱工业作出的突出贡献。模拟“侯氏制碱法”以粗盐水为原料制备纯碱的流程如图所示。
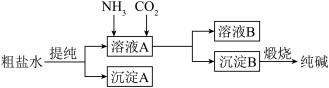
回答下列问题:
(1)粗盐水中含有 杂质,提纯过程应加试剂为
杂质,提纯过程应加试剂为___________ ;沉淀A___________ 电解质(填“是”或“不是”)。
(2)向溶液A中先通入___________ 至饱和(填“ ”或“
”或“ ”,下同),再向溶液中通入
”,下同),再向溶液中通入___________ ,此时观察到溶液中有晶体析出,该反应的化学方程式为___________ 。
(3)溶液B中主要溶质的电离方程式为___________ 。
(4)此流程中可以循环利用的物质是___________ 。

回答下列问题:
(1)粗盐水中含有
 杂质,提纯过程应加试剂为
杂质,提纯过程应加试剂为(2)向溶液A中先通入
 ”或“
”或“ ”,下同),再向溶液中通入
”,下同),再向溶液中通入(3)溶液B中主要溶质的电离方程式为
(4)此流程中可以循环利用的物质是
您最近一年使用:0次
解题方法
7 . 下列各组物质中,X是主体物质,Y是少量杂质,Z是为除去杂质所要加入的试剂,其中所加试剂正确的一组是
| 选项 | A | B | C | D |
| X | FeCl3溶液 | FeCl3溶液 | Fe | NaHCO3 |
| Y | FeCl2 | CuCl2 | Al | Na2CO3 |
| Z | Cl2 | Fe | HCl溶液 | 过量盐酸 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
8 . 海水中含有NaCl、MgCl2等,大量的镁是从海水中提取的,其中主要流程如下:
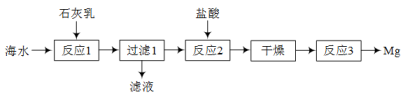
(注:石灰乳的主要成分为氢氧化钙)
(1)滤液中含有的溶质除NaCl外还有_______ 。
(2)反应2的化学方程式为_______ 。
(3)反应3的目的是制取Mg单质,方法是_______ 。

(注:石灰乳的主要成分为氢氧化钙)
(1)滤液中含有的溶质除NaCl外还有
(2)反应2的化学方程式为
(3)反应3的目的是制取Mg单质,方法是
您最近一年使用:0次
名校
解题方法
9 . 海洋中蕴含着丰富的资源,我们通过“浓缩、氧化、提取”等步骤提取其中的溴、碘单质等资源。
为研究海水提溴工艺,甲、乙两同学分别设计了如下实验流程:
甲:苦卤 含溴海水
含溴海水 含溴空气
含溴空气 溴水混合物
溴水混合物 溴蒸气
溴蒸气 液溴
液溴
乙:苦卤 含溴海水
含溴海水 溴蒸气
溴蒸气 液溴
液溴
(1)步骤③通入热空气或水蒸气吹出Br2,利用了溴的__________ 性。甲同学步骤④所发生反应的化学反应方程式为___________________ 。步骤④中SO2被氧化生成 ,写出检验
,写出检验 的方法
的方法___________________ 。
(2)对比甲、乙两流程,最大的区别在于对含溴海水的处理方法不同,其中符合工业生产要求的是_______ (填“甲”或“乙”),理由_____________________________________ 。
海洋植物中富含一种人体必需的微量元素——碘。实验室模拟从海带中提取碘单质的流程图如下:

(3)为寻找氯水的替代品,某同学将O2不断鼓入“溶液A”中。设计实验,判断O2是否能代替氯水。(简要说明所用的试剂、现象和结论)____________________ 。
(4)由于“溶液B”中I2的含量较低,“操作I”能将I2“富集、浓缩”到“有机溶液X”中。已知:I2在以下试剂中的溶解度都大于水,则“试剂a”可以是_________ 。(选填编号)
(5)除操作I可以从碘的有机溶液中提取碘以外,还可用反萃取法,其流程如下:
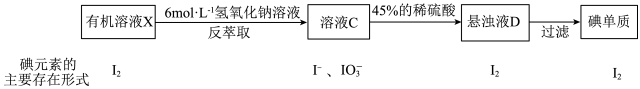
①“配制100g质量分数为45%H2SO4溶液”一定不会用到“配制100mL 6mol·L-1NaOH溶液”中的_____________ 仪器(填名称)。
②相较于操作II,反萃取法的优点在于_______________ 。
为研究海水提溴工艺,甲、乙两同学分别设计了如下实验流程:
甲:苦卤
 含溴海水
含溴海水 含溴空气
含溴空气 溴水混合物
溴水混合物 溴蒸气
溴蒸气 液溴
液溴乙:苦卤
 含溴海水
含溴海水 溴蒸气
溴蒸气 液溴
液溴(1)步骤③通入热空气或水蒸气吹出Br2,利用了溴的
 ,写出检验
,写出检验 的方法
的方法(2)对比甲、乙两流程,最大的区别在于对含溴海水的处理方法不同,其中符合工业生产要求的是
海洋植物中富含一种人体必需的微量元素——碘。实验室模拟从海带中提取碘单质的流程图如下:

(3)为寻找氯水的替代品,某同学将O2不断鼓入“溶液A”中。设计实验,判断O2是否能代替氯水。(简要说明所用的试剂、现象和结论)
(4)由于“溶液B”中I2的含量较低,“操作I”能将I2“富集、浓缩”到“有机溶液X”中。已知:I2在以下试剂中的溶解度都大于水,则“试剂a”可以是
试剂 | A.乙醇 | B.氯仿 | C.四氯化碳 | D.裂化汽油 |
相关性质 | 与水互溶 不与I2反应 | 与水不互溶 不与I2反应 | 与水不互溶 不与I2反应 | 与水不互溶 与I2反应 |
(5)除操作I可以从碘的有机溶液中提取碘以外,还可用反萃取法,其流程如下:

①“配制100g质量分数为45%H2SO4溶液”一定不会用到“配制100mL 6mol·L-1NaOH溶液”中的
②相较于操作II,反萃取法的优点在于
您最近一年使用:0次
2022-12-14更新
|
866次组卷
|
2卷引用:上海市松江二中2021-2022学年高一上学期期末考试化学试题
名校
解题方法
10 . 为探索工业含铝、铁、铜合金废料的再利用,某同学实设计的回收利用方案如图:
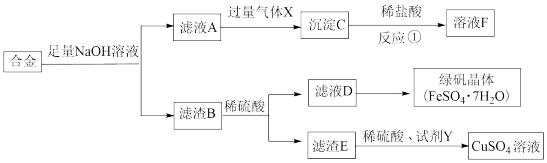
(1)气体X的化学式是_____ 。
(2)检验滤液D是否含有Fe3+的最佳试剂为_____ (填序号)。
(3)若要从滤液D得到绿矾晶体,必须进行的实验操作步骤:_____ 、冷却结晶、过滤、自然干燥。
(4)写出“滤液A”与“过量气体X”反应的离子方程式_____ 。
(5)浓硝酸可以溶解铜,也可以溶解上述合金。若固体未完全溶解,则滤液D中Fe元素将以_____ (填“Fe3+”或“Fe2+”)离子形式存在。

(1)气体X的化学式是
(2)检验滤液D是否含有Fe3+的最佳试剂为
| A.KMnO4 | B.NaOH | C.氯水 | D.KSCN |
(4)写出“滤液A”与“过量气体X”反应的离子方程式
(5)浓硝酸可以溶解铜,也可以溶解上述合金。若固体未完全溶解,则滤液D中Fe元素将以
您最近一年使用:0次
2022-12-13更新
|
228次组卷
|
2卷引用:云南省曲靖市富源县第一中学2020-2021学年高一下学期期中考试化学试题



