名校
1 . 以硅藻土为载体的五氧化二钒(V2O3)是接触法生成硫酸的催化剂。从废钒催化剂中回收V2O3既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
以下是一种废钒催化剂回收工艺路线:
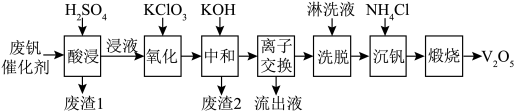
回答下列问题:
(1)“酸浸”时V2O5转化为 , 反应的离子方程式为
, 反应的离子方程式为___________ ,同时V2O4转化为 。“废渣1”的主要成分是
。“废渣1”的主要成分是______ 。
(2)“氧化”中使 变为
变为 , 则“氧化”环节中还原剂与氧化剂的物质的量之比为
, 则“氧化”环节中还原剂与氧化剂的物质的量之比为______ 。
(3)“中和”后的溶液中,钒主要以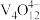 形式存在。“离子交换”和“洗脱”可简单表示为:4ROH+
形式存在。“离子交换”和“洗脱”可简单表示为:4ROH+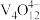
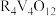 +
+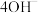 (以ROH 为强碱性阴离子交换树脂)-为了提高洗脱效率, 淋洗液应该呈
(以ROH 为强碱性阴离子交换树脂)-为了提高洗脱效率, 淋洗液应该呈_____ 性(填“敢”或“碱”)。
(4)检验“流出液”中含量最多的阳离子,其实验操作称为___ 。
(5)“煅烧”中发生反应的化学方程式 ,写出“沉钒”过程的离子方程式
,写出“沉钒”过程的离子方程式_________ 。
| 物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
| 质量分数/% | 2.20~2.90 | 2.8~3.32 | 22~28 | 60~65 | 1~2 | <1 |

回答下列问题:
(1)“酸浸”时V2O5转化为
 , 反应的离子方程式为
, 反应的离子方程式为 。“废渣1”的主要成分是
。“废渣1”的主要成分是(2)“氧化”中使
 变为
变为 , 则“氧化”环节中还原剂与氧化剂的物质的量之比为
, 则“氧化”环节中还原剂与氧化剂的物质的量之比为(3)“中和”后的溶液中,钒主要以
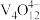 形式存在。“离子交换”和“洗脱”可简单表示为:4ROH+
形式存在。“离子交换”和“洗脱”可简单表示为:4ROH+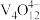
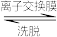
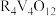 +
+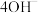 (以ROH 为强碱性阴离子交换树脂)-为了提高洗脱效率, 淋洗液应该呈
(以ROH 为强碱性阴离子交换树脂)-为了提高洗脱效率, 淋洗液应该呈(4)检验“流出液”中含量最多的阳离子,其实验操作称为
(5)“煅烧”中发生反应的化学方程式
 ,写出“沉钒”过程的离子方程式
,写出“沉钒”过程的离子方程式
您最近一年使用:0次
解题方法
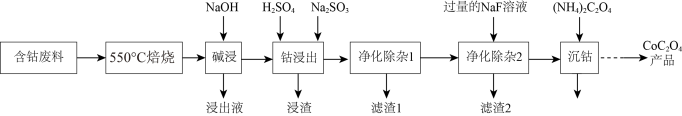
2 . 草酸钴是制作氧化钴和金属钴的原料,一种利用含钴废料(主要成分为Co2O3,含少量Fe2O3、ZnO、Al2O3、CaO、MgO、碳及有机物等)制取CoC2O4的工艺流程如下:
②ZnO与Al2O3化学性质相似,既能溶于强酸又能溶于强碱
(1)“550℃焙烧”的目的是_______ 。
(2)“浸出液”的主要成分是_______ 。
(3)“钴浸出”过程中Co3+转化为Co2+,反应的离子方程式为_______ 。
(4)“净化除杂1”过程中,先在40 ~ 50℃加入H2O2,控制温度不能太高的原因是_______ ,H2O2的作用是_______ (用离子方程式表示)。
(5)在空气中焙烧CoC2O4生成Co3O4和一种气体,请写出该反应的化学方程式:_______ 。
②ZnO与Al2O3化学性质相似,既能溶于强酸又能溶于强碱
(1)“550℃焙烧”的目的是
(2)“浸出液”的主要成分是
(3)“钴浸出”过程中Co3+转化为Co2+,反应的离子方程式为
(4)“净化除杂1”过程中,先在40 ~ 50℃加入H2O2,控制温度不能太高的原因是
(5)在空气中焙烧CoC2O4生成Co3O4和一种气体,请写出该反应的化学方程式:
您最近一年使用:0次
名校
3 . 氯化钠既是我们日常生活中不可缺少的调味品,也是一种重要的化工原料。某化学兴趣小组进行粗盐(主要含有泥沙、Na+、Ca2+、Mg2+、SO42—、Cl—)提纯实验。
Ⅰ.甲同学的操作步骤如图所示:
依据所学知识回答下列问题:
(1)操作①所用的玻璃仪器包括烧杯、___________ ;操作(4)的名称是___________ 。
(2)从产品纯度考虑,试剂a、b、c可以分别为下列选项中的___________ (填选项);加入盐酸时发生反应生成CO2的离子方程式为___________ 。
A.BaCl2溶液、NaOH溶液、Na2SO4溶液
B.NaOH溶液、BaCl2溶液、Na2CO3溶液
C.BaCl2溶液、Na2SO4溶液、NaOH溶液
Ⅱ.乙同学对甲同学的实验进行评价,提出了一些猜想,并设计实验进行验证:
供选择的试剂:稀盐酸、Na2SO4溶液、BaCl2溶液。
(3)完成上述表格中:①___________ ;②___________ ;③___________ ;④___________ 。
(4)根据乙同学的实验,请对甲同学的实验设计进行评价:___________ 。
Ⅰ.甲同学的操作步骤如图所示:

依据所学知识回答下列问题:
(1)操作①所用的玻璃仪器包括烧杯、
(2)从产品纯度考虑,试剂a、b、c可以分别为下列选项中的
A.BaCl2溶液、NaOH溶液、Na2SO4溶液
B.NaOH溶液、BaCl2溶液、Na2CO3溶液
C.BaCl2溶液、Na2SO4溶液、NaOH溶液
Ⅱ.乙同学对甲同学的实验进行评价,提出了一些猜想,并设计实验进行验证:
| 猜想 | 验证的方法 | 现象 | 结论 |
| 猜想1:固体A中含BaCO3 | 取少量固体A于试管中,先加入足量①___________,再加入②___________ | 有气泡产生,无白色沉淀 | ③___________ |
| 猜想2:最后制得的NaCl晶体中还含有Na2SO4 | 取少量提纯后的NaCl晶体于试管中,加入适量的蒸馏水溶解,滴入稀HNO3和BaCl2溶液 | ④___________ | 猜想2成立 |
(3)完成上述表格中:①
(4)根据乙同学的实验,请对甲同学的实验设计进行评价:
您最近一年使用:0次
名校
解题方法
4 . 碱式氧化镍是镍电池的正极活性材料。利用镍渣(主要含NiO,及少量 、CuO、CaO、
、CuO、CaO、 等杂质)制备碱式氧化镍的流程如下:
等杂质)制备碱式氧化镍的流程如下:
(2)浸渣的主要成分是_______ 。
(3)“沉铜”过程中生成单质S的离子方程式为______ 。
(4)“氧化”中的目的是将 氧化为
氧化为 ,试剂R可选用
,试剂R可选用_____ (填标号)。写出“氧化”时反应的离子方程式:_____ 。
A.氯水 B. 酸性溶液 C.
酸性溶液 C.
(5)碱式氧化镍(NiOOH)可用作镍氢电池的正极材料,电池的总反应为
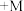 ,其工作时的正极电极反应式为
,其工作时的正极电极反应式为_______ 。
(6)若用2.0t废料(含NiO75%)制得NiOOH 0.92 t,则NiOOH的产率为_____ %。
 、CuO、CaO、
、CuO、CaO、 等杂质)制备碱式氧化镍的流程如下:
等杂质)制备碱式氧化镍的流程如下: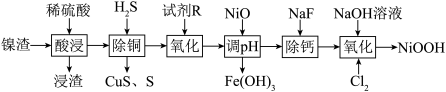
| A.研磨废料 | B.加入大量水 | C.搅拌 | D.适当升高温度 |
(2)浸渣的主要成分是
(3)“沉铜”过程中生成单质S的离子方程式为
(4)“氧化”中的目的是将
 氧化为
氧化为 ,试剂R可选用
,试剂R可选用A.氯水 B.
 酸性溶液 C.
酸性溶液 C.
(5)碱式氧化镍(NiOOH)可用作镍氢电池的正极材料,电池的总反应为

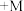 ,其工作时的正极电极反应式为
,其工作时的正极电极反应式为(6)若用2.0t废料(含NiO75%)制得NiOOH 0.92 t,则NiOOH的产率为
您最近一年使用:0次
2024-05-03更新
|
216次组卷
|
2卷引用:广东省深圳市翠园中学、龙城高级中学2023-2024学年高一下学期第一次月考化学试题
名校
解题方法
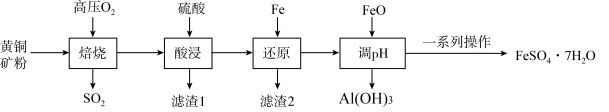
5 . 绿矾(FeSO4⋅7H2O))是一种重要的药物,也是一种工业原料。一种以黄铜矿(主要成分是CuFeS2,含SiO2、Al2O3等杂质)为原料制备绿矾的流程如图:
(1)“焙烧”时,需将黄铜矿粉碎,其目的是_______ ;高温“焙烧”过程中生成了三种氧化物,其化学方程式是_______ 。
(2)滤渣1的主要成分为_______ (填化学式,下同);滤渣2的主要成分为_______ 。
(3)“一系列操作”为:_______ 、_______ 、过滤、洗涤、干燥。
(4)硫代硫酸钠(Na2S2O3)俗称“海波”或“大苏打”,也是一种重要的含硫盐。在酸性条件下不稳定,易生成一种固体和一种气体,其离子方程式为_______ 。
(5)绿矾在空气中容易被部分氧化。现取被部分氧化的绿矾晶体溶于稀盐酸后,加入足量的BaCl2溶液,过滤得沉淀9.32g;再通入112mL(标准状况)氯气恰好将其中的Fe2+完全氧化。推测所取晶体中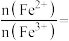
_______ 。
(1)“焙烧”时,需将黄铜矿粉碎,其目的是
(2)滤渣1的主要成分为
(3)“一系列操作”为:
(4)硫代硫酸钠(Na2S2O3)俗称“海波”或“大苏打”,也是一种重要的含硫盐。在酸性条件下不稳定,易生成一种固体和一种气体,其离子方程式为
(5)绿矾在空气中容易被部分氧化。现取被部分氧化的绿矾晶体溶于稀盐酸后,加入足量的BaCl2溶液,过滤得沉淀9.32g;再通入112mL(标准状况)氯气恰好将其中的Fe2+完全氧化。推测所取晶体中
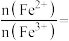
您最近一年使用:0次
6 . 某中学研究性学习小组的以黄铁矿 (杂质为石英)为原料,设计了如下工艺流程:
(杂质为石英)为原料,设计了如下工艺流程:
(1)在空气中焙烧黄铁矿的化学方程式为:__________________________ 。
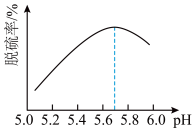
(2)研究发现,pH和温度对石灰石浆液的脱硫效率有一定影响。当烟气通入速度一定时,石灰石浆液的脱硫率与浆液pH的关系如图所示( )。
)。__________ 。
a.烟气通入石灰石浆液时的温度越高,吸收越快,吸收率越高
b.反应时需鼓入足量的空气以保证 被充分氧化生成
被充分氧化生成
c.将脱硫后的气体通入 溶液,可粗略判断烟气脱硫效率
溶液,可粗略判断烟气脱硫效率
d.石灰石浆液pH>5.7烟气脱硫效果降低,是因为石灰石的溶解程度增大
(3)写出反应Ⅱ的化学反应方程式_____________________ 。检验反应Ⅱ所得的滤液中所含阴离子的方法是____________________________ 。
(4)向红渣酸浸得到的滤液中加入适量铁粉还原,再由还原后的滤液制得 的操作为:
的操作为:__________ 、__________ 、过滤、洗涤、干燥。
(5)反应①反应方程式是______________ 。从反应①至④制取高纯多晶硅的过程中可以循环利用的物质有____________________ 。
 (杂质为石英)为原料,设计了如下工艺流程:
(杂质为石英)为原料,设计了如下工艺流程: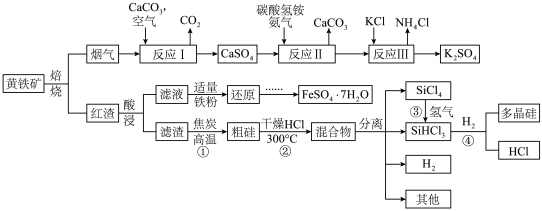
(1)在空气中焙烧黄铁矿的化学方程式为:
(2)研究发现,pH和温度对石灰石浆液的脱硫效率有一定影响。当烟气通入速度一定时,石灰石浆液的脱硫率与浆液pH的关系如图所示(
 )。
)。
a.烟气通入石灰石浆液时的温度越高,吸收越快,吸收率越高
b.反应时需鼓入足量的空气以保证
 被充分氧化生成
被充分氧化生成
c.将脱硫后的气体通入
 溶液,可粗略判断烟气脱硫效率
溶液,可粗略判断烟气脱硫效率d.石灰石浆液pH>5.7烟气脱硫效果降低,是因为石灰石的溶解程度增大
(3)写出反应Ⅱ的化学反应方程式
(4)向红渣酸浸得到的滤液中加入适量铁粉还原,再由还原后的滤液制得
 的操作为:
的操作为:(5)反应①反应方程式是
您最近一年使用:0次
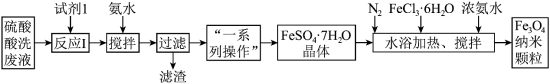
7 . 工业废水处理是沙头角污水处理中心的重要业务。一种处理钢厂酸洗废水(含Fe3+、Fe2+、Al3+等)的工艺流程如下图所示:
回答下列问题:
(1)试剂1是___________ 。反应I的离子方程式为___________ 。
如何检验反应I后的溶液中是否含有Fe3+___________ 。
(2)加入少量氨水的目的是调节pH,操作时需控制pH值的范围为___________ 。
(3)“一系列操作”包括:蒸发浓缩,冷却结晶,___________ 。
(4)通入N2的目的是___________ 。
(5)制备Fe3O4纳米颗粒的离子方程式为___________ 。
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(1)试剂1是
如何检验反应I后的溶液中是否含有Fe3+
(2)加入少量氨水的目的是调节pH,操作时需控制pH值的范围为
(3)“一系列操作”包括:蒸发浓缩,冷却结晶,
(4)通入N2的目的是
(5)制备Fe3O4纳米颗粒的离子方程式为
您最近一年使用:0次
名校
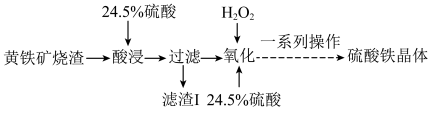
8 . 硫酸铁是水处理行业用作净水的混凝剂和污泥的处理剂,广泛用于水的处理。一种以黄铁矿烧渣(主要成分为Fe2O3、FeO、SiO2等)为原料制取硫酸铁晶体的工艺流程如下:
(1)滤渣Ⅰ的主要成分是____________ (填化学式)。
(2)在实验操作中常需要在加入氧化剂H2O2之前,对过滤后的滤液进行取样分析,取样分析的目的是____________________________ 。
(3)“酸浸”后过滤所得滤液中所含的阳离子有_________________ (填离子符号)。
(4)“氧化”过程发生的反应的离子方程式为_________________ ;“氧化”时可用硝酸代替氧化剂H2O2,优点是原料成本低,缺点是________________ 。
为除去粗盐水中含有的杂质SO 、Ca2+和Mg2+,得到精盐,某同学设计了如下实验流程:
、Ca2+和Mg2+,得到精盐,某同学设计了如下实验流程:_________ ;
(6)写出操作③的离子方程式_________ , _________ ;
(7)在“粗食盐的提纯”实验中,用蒸发皿蒸发滤液时,下列操作正确的是( )
(1)滤渣Ⅰ的主要成分是
(2)在实验操作中常需要在加入氧化剂H2O2之前,对过滤后的滤液进行取样分析,取样分析的目的是
(3)“酸浸”后过滤所得滤液中所含的阳离子有
(4)“氧化”过程发生的反应的离子方程式为
为除去粗盐水中含有的杂质SO
 、Ca2+和Mg2+,得到精盐,某同学设计了如下实验流程:
、Ca2+和Mg2+,得到精盐,某同学设计了如下实验流程: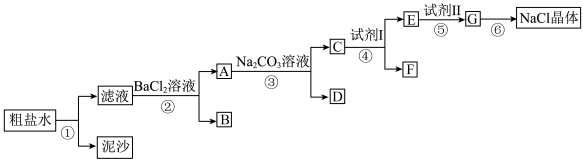
(6)写出操作③的离子方程式
(7)在“粗食盐的提纯”实验中,用蒸发皿蒸发滤液时,下列操作正确的是( )
| A.把浑浊的滤液倒入蒸发皿里,进行加热 | B.待滤液完全蒸干后,停止加热 |
| C.等到开始出现固体时,用玻璃棒不断搅拌液体 | D.等到出现大量固体时,停止加热 |
您最近一年使用:0次
名校
9 . 某同学对某种粗盐(杂质有CaCl2、MgCl2)进行提纯实验,步骤见下图所示。
(2)检验NaCl溶液说法正确的是 。

| A.操作过程①②是过滤 | B.固体A是CaCO3、MgCO3 |
| C.Na2CO3溶液过量的原因是除尽Ca2+ 、Mg2+ | D.蒸发所用主要仪器是坩埚,可直接蒸干 |
| A.做焰色实验,火焰呈黄色说明有钠元素,即有Na+ |
| B.取适量溶液用硝酸酸化,再加硝酸银溶液,有白色沉淀,说明有Cl- |
| C.做焰色实验,火焰呈黄色说明有钠元素,但不能确定是否有钾元素 |
| D.检验Cl-也可用盐酸酸化,排除干扰离子 |
您最近一年使用:0次
名校
10 . 除去粗盐中的Ca2+、Mg2+、 及泥沙,可先将粗盐溶于水,然后进行下列操作:
及泥沙,可先将粗盐溶于水,然后进行下列操作:
①过滤②加过量的NaOH溶液③加适量盐酸④加过量Na2CO3溶液⑤加过量BaCl2溶液。正确的操作顺序是
 及泥沙,可先将粗盐溶于水,然后进行下列操作:
及泥沙,可先将粗盐溶于水,然后进行下列操作:①过滤②加过量的NaOH溶液③加适量盐酸④加过量Na2CO3溶液⑤加过量BaCl2溶液。正确的操作顺序是
| A.①④②⑤③ | B.④①②⑤③ | C.②④⑤①③ | D.⑤②④①③ |
您最近一年使用:0次
2024-04-11更新
|
168次组卷
|
2卷引用:广东省江门市某校2023-2024学年高一下学期第一次质量检测化学试题



