名校
1 . 某工厂的工业废水中含有大量的FeSO4和CuSO4,为了减少污染并变废为宝,工厂拟定用以下流程从该废水中回收FeSO4和金属Cu,请根据以下流程图,回答相关问题:

(1)操作Ⅰ和操作Ⅱ分离固体和溶液的方法是______ 。
(2)为了将CuSO4完全转化,步骤①加入的铁粉应______ (选填“过量”或“少量”),其对应的离子方程式为______ 。
(3)固体A的成分是铁和______ (填名称)。
(4)步骤②加入试剂B的稀溶液,B的化学式为______ ,该物质在该反应中作______ 剂(选填“氧化”或“还原")。
(5)取1~2mLFeSO4溶液于试管中,滴加几滴NaOH溶液,生成的白色沉淀迅速变为灰绿色,最后变成______ 色。写出白色沉淀变色发生的化学方程式为______ 。
(6)另取l~2mLFeSO4溶液于试管中,滴加几滴氯水,该反应的离子方程式为______ ,向反应后的溶液中再滴加几滴______ 溶液,溶液变为血红色。

(1)操作Ⅰ和操作Ⅱ分离固体和溶液的方法是
(2)为了将CuSO4完全转化,步骤①加入的铁粉应
(3)固体A的成分是铁和
(4)步骤②加入试剂B的稀溶液,B的化学式为
(5)取1~2mLFeSO4溶液于试管中,滴加几滴NaOH溶液,生成的白色沉淀迅速变为灰绿色,最后变成
(6)另取l~2mLFeSO4溶液于试管中,滴加几滴氯水,该反应的离子方程式为
您最近一年使用:0次
名校
2 . 由粗SiO2制备纯SiO2的流程如图所示,下列说法不正确的是
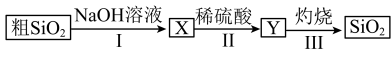
| A.X可用作木材防火剂 |
B.步骤Ⅱ的反应是 |
| C.步骤Ⅱ中的稀硫酸不可用CO2替代 |
| D.若在实验室中完成步骤Ⅲ,一般在蒸发皿中进行 |
您最近一年使用:0次
2023-09-24更新
|
65次组卷
|
16卷引用:广东省佛山市顺德区容山中学2022-2023学年高一下学期3月月考化学试题
广东省佛山市顺德区容山中学2022-2023学年高一下学期3月月考化学试题2015-2016学年北京市朝阳区高一上学期期末考试化学试卷安徽省定远重点中学2018-2019学年高一下学期开学考试化学试题【全国百强校】四川省阆中中学2018-2019学年高一下学期期中考试化学试题必修第二册RJ第5章第三节 无机非金属材料 易错疑难集训(三)江苏省南京市中华中学2020-2021学年高一下学期期中考试化学试题人教版(2019)必修第二册第五章第三节 易错疑难集训陕西省横山清源中学2022-2023学年高一下学期3月月考化学试题吉林省长春市新解放学校2022-2023学年高一下学期4月月考化学试题浙江台州市永宁中学(筹)2022-2023学年高一下学期3月月考化学试题河南省洛阳市第一高级中学2022-2023学年高一下学期3月月考化学试题江西省乐安县第二中学2022-2023学年高一下学期5月期中考试化学试题(已下线)合格考汇编8硅及其化合物安徽省芜湖市第一中学2022-2023学年高一下学期3月份教学质量诊断测试化学试卷黑龙江省哈尔滨市第三中学校2022-2023学年高二上学期开学验收考试化学试题新疆维吾尔自治区乌鲁木齐市第101中学2023-2024学年高二上学期开学考试化学试题
名校
解题方法
3 . 某工厂以镍废渣(主要成分为 Ni,含少量 Fe、Fe3O4 、Al2O3 和不溶性杂质等)为原料制备翠矾 ( NiSO4 7H2O ),其生产工艺如下:
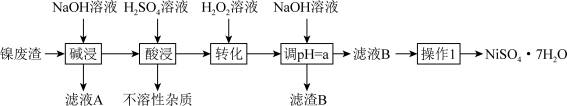
该流程中几种金属离子生成对应氢氧化物沉淀的 pH 如下表。回答下列问题:
(1)“滤液 A”中主要溶质的化学式为___________ 。
(2)“转化”过程中加入H2O2 的目的是将“酸浸”后溶液中的Fe2 氧化为Fe3 ,该过程用离子方程式表示为___________ ;“转化”过程中温度不宜过高,原因是__________ 。
(3)调节pH a ,是为了将溶液中的___________ 元素完全沉淀,则 a 的取值范围是___________ 。证明杂质离子已经被完全除去的实验操作及现象是:取少量滤液 B 于试管中,___________ 。
(4)“操作 1”的目的是将硫酸镍溶液变成NiSO4 7H2O ,具体操作是将溶液进行蒸发浓缩、___________ 、___________ 、洗涤、干燥。

该流程中几种金属离子生成对应氢氧化物沉淀的 pH 如下表。回答下列问题:
| 金属离子 | 开始沉淀的 pH | 完全沉淀的 pH |
| Fe3 | 2.7 | 3.7 |
| Fe2 | 7.6 | 9.7 |
| Ni2 | 7.1 | 9.2 |
(1)“滤液 A”中主要溶质的化学式为
(2)“转化”过程中加入H2O2 的目的是将“酸浸”后溶液中的Fe2 氧化为Fe3 ,该过程用离子方程式表示为
(3)调节pH a ,是为了将溶液中的
(4)“操作 1”的目的是将硫酸镍溶液变成NiSO4 7H2O ,具体操作是将溶液进行蒸发浓缩、
您最近一年使用:0次
名校
4 . 利用油脂厂废弃的镍(Ni)催化剂(主要含有Ni、Al、Fe及少量 、
、 、
、 )制备
)制备 的工艺流程如下:
的工艺流程如下:
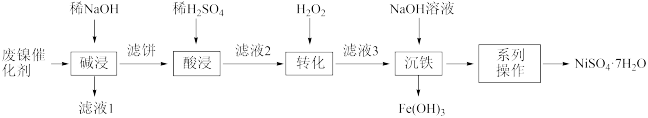
回答下列问题:
(1)为加快“碱浸”的速率可采取的措施是___________ (任写一条);
(2)“碱浸”中 的作用有:去除油脂、
的作用有:去除油脂、___________ ;
(3)“滤液2”中含金属阳离子,主要有:___________ ;
(4)①“转化”中反应的离子方程式是___________ , 也能转化
也能转化 ,工业生产中不选用
,工业生产中不选用 的原因是
的原因是___________ ;
②“转化”中可替代 的最佳物质是
的最佳物质是___________ (填标号);
a. b.
b. c.Fe
c.Fe
(5)“转化”时,应控制的pH范围为___________ ;
(6)某温度下, 分解得到铁、氧质量比为
分解得到铁、氧质量比为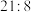 的氧化物,其化学式为
的氧化物,其化学式为___________ 。
 、
、 、
、 )制备
)制备 的工艺流程如下:
的工艺流程如下:
回答下列问题:
(1)为加快“碱浸”的速率可采取的措施是
(2)“碱浸”中
 的作用有:去除油脂、
的作用有:去除油脂、(3)“滤液2”中含金属阳离子,主要有:
(4)①“转化”中反应的离子方程式是
 也能转化
也能转化 ,工业生产中不选用
,工业生产中不选用 的原因是
的原因是②“转化”中可替代
 的最佳物质是
的最佳物质是a.
 b.
b. c.Fe
c.Fe(5)“转化”时,应控制的pH范围为
| 氢氧化物 |  |  |  |  |
| 开始沉淀的pH | 7.5 | 2.2 | 4.1 | 6.4 |
| 沉淀完全的pH | 9.5 | 3.5 | 5.4 | 8.4 |
 分解得到铁、氧质量比为
分解得到铁、氧质量比为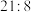 的氧化物,其化学式为
的氧化物,其化学式为
您最近一年使用:0次
名校
解题方法
5 . 钛合金密度较小,常温下特别稳定,耐酸碱腐蚀,韧性好,高温下海绵状钛能与氧气反应,是航空、军工、电力等领域的必须金属材料。
Ⅰ.由钛铁矿(主要成分是钛酸亚铁: ,还含有少量
,还含有少量 、
、 等杂质)制备
等杂质)制备 的一种工艺流程示意如下:
的一种工艺流程示意如下:
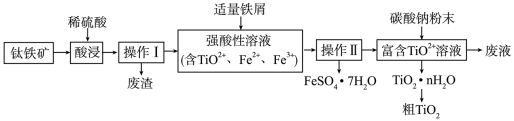
回答下列问题:
(1) 中Ti的化合价为
中Ti的化合价为_______ 。
(2)“酸浸”中, 反应的离子方程式为
反应的离子方程式为_______ 。
(3)加入铁屑的作用是_______ 。
(4)①实验室完成“操作Ⅰ”需用到的玻璃仪器有烧杯、_______ ,废渣的主要成分是_______ ,②实验室完成“操作Ⅱ”包含的具体操作有蒸发浓缩,_______ ,过滤,洗涤,干燥。
Ⅱ.以 为原料,采用亨特(Hunter)法生产钛的流程如下:
为原料,采用亨特(Hunter)法生产钛的流程如下:
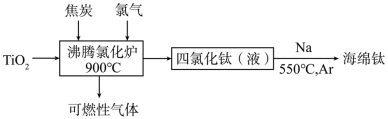
(5)沸腾氯化炉中反应的化学方程式为_______ 。
(6)制备海绵钛中Ar的作用是_______ 。
Ⅰ.由钛铁矿(主要成分是钛酸亚铁:
 ,还含有少量
,还含有少量 、
、 等杂质)制备
等杂质)制备 的一种工艺流程示意如下:
的一种工艺流程示意如下:
回答下列问题:
(1)
 中Ti的化合价为
中Ti的化合价为(2)“酸浸”中,
 反应的离子方程式为
反应的离子方程式为(3)加入铁屑的作用是
(4)①实验室完成“操作Ⅰ”需用到的玻璃仪器有烧杯、
Ⅱ.以
 为原料,采用亨特(Hunter)法生产钛的流程如下:
为原料,采用亨特(Hunter)法生产钛的流程如下:
(5)沸腾氯化炉中反应的化学方程式为
(6)制备海绵钛中Ar的作用是
您最近一年使用:0次
6 . 利用电解铜废液(主要成分是 、
、 等)浸出烟尘(主要成分是CuO、ZnO、PbO等)制备硫酸铜和硫酸锌的工艺路线如图所示。
等)浸出烟尘(主要成分是CuO、ZnO、PbO等)制备硫酸铜和硫酸锌的工艺路线如图所示。

已知:有机物HR难溶于水,可以捕获 ,其原理为
,其原理为 。
。
回答下列问题:
(1)“浸出”时,为了提高浸出率,可以采取措施___________ (答两种),滤渣的主要成分是___________ (写化学式),写出ZnO和硫酸反应的离子方程式___________ 。
(2)浸出率随电解废液用量的变化如下图,最佳电解废液用量是___________ mL/g。

(3)“水层”经___________ 、___________ 、过滤、洗涤,得到 晶体。
晶体。
(4)“反蒸”时可以加入___________,有利于硫酸铜固体析出。
(5)已知: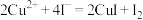 ,
, 。称取硫酸铜固体5.0g,加入适量稀硫酸和水配成溶液,加入过量的KI溶液(杂质不参与反应),再加入几滴淀粉溶液,用
。称取硫酸铜固体5.0g,加入适量稀硫酸和水配成溶液,加入过量的KI溶液(杂质不参与反应),再加入几滴淀粉溶液,用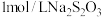 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液30mL,硫酸铜固体的纯度为
溶液30mL,硫酸铜固体的纯度为______ 。
 、
、 等)浸出烟尘(主要成分是CuO、ZnO、PbO等)制备硫酸铜和硫酸锌的工艺路线如图所示。
等)浸出烟尘(主要成分是CuO、ZnO、PbO等)制备硫酸铜和硫酸锌的工艺路线如图所示。
已知:有机物HR难溶于水,可以捕获
 ,其原理为
,其原理为 。
。回答下列问题:
(1)“浸出”时,为了提高浸出率,可以采取措施
(2)浸出率随电解废液用量的变化如下图,最佳电解废液用量是

(3)“水层”经
 晶体。
晶体。(4)“反蒸”时可以加入___________,有利于硫酸铜固体析出。
| A.HR | B.硫酸溶液 | C.蒸馏水 | D.NaOH溶液 |
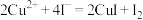 ,
, 。称取硫酸铜固体5.0g,加入适量稀硫酸和水配成溶液,加入过量的KI溶液(杂质不参与反应),再加入几滴淀粉溶液,用
。称取硫酸铜固体5.0g,加入适量稀硫酸和水配成溶液,加入过量的KI溶液(杂质不参与反应),再加入几滴淀粉溶液,用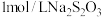 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液30mL,硫酸铜固体的纯度为
溶液30mL,硫酸铜固体的纯度为
您最近一年使用:0次
名校
解题方法
7 . 实验方案合理的是
| A.金属钠若着火用水扑灭 | B.用碱石灰干燥NH3 |
| C.往浓硫酸中加水稀释配制稀硫酸 | D.用NaOH除去K2SO4中的MgSO4 |
您最近一年使用:0次
解题方法
8 . 铁泥是一种常见的工业废料(主要成分为Fe2O3、FeO、Fe及杂质,杂质与酸不反应,难溶于水),可用于生产柠檬酸铁铵或磁性氧化铁,具体流程如图。

回答下列问题:
(1)“溶解”时,Fe2O3与硫酸反应的离子方程式为_____ 。
(2)制备柠檬酸铁铵
①写出“氧化”时发生反应的离子方程式并用单线桥表示该反应的电子转移情况_____ 。
②“氧化”时控制温度不超过90℃的原因是______ 。
(3)制备磁性氧化铁
①“还原”时,加入的试剂X为_____ (填化学式)。
②“操作I”为沉化、______ 、洗涤至滤液呈______ 性(填“酸、中、碱”)、干燥。
③在氩气中加热草酸亚铁晶体(FeC2O4∙2H2O),随温度升高,FeC2O4∙2H2O的质量变化曲线出现两个失重“台阶”,如图所示。结合表格,计算第一阶段的质量损失率为______ (保留4位有效数字),推断第二阶段产生的气体为______ 。
(质量损失率=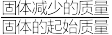 ×100%)
×100%)


回答下列问题:
(1)“溶解”时,Fe2O3与硫酸反应的离子方程式为
(2)制备柠檬酸铁铵
①写出“氧化”时发生反应的离子方程式并用单线桥表示该反应的电子转移情况
②“氧化”时控制温度不超过90℃的原因是
(3)制备磁性氧化铁
①“还原”时,加入的试剂X为
②“操作I”为沉化、
③在氩气中加热草酸亚铁晶体(FeC2O4∙2H2O),随温度升高,FeC2O4∙2H2O的质量变化曲线出现两个失重“台阶”,如图所示。结合表格,计算第一阶段的质量损失率为
(质量损失率=
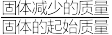 ×100%)
×100%) 
| 失重阶段 | 温度范围/℃ | 质量损失率% | 产物 |
| 第一阶段 | 室温~255 | _____ | FeC2O4 |
| 第二阶段 | 255-520 | 37.06 | Fe3O4 |
您最近一年使用:0次
2023-01-11更新
|
307次组卷
|
2卷引用:广东省佛山市2022-2023学年高一上学期普通高中教学质量检测化学试题
名校
解题方法
9 . 铁有两种氯化物,都是重要的化工试剂。它们的一些性质及制备方法如表:
实验室可用如图所示的装置模拟工业生产无水氯化铁。下列说法正确的是

| 物质 | 性质 | 工业制备方法 |
| FeCl3 | 易升华,易潮解 | 向500~600℃的铁粉中通入氯气 |
| FeCl2 | 易升华 | 向炽热铁粉中通入氯化氢 |

| A.装置A中药品为浓盐酸和MnO2 | B.把a管换成细导管,实验更安全 |
| C.装置C中的产品可能混有FeCl2 | D.b管接装置D的效果优于接装置E |
您最近一年使用:0次
2023-01-11更新
|
489次组卷
|
3卷引用:广东省佛山市2022-2023学年高一上学期普通高中教学质量检测化学试题
解题方法
10 . 某合金主要成分为Zn、Fe、Cu,某兴趣小组利用该合金制成的机械零件废弃物,按下列流程制备七水合硫酸锌( )。
)。

已知: 是常用的氧化剂,通常可以将变价金属离子由低化合价氧化成高化合价;金属离子形成氢氧化物沉淀的相关pH范围如下表:
是常用的氧化剂,通常可以将变价金属离子由低化合价氧化成高化合价;金属离子形成氢氧化物沉淀的相关pH范围如下表:
回答下列问题:
(1)写出“酸浸”过程中Zn发生反应的化学方程式_______ 。
(2)“酸浸”和“调pH”后要把固液分离,所进行的操作是_______ ,在实验室进行这步操作所用到的玻璃仪器有烧杯、玻璃棒和_______ 。
(3) 中氧元素的化合价是
中氧元素的化合价是_______ ,“氧化”时加入的 要足量,原因是
要足量,原因是_______ 。
(4)“调pH”时为了不除去 ,合适的pH范围是
,合适的pH范围是_______ 。
(5)从滤液II中得到 的操作步骤是:
的操作步骤是:_______ 、过滤、洗涤、干燥。
(6) 在一定温度下完全脱去结晶水,继续升温可分解为ZnO和一种氧化物。
在一定温度下完全脱去结晶水,继续升温可分解为ZnO和一种氧化物。
①该氧化物的化学式是_______ 。
②试计算:14.35g 完全分解得到ZnO的质量
完全分解得到ZnO的质量_______ ,写出计算过程( 的式量是287)。
的式量是287)。
 )。
)。
已知:
 是常用的氧化剂,通常可以将变价金属离子由低化合价氧化成高化合价;金属离子形成氢氧化物沉淀的相关pH范围如下表:
是常用的氧化剂,通常可以将变价金属离子由低化合价氧化成高化合价;金属离子形成氢氧化物沉淀的相关pH范围如下表:| 金属离子 | pH | |
| 开始沉淀 | 完全沉淀 | |
 | 1.5 | 2.8 |
 | 5.5 | 8.3 |
 | 5.4 | 8.2 |
(1)写出“酸浸”过程中Zn发生反应的化学方程式
(2)“酸浸”和“调pH”后要把固液分离,所进行的操作是
(3)
 中氧元素的化合价是
中氧元素的化合价是 要足量,原因是
要足量,原因是(4)“调pH”时为了不除去
 ,合适的pH范围是
,合适的pH范围是(5)从滤液II中得到
 的操作步骤是:
的操作步骤是:(6)
 在一定温度下完全脱去结晶水,继续升温可分解为ZnO和一种氧化物。
在一定温度下完全脱去结晶水,继续升温可分解为ZnO和一种氧化物。①该氧化物的化学式是
②试计算:14.35g
 完全分解得到ZnO的质量
完全分解得到ZnO的质量 的式量是287)。
的式量是287)。
您最近一年使用:0次



