解题方法
1 . 氢氧化氧镍(NiOOH)有良好的电化学活性,是合成锂离子电池材料的前驱体。某化工厂用含镍废料(主要成分为NiO,杂质为Fe3O4、CaO、CuO)制备NiOOH的工艺流程如图。

已知几种金属离子沉淀的pH如表:
(1)为了提高“酸浸”中原料的浸出效率,采取的措施不合理的有_______。
(2)料渣2的主要成分是_______ (填化学式)。
(3)“除铜”中发生两个反应,写出其中生成CuS的离子方程式_______ 。
(4)“除铁”在40~50℃下进行,加入H2O2的作用是_______ ,NaOH用于调节溶液的pH,应调节pH的范围是_______ 。
(5)NiOOH中Ni的化合价为_______ 。
(6)若用2.0t废料(含NiO75%)制得NiOOH 1.6t,则NiOOH的产率为_______ %(保留两位有效数字)。

已知几种金属离子沉淀的pH如表:
| 金属离子 | Fe3+ | Fe2+ | Ni2+ |
| 开始沉淀的pH | 1.5 | 6.5 | 7.2 |
| 沉淀完全的pH | 3.2 | 9.7 | 9.2 |
(1)为了提高“酸浸”中原料的浸出效率,采取的措施不合理的有_______。
| A.研磨废料 | B.加入大量水 | C.搅拌 | D.适当升高温度 |
(2)料渣2的主要成分是
(3)“除铜”中发生两个反应,写出其中生成CuS的离子方程式
(4)“除铁”在40~50℃下进行,加入H2O2的作用是
(5)NiOOH中Ni的化合价为
(6)若用2.0t废料(含NiO75%)制得NiOOH 1.6t,则NiOOH的产率为
您最近一年使用:0次
解题方法
2 . 某废旧金属材料中主要含Fe、Cu、Al、 、FeO、
、FeO、 、CuO和可燃性有机物,现利用如图所示工艺流程回收部分金属及金属化合物。
、CuO和可燃性有机物,现利用如图所示工艺流程回收部分金属及金属化合物。

已知:绿矾为 ,试剂a为固体。
,试剂a为固体。
回答下列问题:
(1)“焙烧”的目的是将金属单质转化为氧化物,并除去_____ 。
(2)“碱浸”时发生反应的固体为_____ 。
(3)“操作Ⅰ”的名称为_____ 。
(4)试剂a为_____ (填化学式),加入试剂a后可能发生的反应是_____ (写出其中一个反应的离子方程式即可)。
(5)“滤液Ⅱ”中可能含有因氧气的作用而产生的少量_____ (填离子符号),检验该离子的试剂是_____ ,若有该离子,则现象是_____ 。
 、FeO、
、FeO、 、CuO和可燃性有机物,现利用如图所示工艺流程回收部分金属及金属化合物。
、CuO和可燃性有机物,现利用如图所示工艺流程回收部分金属及金属化合物。
已知:绿矾为
 ,试剂a为固体。
,试剂a为固体。回答下列问题:
(1)“焙烧”的目的是将金属单质转化为氧化物,并除去
(2)“碱浸”时发生反应的固体为
(3)“操作Ⅰ”的名称为
(4)试剂a为
(5)“滤液Ⅱ”中可能含有因氧气的作用而产生的少量
您最近一年使用:0次
3 . Ⅰ.氧化铁是重要工业颜料,用废铁屑制备氧化铁的流程如图:
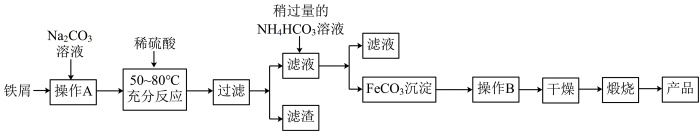
回答下列问题:
(1)检验“操作B”是否彻底的操作为_______ 。
(2)写出加入稍过量的NH4HCO3溶液得到FeCO3的离子方程式:_______ 。
(3)写出在空气中充分加热煅烧FeCO3的化学方程式:_______ 。
Ⅱ.上述流程中,若煅烧不充分,最终产品中会含有少量的FeO杂质。某同学为测定产品中Fe2O3的含量,进行如下实验:
a.称取样品8.00 g,加入足量稀H2SO4溶解,并加水稀释至100 mL;
b.量取25.00 mL待测溶液于锥形瓶中;
c.用酸化的0. 010 00 mol·L-1KMnO4标准液滴定至终点;
d.重复操作b、c 2~3次,得出消耗KMnO4溶液体积的平均值为20.00 mL。
(4)确定滴定达到终点的操作及现象为_______ 。
(5)上述样品的质量分数为_______ 。
(6)下列操作会导致样品中Fe2O3的质量分数测定结果偏低的有_______(填字母) 。

回答下列问题:
(1)检验“操作B”是否彻底的操作为
(2)写出加入稍过量的NH4HCO3溶液得到FeCO3的离子方程式:
(3)写出在空气中充分加热煅烧FeCO3的化学方程式:
Ⅱ.上述流程中,若煅烧不充分,最终产品中会含有少量的FeO杂质。某同学为测定产品中Fe2O3的含量,进行如下实验:
a.称取样品8.00 g,加入足量稀H2SO4溶解,并加水稀释至100 mL;
b.量取25.00 mL待测溶液于锥形瓶中;
c.用酸化的0. 010 00 mol·L-1KMnO4标准液滴定至终点;
d.重复操作b、c 2~3次,得出消耗KMnO4溶液体积的平均值为20.00 mL。
(4)确定滴定达到终点的操作及现象为
(5)上述样品的质量分数为
(6)下列操作会导致样品中Fe2O3的质量分数测定结果偏低的有_______(填字母) 。
| A.未干燥锥形瓶 |
| B.盛装标准液的滴定管没有用标准液润洗 |
| C.滴定开始时平视刻度线读数,滴定结束时仰视刻度线读数 |
| D.量取待测液的滴定管没有润洗 |
您最近一年使用:0次
名校
解题方法
4 . 某工厂的工业废水中含有大量的FeSO4、较多的CuSO4和少量Na2SO4,为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。请根据下列流程图,完成回收硫酸亚铁和铜的实验方案(可供选择的试剂为铁粉、稀H2SO4、NaOH溶液等试剂)。

(1)操作a的名称为___________ 。
(2)加入的试剂④为___________ ,发生的化学方程式为___________ 。
(3)加入试剂①的目的是___________ 。
(4)从溶液D和溶液G中得到FeSO4·7H2O晶体的操作为___________ 、冷却结晶、过滤、洗涤、干燥。

(1)操作a的名称为
(2)加入的试剂④为
(3)加入试剂①的目的是
(4)从溶液D和溶液G中得到FeSO4·7H2O晶体的操作为
您最近一年使用:0次
名校
解题方法
5 . 除去食盐中少量的 ,而又不引入新的杂质离子,应依次加入
,而又不引入新的杂质离子,应依次加入
 ,而又不引入新的杂质离子,应依次加入
,而又不引入新的杂质离子,应依次加入| A.BaCl2、Na2CO3 | B.Na2CO3、BaCl2 |
| C.BaCl2、Na2CO3、HCl | D.Ba(NO3)2、Na2CO3、HCl |
您最近一年使用:0次
2023-02-01更新
|
147次组卷
|
2卷引用:广东省揭阳市惠来县第一中学2022-2023学年高一下学期第一次月考化学试题
名校
解题方法
6 . 央视《每周质量报告》曝光了河北省一些明胶企业将皮革废料熬制成工业明胶,出售给浙江绍兴某些制药企业,最终变成药用胶囊。由工业明胶制成的胶囊往往含有超标的重金属铬,会对人体造成伤害。明胶是水溶性蛋白质混合物,溶于水形成胶体。
(1)已知Fe(CrO2)2中铬元素是+3价,则其中铁元素是_______ 价。CrO 是一种酸根离子,则Fe(CrO2)2属于
是一种酸根离子,则Fe(CrO2)2属于_______ (填“酸”、“碱”、“盐”或“氧化物”)。
(2)明胶的水溶液和K2SO4溶液共同具备的性质是_______ (填序号)。
a.都不稳定,密封放置会产生沉淀
b.二者均有丁达尔效应
c.分散质粒子可通过滤纸
(3)已知胶体的分散质不能透过半透膜,但水分子等小分子或离子能透过半透膜。提纯明胶的装置是下列中的_______ (填序号)。
A、 B、
B、 C、
C、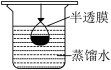
(4)现有10mL明胶的水溶液与5mL K2SO4溶液混合装入半透膜内,将此半透膜袋浸入盛蒸馏水的烧杯中,设计实验证明SO 能够透过半透膜:
能够透过半透膜:_______ 。
(1)已知Fe(CrO2)2中铬元素是+3价,则其中铁元素是
 是一种酸根离子,则Fe(CrO2)2属于
是一种酸根离子,则Fe(CrO2)2属于(2)明胶的水溶液和K2SO4溶液共同具备的性质是
a.都不稳定,密封放置会产生沉淀
b.二者均有丁达尔效应
c.分散质粒子可通过滤纸
(3)已知胶体的分散质不能透过半透膜,但水分子等小分子或离子能透过半透膜。提纯明胶的装置是下列中的
A、
 B、
B、 C、
C、
(4)现有10mL明胶的水溶液与5mL K2SO4溶液混合装入半透膜内,将此半透膜袋浸入盛蒸馏水的烧杯中,设计实验证明SO
 能够透过半透膜:
能够透过半透膜:
您最近一年使用:0次
2022-11-22更新
|
219次组卷
|
2卷引用:广东省揭阳市揭西县河婆中学2020-2021学年高一上学期第一次月考化学试题
名校
解题方法
7 . 干燥的二氧化碳和氮气反应可生成氨基甲酸铵固体,化学方程式为:2NH3(g)+CO2(g)=NH2COONH4(s)。在四氯化碳中通入二氧化碳和氨制备氨基甲酸铵的实验装置如下图所示,回答下列问题:
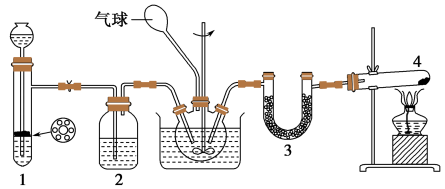
(1)装置1用来制备二氧化碳气体:将块状石灰石放置在试管中的带孔塑料板上,漏斗中所加试剂为:_______ ,装置2中所加试剂为_______ ;
(2)装置4中试剂为固体NH4Cl和Ca(OH)2,发生反应的化学方程式为_______ ;试管口不能向上倾斜的原因是_______ 。装置3中试剂为KOH,其作用为_______ 。

(1)装置1用来制备二氧化碳气体:将块状石灰石放置在试管中的带孔塑料板上,漏斗中所加试剂为:
(2)装置4中试剂为固体NH4Cl和Ca(OH)2,发生反应的化学方程式为
您最近一年使用:0次
8 . 下表是元素周期表的一部分,按要求回答下列问题:
I.
(1)⑧的单质的电子式为_______ 。
(2)①~⑧对应元素中,非金属性最强的是_______ (填元素符号)。
(3)⑤⑥两种元素的最高价氧化物对应水化物中,碱性最强的是_______ (填化学式)。
(4)实验室用 和
和 制备②的简单氢化物,其化学方程式为
制备②的简单氢化物,其化学方程式为_______ 。
(5)下列不能用于验证氯元素比硫元素非金属性强的依据是_______(填字母)。
II. 是重要的金属元素,它们的单质及其化合物在工业上有广泛的应用。
是重要的金属元素,它们的单质及其化合物在工业上有广泛的应用。
工业上用废铁锈(主要成分为 ,含少量的
,含少量的 与Cu)制取绿矾(
与Cu)制取绿矾( )的流程图如下。请回答下列问题。
)的流程图如下。请回答下列问题。

(6)X与Y分别为_______ 、_______ (填化学式)。
(7)废铁锈加入过量 溶液发生的离子方程式为
溶液发生的离子方程式为_______ 。
(8)流程中获得的Cu,可用铁盐溶解,写出反应的离子方程式为_______ 。
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
| 一 | ① | ||||||
| 二 | ② | ③ | ④ | ||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ |
(1)⑧的单质的电子式为
(2)①~⑧对应元素中,非金属性最强的是
(3)⑤⑥两种元素的最高价氧化物对应水化物中,碱性最强的是
(4)实验室用
 和
和 制备②的简单氢化物,其化学方程式为
制备②的简单氢化物,其化学方程式为(5)下列不能用于验证氯元素比硫元素非金属性强的依据是_______(填字母)。
A. 比 比 稳定 稳定 |
B.铁与 反应生成 反应生成 ,而铁与硫反应生成 ,而铁与硫反应生成 |
C. 的酸性比 的酸性比 的强 的强 |
D. 的氧化性比 的氧化性比 的强 的强 |
II.
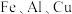 是重要的金属元素,它们的单质及其化合物在工业上有广泛的应用。
是重要的金属元素,它们的单质及其化合物在工业上有广泛的应用。工业上用废铁锈(主要成分为
 ,含少量的
,含少量的 与Cu)制取绿矾(
与Cu)制取绿矾( )的流程图如下。请回答下列问题。
)的流程图如下。请回答下列问题。
(6)X与Y分别为
(7)废铁锈加入过量
 溶液发生的离子方程式为
溶液发生的离子方程式为(8)流程中获得的Cu,可用铁盐溶解,写出反应的离子方程式为
您最近一年使用:0次
解题方法
9 . 电子工业中常用覆铜板为基础材料制作印刷电路板,工业上利用FeCl3溶液作为“腐蚀液”将覆铜板上不想要的铜腐蚀,同时还可以从腐蚀废液(主要含FeCl3、FeCl2和CuCl2)中回收铜,并重新获得FeCl3溶液。废液处理流程如下:

请回答下列问题。
(1)操作I的名称为_______ 。
(2)FeCl3溶液腐蚀铜板的离子方程式为_______ 。
(3)试剂a是一种常见金属单质,试剂a为_______ (填化学式)。沉淀A为_______ (填化学式)。从氧化还原反应的角度分析,试剂c是_______ (填“氧化”或“还原”)剂。
(4)为了检验腐蚀废液中是否含有FeCl3,可将腐蚀废液取样然后滴加_______ (填字母)。
A.NaOH溶液 B.KSCN溶液 C.AgNO3溶液
(5)实验室配制FeCl2溶液时为了防止FeCl2溶液变质,经常向其中加入铁粉,其原因是_______ (用化学方程式表示)。

请回答下列问题。
(1)操作I的名称为
(2)FeCl3溶液腐蚀铜板的离子方程式为
(3)试剂a是一种常见金属单质,试剂a为
(4)为了检验腐蚀废液中是否含有FeCl3,可将腐蚀废液取样然后滴加
A.NaOH溶液 B.KSCN溶液 C.AgNO3溶液
(5)实验室配制FeCl2溶液时为了防止FeCl2溶液变质,经常向其中加入铁粉,其原因是
您最近一年使用:0次
名校
10 . 铝硅铁合金(AlxFeySiz)是炼钢过程中重要的脱氧剂。为测定其化学式,设计了如下流程,根据流程回答下列问题:
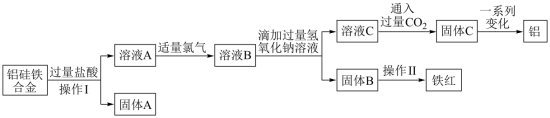
(1)操作Ⅰ的名称是_______ 。
(2)固体A可用于生产半导体材料,固体A为_______ 。
(3)通入氯气的作用是_______ ,此时发生反应的离子方程式为_______ 。
(4)向溶液B中滴加氢氧化钠溶液的过程中产生沉淀的物质的量与加入氢氧化钠溶液的体积关系正确的是_______。(填正确答案标号)。
(5)生成固体C的同时还生成NaHCO3,该反应离子方程式为_______ 。
(6)实验测定固体A的质量为560g,铝的质量为810g,铁红的质量为80g,则铝硅铁合金的化学式为_______ ,该流程中铝硅铁合金与过量盐酸反应,在标准状况下产生的气体的体积V=_______ L。

(1)操作Ⅰ的名称是
(2)固体A可用于生产半导体材料,固体A为
(3)通入氯气的作用是
(4)向溶液B中滴加氢氧化钠溶液的过程中产生沉淀的物质的量与加入氢氧化钠溶液的体积关系正确的是_______。(填正确答案标号)。
A. | B.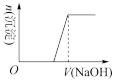 | C.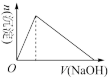 | D. |
(6)实验测定固体A的质量为560g,铝的质量为810g,铁红的质量为80g,则铝硅铁合金的化学式为
您最近一年使用:0次
2022-03-05更新
|
153次组卷
|
2卷引用:广东省普宁第二中学2021-2022学年高一下学期期初摸底考试化学试卷



