名校
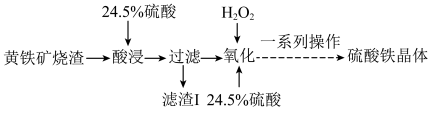
1 . 硫酸铁是水处理行业用作净水的混凝剂和污泥的处理剂,广泛用于水的处理。一种以黄铁矿烧渣(主要成分为Fe2O3、FeO、SiO2等)为原料制取硫酸铁晶体的工艺流程如下:
(1)滤渣Ⅰ的主要成分是____________ (填化学式)。
(2)在实验操作中常需要在加入氧化剂H2O2之前,对过滤后的滤液进行取样分析,取样分析的目的是____________________________ 。
(3)“酸浸”后过滤所得滤液中所含的阳离子有_________________ (填离子符号)。
(4)“氧化”过程发生的反应的离子方程式为_________________ ;“氧化”时可用硝酸代替氧化剂H2O2,优点是原料成本低,缺点是________________ 。
为除去粗盐水中含有的杂质SO 、Ca2+和Mg2+,得到精盐,某同学设计了如下实验流程:
、Ca2+和Mg2+,得到精盐,某同学设计了如下实验流程:_________ ;
(6)写出操作③的离子方程式_________ , _________ ;
(7)在“粗食盐的提纯”实验中,用蒸发皿蒸发滤液时,下列操作正确的是( )
(1)滤渣Ⅰ的主要成分是
(2)在实验操作中常需要在加入氧化剂H2O2之前,对过滤后的滤液进行取样分析,取样分析的目的是
(3)“酸浸”后过滤所得滤液中所含的阳离子有
(4)“氧化”过程发生的反应的离子方程式为
为除去粗盐水中含有的杂质SO
 、Ca2+和Mg2+,得到精盐,某同学设计了如下实验流程:
、Ca2+和Mg2+,得到精盐,某同学设计了如下实验流程: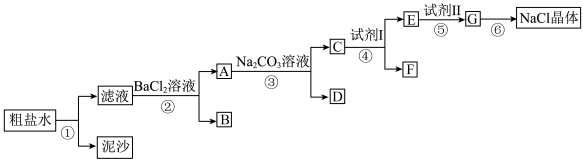
(6)写出操作③的离子方程式
(7)在“粗食盐的提纯”实验中,用蒸发皿蒸发滤液时,下列操作正确的是( )
| A.把浑浊的滤液倒入蒸发皿里,进行加热 | B.待滤液完全蒸干后,停止加热 |
| C.等到开始出现固体时,用玻璃棒不断搅拌液体 | D.等到出现大量固体时,停止加热 |
您最近一年使用:0次
名校
2 . 某同学对某种粗盐(杂质有CaCl2、MgCl2)进行提纯实验,步骤见下图所示。
(2)检验NaCl溶液说法正确的是 。

| A.操作过程①②是过滤 | B.固体A是CaCO3、MgCO3 |
| C.Na2CO3溶液过量的原因是除尽Ca2+ 、Mg2+ | D.蒸发所用主要仪器是坩埚,可直接蒸干 |
| A.做焰色实验,火焰呈黄色说明有钠元素,即有Na+ |
| B.取适量溶液用硝酸酸化,再加硝酸银溶液,有白色沉淀,说明有Cl- |
| C.做焰色实验,火焰呈黄色说明有钠元素,但不能确定是否有钾元素 |
| D.检验Cl-也可用盐酸酸化,排除干扰离子 |
您最近一年使用:0次
名校
解题方法
3 . 实验室用 和浓盐酸制取
和浓盐酸制取 并回收
并回收 ,下列装置不能达到实验目的的是
,下列装置不能达到实验目的的是
 和浓盐酸制取
和浓盐酸制取 并回收
并回收 ,下列装置不能达到实验目的的是
,下列装置不能达到实验目的的是A.制备氯气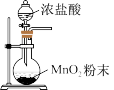 | B.收集氯气 |
C.过滤除MnO2 | D.浓缩滤液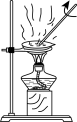 |
您最近一年使用:0次
2023-08-21更新
|
148次组卷
|
5卷引用:广东省连州市连州中学2021-2022学年高一上学期期中考试化学试题
名校
解题方法
4 . 粗食盐水中常含有少量 、
、 、
、 ,实验室提纯粗食盐水制取食盐的流程如图。以下说法错误的是
,实验室提纯粗食盐水制取食盐的流程如图。以下说法错误的是

 、
、 、
、 ,实验室提纯粗食盐水制取食盐的流程如图。以下说法错误的是
,实验室提纯粗食盐水制取食盐的流程如图。以下说法错误的是
A.操作 加入过量 加入过量 溶液主要是为沉淀 溶液主要是为沉淀 |
B.“滤液2”中加入的 溶液是 溶液是 溶液 溶液 |
C.“沉淀3”的成分只有 |
| D.在该提纯过程中玻璃棒的作用有引流和搅拌 |
您最近一年使用:0次
2023-07-07更新
|
287次组卷
|
5卷引用:广东省清远市2022-2023学年高一下学期期末质量检测化学试题
名校
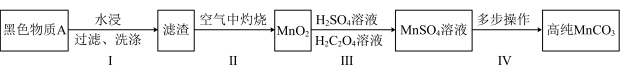
5 . 废旧锌锰干电池内部的黑色物质A主要含有MnO2、MnOOH、NH4C1、ZnCl2、碳单质,用黑色物质A制备高纯MnCO3的流程如图:
已知: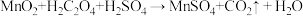 (未配平)。
(未配平)。
(1)第I步操作是为了除去可溶性的_____ (填化学式)。
(2)第I步后在空气中灼烧的目的有两个,一个是将MnOOH转化为MnO2,另一个是_____ 。灼烧时,MnOOH与空气中的氧气反应的化学方程式为_____ 。
(3)第Ⅲ步中为提高反应速率,可以采取的措施有_____ (任写一条),第Ⅲ步过程中加入H2SO4溶液的作用是_____ 。
(4)已知:MnCO3难溶于水和乙醇,潮湿时易被空气氧化,100℃时开始分解;Mn2+在pH大于7.7时,开始转化为Mn(OH)2沉淀。第Ⅳ步中的多步操作可按如图步骤进行:
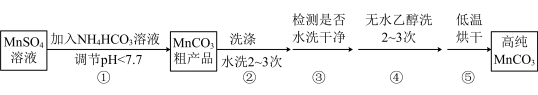
操作①加入NH4HCO3溶液调节溶液pH的过程中有CO2产生,则MnSO4溶液与NH4HCO3溶液反应的离子方程式为_____ ;操作②中需要的玻璃仪器有_____ ;你认为操作③中检测的方法及现象是_____ 时可继续进行操作④;操作④中用无水乙醇洗涤的目的是_____ (答一条即可)。

已知:
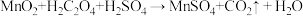 (未配平)。
(未配平)。(1)第I步操作是为了除去可溶性的
(2)第I步后在空气中灼烧的目的有两个,一个是将MnOOH转化为MnO2,另一个是
(3)第Ⅲ步中为提高反应速率,可以采取的措施有
(4)已知:MnCO3难溶于水和乙醇,潮湿时易被空气氧化,100℃时开始分解;Mn2+在pH大于7.7时,开始转化为Mn(OH)2沉淀。第Ⅳ步中的多步操作可按如图步骤进行:

操作①加入NH4HCO3溶液调节溶液pH的过程中有CO2产生,则MnSO4溶液与NH4HCO3溶液反应的离子方程式为
您最近一年使用:0次
2023-07-05更新
|
208次组卷
|
3卷引用:广东省清远市2022-2023学年高一下学期期末质量检测化学试题
解题方法
6 . 铝元素是地壳中含量最多的金属元素,常以化合态的形式存在于铝土矿中,其氧化物具有两性, 与
与 类似。
类似。
Ⅰ.工业上常常从铝土矿(主要成分为 ,含
,含 、
、 杂质)中提取
杂质)中提取 ,并通过电解法制备铝单质。请根据流程图,回答相关问题。
,并通过电解法制备铝单质。请根据流程图,回答相关问题。

已知: 属于两性氢氧化物,既能溶于稀盐酸又能溶于NaOH溶液。
属于两性氢氧化物,既能溶于稀盐酸又能溶于NaOH溶液。
(1)写出“滤渣A”的化学式:_______ ;过滤时,玻璃棒的作用为_______ ;“滤液B”中的溶质为 、
、_______ (写化学式)。
(2)上述流程中“过量氨水”能否改为“过量NaOH溶液”?_______ (填“能”或“不能”),请用离子方程式解释:_______ 。
Ⅱ.已知 能与NaOH溶液反应生成亚铬酸钠(
能与NaOH溶液反应生成亚铬酸钠(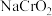 ),
), 可由
可由 和硫黄(S)混合后进行反应得到,发生反应的化学方程式为
和硫黄(S)混合后进行反应得到,发生反应的化学方程式为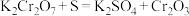 ,再经湿磨、热水洗涤、压滤、干燥、粉碎制得。回答下到问题:
,再经湿磨、热水洗涤、压滤、干燥、粉碎制得。回答下到问题:
(3)写出 与NaOH溶液反应的化学方程式:
与NaOH溶液反应的化学方程式:_______ 。
(4)由 和硫黄制取
和硫黄制取 的废水中含有一定量的
的废水中含有一定量的 ,Cr元素含量达标才能排放,可以加入
,Cr元素含量达标才能排放,可以加入 溶液去除酸性废水中的
溶液去除酸性废水中的 ,使
,使 转化为
转化为 而自身转化为三价铁,再放入沉淀池,达到指定标准后方可排放。上述过程
而自身转化为三价铁,再放入沉淀池,达到指定标准后方可排放。上述过程 溶液与
溶液与 发生的反应中氧化剂与还原剂的物质的量之比为
发生的反应中氧化剂与还原剂的物质的量之比为_______ 。
(5)某兴趣小组同学想根据上述反应原理测出该酸性废水中残留的 的物质的量浓度,采样后,经初步预算需要
的物质的量浓度,采样后,经初步预算需要 的
的 溶液240mL,配制该溶液时至少需称量
溶液240mL,配制该溶液时至少需称量_______ g 。
。
 与
与 类似。
类似。Ⅰ.工业上常常从铝土矿(主要成分为
 ,含
,含 、
、 杂质)中提取
杂质)中提取 ,并通过电解法制备铝单质。请根据流程图,回答相关问题。
,并通过电解法制备铝单质。请根据流程图,回答相关问题。
已知:
 属于两性氢氧化物,既能溶于稀盐酸又能溶于NaOH溶液。
属于两性氢氧化物,既能溶于稀盐酸又能溶于NaOH溶液。(1)写出“滤渣A”的化学式:
 、
、(2)上述流程中“过量氨水”能否改为“过量NaOH溶液”?
Ⅱ.已知
 能与NaOH溶液反应生成亚铬酸钠(
能与NaOH溶液反应生成亚铬酸钠(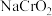 ),
), 可由
可由 和硫黄(S)混合后进行反应得到,发生反应的化学方程式为
和硫黄(S)混合后进行反应得到,发生反应的化学方程式为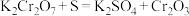 ,再经湿磨、热水洗涤、压滤、干燥、粉碎制得。回答下到问题:
,再经湿磨、热水洗涤、压滤、干燥、粉碎制得。回答下到问题:(3)写出
 与NaOH溶液反应的化学方程式:
与NaOH溶液反应的化学方程式:(4)由
 和硫黄制取
和硫黄制取 的废水中含有一定量的
的废水中含有一定量的 ,Cr元素含量达标才能排放,可以加入
,Cr元素含量达标才能排放,可以加入 溶液去除酸性废水中的
溶液去除酸性废水中的 ,使
,使 转化为
转化为 而自身转化为三价铁,再放入沉淀池,达到指定标准后方可排放。上述过程
而自身转化为三价铁,再放入沉淀池,达到指定标准后方可排放。上述过程 溶液与
溶液与 发生的反应中氧化剂与还原剂的物质的量之比为
发生的反应中氧化剂与还原剂的物质的量之比为(5)某兴趣小组同学想根据上述反应原理测出该酸性废水中残留的
 的物质的量浓度,采样后,经初步预算需要
的物质的量浓度,采样后,经初步预算需要 的
的 溶液240mL,配制该溶液时至少需称量
溶液240mL,配制该溶液时至少需称量 。
。
您最近一年使用:0次
2023-06-08更新
|
248次组卷
|
2卷引用:广东省清远市2022-2023学年高一上学期期末考试化学试题
名校
解题方法
7 . “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯。
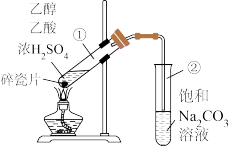
回答下列问题:
(1)写出由CH3COOH与C2H518OH制取乙酸乙酯的化学方程式:___________ 。
(2)试管②中观察到的现象是___________ 。
(3)试管②中饱和Na2CO3溶液的作用是___________ 。
(4)饱和Na2CO3溶液_______ (填“能”或“不能”)用NaOH溶液代替,其原因是______ 。
(5)装置中通蒸气的导气管,不能插入饱和Na2CO3溶液中,目的是______ 。
(6)若要把制得的乙酸乙酯分离出来,应采用的实验操作是_____ ,主要使用的玻璃仪器是___________ (填仪器的名称)。

回答下列问题:
(1)写出由CH3COOH与C2H518OH制取乙酸乙酯的化学方程式:
(2)试管②中观察到的现象是
(3)试管②中饱和Na2CO3溶液的作用是
(4)饱和Na2CO3溶液
(5)装置中通蒸气的导气管,不能插入饱和Na2CO3溶液中,目的是
(6)若要把制得的乙酸乙酯分离出来,应采用的实验操作是
您最近一年使用:0次
2022-08-23更新
|
121次组卷
|
2卷引用:广东省清远市阳山县南阳中学2021-2022学年高一下学期第二次月考化学试题
名校
8 . 菜之魂在味,在“七味八滋”中,盐应是百味之首。粗盐常含有少量 、
、 、
、 以及泥沙等杂质,实验室中提纯
以及泥沙等杂质,实验室中提纯 的流程如图所示。
的流程如图所示。

回答下列问题:
(1)操作Ⅰ需要使用的玻璃仪器是_______ (填仪器名称)。
(2)操作Ⅱ为蒸发结晶,蒸发过程中_______ 时停止加热。
(3)溶液a和溶液b分别为_______ 溶液和_______ 溶液,加入过量溶液b的目的是_______ (用离子方程式表示)。
(4)说明溶液c已经足量的现象为_______ 。
(5)称取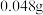 精盐,配制成
精盐,配制成 溶液;量取
溶液;量取 与
与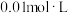 的
的 溶液反应,消耗
溶液反应,消耗 溶液的体积为
溶液的体积为 ,则该精盐样品中
,则该精盐样品中 的质量分数是
的质量分数是_______ 。
 、
、 、
、 以及泥沙等杂质,实验室中提纯
以及泥沙等杂质,实验室中提纯 的流程如图所示。
的流程如图所示。
回答下列问题:
(1)操作Ⅰ需要使用的玻璃仪器是
(2)操作Ⅱ为蒸发结晶,蒸发过程中
(3)溶液a和溶液b分别为
(4)说明溶液c已经足量的现象为
(5)称取
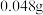 精盐,配制成
精盐,配制成 溶液;量取
溶液;量取 与
与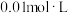 的
的 溶液反应,消耗
溶液反应,消耗 溶液的体积为
溶液的体积为 ,则该精盐样品中
,则该精盐样品中 的质量分数是
的质量分数是
您最近一年使用:0次
2021-11-11更新
|
278次组卷
|
4卷引用:广东省清远市2021-2022学年高一下学期期中调研考试化学试题
解题方法
9 . 某化学学习小组设计通过如图步骤用铜丝和硫酸制取胆矾晶体:
铜丝
(1)固体A为_______ 色;胆矾的化学式为_______ 。
(2)为加快反应②,可采取的实验方法是_______ (写出一种即可)。
(3)操作①、操作②的具体实验操作名称是_______ 。
(4)有同学提出可以将反应①和反应②合并,也就是将铜丝与浓硫酸直接混合加热即可得到蓝色溶液。该同学所提方案不足之处是_______ (写出一种即可)。
铜丝

(1)固体A为
(2)为加快反应②,可采取的实验方法是
(3)操作①、操作②的具体实验操作名称是
(4)有同学提出可以将反应①和反应②合并,也就是将铜丝与浓硫酸直接混合加热即可得到蓝色溶液。该同学所提方案不足之处是
您最近一年使用:0次
2021-07-27更新
|
144次组卷
|
2卷引用:广东省清远市凤霞中学2020-2021学年高一下学期期中质量检测化学试题
名校
解题方法
10 . 某工业废水中存在大量的Na+、Cl-、Cu2+、SO ,欲除去其中的Cu2+、SO
,欲除去其中的Cu2+、SO (为使离子完全沉淀,沉淀剂需要过量),设计工艺流程如图所示:下列说法
(为使离子完全沉淀,沉淀剂需要过量),设计工艺流程如图所示:下列说法不正确 的是
工业废水
 溶液
溶液 Na+ Cl-
Na+ Cl-
 ,欲除去其中的Cu2+、SO
,欲除去其中的Cu2+、SO (为使离子完全沉淀,沉淀剂需要过量),设计工艺流程如图所示:下列说法
(为使离子完全沉淀,沉淀剂需要过量),设计工艺流程如图所示:下列说法工业废水

 溶液
溶液 Na+ Cl-
Na+ Cl-| A.NaOH的作用是除去Cu2+ | B.试剂a为Na2CO3,试剂b为BaCl2 |
| C.流程图中,操作x为过滤 | D.试剂c为盐酸 |
您最近一年使用:0次
2020-12-20更新
|
219次组卷
|
4卷引用:广东省清远市第一中学2022-2023学年高一上学期期中考试化学试题



