解题方法
1 . 某硫酸厂用硫铁矿焙烧后的烧渣(主要成分为 、
、 、
、 ,不考虑其他杂质)制备绿矾粗产品
,不考虑其他杂质)制备绿矾粗产品 的流程如下:
的流程如下: 是酸性氧化物。
是酸性氧化物。
回答下列问题:
(1)流程中两次“操作”的名称是________ 。
(2)“还原”步骤中溶液由黄色变浅绿色,写出溶液变浅绿色的离子方程式________ 。
(3)“调pH至5-6”步骤中,写出生成 的离子方程式
的离子方程式________ 。
(4)鉴别滤液a中金属阳离子的实验方案如下,按要求填空:
 、
、 、
、 ,不考虑其他杂质)制备绿矾粗产品
,不考虑其他杂质)制备绿矾粗产品 的流程如下:
的流程如下:
 是酸性氧化物。
是酸性氧化物。回答下列问题:
(1)流程中两次“操作”的名称是
(2)“还原”步骤中溶液由黄色变浅绿色,写出溶液变浅绿色的离子方程式
(3)“调pH至5-6”步骤中,写出生成
 的离子方程式
的离子方程式(4)鉴别滤液a中金属阳离子的实验方案如下,按要求填空:
操作 | 现象 | 结论或离子方程式 |
| 步骤1:取少量滤液a进行① | 火焰呈② | 滤液a中含有 。 。 |
| 步骤2:另取少量滤液a于试管中,依次滴入③ | 溶液先无红色,后变红色。 | 滤液a中含有 ,不含 ,不含 。写出该过程中属于氧化还原反应的离子方程式④ 。写出该过程中属于氧化还原反应的离子方程式④ |
您最近一年使用:0次
2024-01-22更新
|
86次组卷
|
2卷引用:广东省湛江市雷州市第二中学2023-2024学年高一下学期开学化学试题
名校
2 . 人类的生产、生活离不开化学。
(1)铝粉与某些金属的氧化物组成的混合物叫铝热剂,铝热剂在高温下发生的反应叫铝热反应,如: ,反应发生时放出大量的热。
,反应发生时放出大量的热。
①信息中的“某些”指___________ (填“比铝活泼”“比铝不活泼”或“任意”)。
②试写出铝粉与 发生铝热反应的化学方程式:
发生铝热反应的化学方程式:___________ 。
(2)从海水中提取溴的工业流程如图:
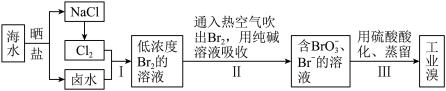
①步骤Ⅰ中发生反应的离子方程式为___________ 。
②步骤Ⅱ用热空气吹出的 被纯碱溶液吸收时,被氧化和被还原的
被纯碱溶液吸收时,被氧化和被还原的 的物质的量之比为
的物质的量之比为___________ 。
(3)海带中含有丰富的碘元素,某化学研究性学习小组用如图流程从海水中提取碘:

①若操作Ⅰ用 溶液(稀硫酸酸化)完成碘元素的转化,则反应的离子方程式为
溶液(稀硫酸酸化)完成碘元素的转化,则反应的离子方程式为___________ 。
②操作Ⅱ的名称为___________ 、___________ ,此过程中可以选用的有机溶剂是___________ (填一种)。
(1)铝粉与某些金属的氧化物组成的混合物叫铝热剂,铝热剂在高温下发生的反应叫铝热反应,如:
 ,反应发生时放出大量的热。
,反应发生时放出大量的热。①信息中的“某些”指
②试写出铝粉与
 发生铝热反应的化学方程式:
发生铝热反应的化学方程式:(2)从海水中提取溴的工业流程如图:

①步骤Ⅰ中发生反应的离子方程式为
②步骤Ⅱ用热空气吹出的
 被纯碱溶液吸收时,被氧化和被还原的
被纯碱溶液吸收时,被氧化和被还原的 的物质的量之比为
的物质的量之比为(3)海带中含有丰富的碘元素,某化学研究性学习小组用如图流程从海水中提取碘:

①若操作Ⅰ用
 溶液(稀硫酸酸化)完成碘元素的转化,则反应的离子方程式为
溶液(稀硫酸酸化)完成碘元素的转化,则反应的离子方程式为②操作Ⅱ的名称为
您最近一年使用:0次
解题方法
3 . 氯化钠是生活必需品,也是重要的化工原料。某化学兴趣小组同学在实验室提纯含少量泥沙的粗盐,操作流程如图所示:
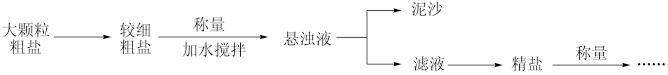
回答下列问题:
(1)“大颗粒粗盐→较细粗盐”的目的是_______ 。
(2)称量时,首先应_______ 。
(3)“悬浊液”_______ (填“能”或“不能”)产生丁达尔效应。
(4)“滤液→精盐”:
①该操作的名称为_______ 。
②该过程中不需要用到的仪器是_______ (填标号)。
③该操作过程中容易造成食盐固体飞溅,为尽量减少飞溅,除连续搅拌外还可采取的措施为_______ (填一种即可)。
(5)实验结束后称量获得的精盐,并计算精盐的产率,发现产率偏低,其可能的原因为_______ (填标号)。
a.过滤后,对烧杯进行多次洗涤 b.“滤液→精盐”的过程中,有溶液溅出

回答下列问题:
(1)“大颗粒粗盐→较细粗盐”的目的是
(2)称量时,首先应
(3)“悬浊液”
(4)“滤液→精盐”:
①该操作的名称为
②该过程中不需要用到的仪器是
 |  |  |
| a.表面皿 | b.坩埚 | c.玻璃棒 |
(5)实验结束后称量获得的精盐,并计算精盐的产率,发现产率偏低,其可能的原因为
a.过滤后,对烧杯进行多次洗涤 b.“滤液→精盐”的过程中,有溶液溅出
您最近一年使用:0次
2023-03-16更新
|
132次组卷
|
3卷引用:广东省徐闻县实验中学2022-2023学年高一下学期第三次学分认定考试化学试题
名校
4 . 我国化学家侯德榜创立了著名的“侯氏制碱法”,实验室模拟流程简图如图。下列说法正确的是


A.反应①的离子方程式:Na++CO2+NH3+H2O=NaHCO3↓+NH |
| B.实验室可用石灰石与稀硫酸制备CO2 |
C.母液中的溶质只有 ,可直接用作氮肥 ,可直接用作氮肥 |
| D.操作1是过滤;操作2用到的主要仪器有蒸发皿、酒精灯、玻璃棒等 |
您最近一年使用:0次
2023-03-04更新
|
285次组卷
|
3卷引用:广东省湛江市第二十一中学2022-2023学年高一上学期期中考试化学试题
广东省湛江市第二十一中学2022-2023学年高一上学期期中考试化学试题(已下线)第06讲 碳酸钠和碳酸氢钠 焰色试验-【暑假自学课】2023年新高一化学暑假精品课(人教版2019必修第一册)广东省珠海市第四中学2023-2024学年高一上学期期中考试化学试卷
解题方法
5 . 乳酸亚铁固体常用于治疗缺铁性贫血,易溶于水,难溶于乙醇。制备乳酸亚铁固体实验如下,回答下列问题:
I.制备碳酸亚铁

实验步骤:
第1步:组装仪器,_______,加入试剂;
第2步:控制开关并制取氢气,排尽装置内的空气;
第3步:一段时间后,启动电磁搅拌器,并控制开关,制备FeCO3;
第4步:抽滤,洗涤干燥。
II.制备乳酸亚铁
第5步:向制得的FeCO3固体中加入足量乳酸溶液,在75℃下搅拌使之充分反应;
第6步:反应结束后,从所得溶液中获得乳酸亚铁晶体。
(1)仪器A名称_______ ;实验中所用蒸馏水均需经煮沸后快速冷却,目的是_______ 。
(2)把第1步补充完整_______ 。
(3)第3步中“控制开关”的具体操作是_______ 。
(4)Na2CO3溶液可用NaHCO3溶液代替,有CO2生成,反应的离子方程式为_______ 。
(5)第6步中,从所得溶液中获得乳酸亚铁晶体的方法是低温蒸发、冷却结晶、_______ 、_______ 、干燥。
I.制备碳酸亚铁

实验步骤:
第1步:组装仪器,_______,加入试剂;
第2步:控制开关并制取氢气,排尽装置内的空气;
第3步:一段时间后,启动电磁搅拌器,并控制开关,制备FeCO3;
第4步:抽滤,洗涤干燥。
II.制备乳酸亚铁
第5步:向制得的FeCO3固体中加入足量乳酸溶液,在75℃下搅拌使之充分反应;
第6步:反应结束后,从所得溶液中获得乳酸亚铁晶体。
(1)仪器A名称
(2)把第1步补充完整
(3)第3步中“控制开关”的具体操作是
(4)Na2CO3溶液可用NaHCO3溶液代替,有CO2生成,反应的离子方程式为
(5)第6步中,从所得溶液中获得乳酸亚铁晶体的方法是低温蒸发、冷却结晶、
您最近一年使用:0次
解题方法
6 . 工业上常用FeCl3溶液腐蚀覆铜板制作印刷电路板,一学习小组为了对制作电路板后的酸性废液中某些物质进行回收循环利用,从而达到保护环境和资源回收利用的目的,设计了如下流程:

(1)FeCl3溶液腐蚀覆铜板时化学方程式为_______ 。
(2)检验酸性废液中是否含Fe3+的方法是_______ 。
(3)操作1和2都含有操作名称是_______ 。
(4)加盐酸的目的是_______ 。
(5)滤液1、2的含有相同的溶质是_______ 。
(6)加H2O2时,发生的离子反应方程式为_______ 。
(7)滤渣2的主要成分是_______ 。

(1)FeCl3溶液腐蚀覆铜板时化学方程式为
(2)检验酸性废液中是否含Fe3+的方法是
(3)操作1和2都含有操作名称是
(4)加盐酸的目的是
(5)滤液1、2的含有相同的溶质是
(6)加H2O2时,发生的离子反应方程式为
(7)滤渣2的主要成分是
您最近一年使用:0次
名校
解题方法
7 . 硫酸铵一种优良的氮肥,适用于各种土壤和作物,硫酸铵还可用于纺织、皮革、医药等方面。某化工厂以硫酸钙为原料制备硫酸铵,其工艺流程如图:
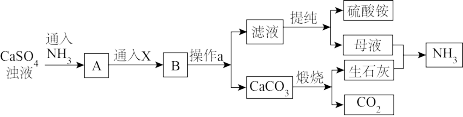
(1)X为_______ (填化学式),操作a名称为_______ 。
(2)NH3是工业制硝酸的重要原料,写出氨的催化氧化反应的化学方程式_______ 。
(3)煅烧CaCO3生成生石灰和CO2的反应为_______ 反应(填“吸热”或“放热”),欲加快该反应速率可采取的措施为_______ (写出一种即可)。
(4)上述流程中,可以循环使用的物质有_______ (填化学式)。
(5)从滤液中获得(NH4)2SO4晶体,必要的操作步骤是蒸发浓缩、_______ 、过滤等。

(1)X为
(2)NH3是工业制硝酸的重要原料,写出氨的催化氧化反应的化学方程式
(3)煅烧CaCO3生成生石灰和CO2的反应为
(4)上述流程中,可以循环使用的物质有
(5)从滤液中获得(NH4)2SO4晶体,必要的操作步骤是蒸发浓缩、
您最近一年使用:0次
2022-05-03更新
|
203次组卷
|
3卷引用:广东省湛江市坡头区第一中学2022-2023学年高一下学期期中考试化学试题
名校
解题方法
8 . 明矾晶体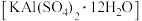 在生产、生活中有广泛用途,如饮用水的净化、造纸工业的施胶剂、食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含
在生产、生活中有广泛用途,如饮用水的净化、造纸工业的施胶剂、食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含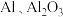 及少量
及少量 和
和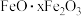 )可制备明矾,工艺流程如图:
)可制备明矾,工艺流程如图:

回答下列问题:
(1)“滤渣①”的主要成分是___________ (填化学式)。
(2)加入稀硫酸酸化后,再经“一系列操作”可得到明矾晶体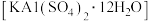 ,则“一系列操作”是
,则“一系列操作”是___________ 、___________ 、___________ 、洗涤、干燥。
(3)流程中加入 的作用是
的作用是___________ ,写出反应的离子方程式:___________ 。
(4)若将铝灰投入过量的氢氧化钠溶液中,所得溶液的溶质除 外,还含有
外,还含有___________ (填化学式)。写出生成气体的该反应的化学方程式:___________ 。
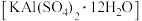 在生产、生活中有广泛用途,如饮用水的净化、造纸工业的施胶剂、食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含
在生产、生活中有广泛用途,如饮用水的净化、造纸工业的施胶剂、食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含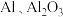 及少量
及少量 和
和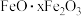 )可制备明矾,工艺流程如图:
)可制备明矾,工艺流程如图:
回答下列问题:
(1)“滤渣①”的主要成分是
(2)加入稀硫酸酸化后,再经“一系列操作”可得到明矾晶体
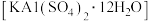 ,则“一系列操作”是
,则“一系列操作”是(3)流程中加入
 的作用是
的作用是(4)若将铝灰投入过量的氢氧化钠溶液中,所得溶液的溶质除
 外,还含有
外,还含有
您最近一年使用:0次
2021-05-15更新
|
358次组卷
|
6卷引用:广东省湛江市2020-2021学年高一下学期期中考试化学试题
广东省湛江市2020-2021学年高一下学期期中考试化学试题贵州省黔南州瓮安二中2020-2021学年高一下学期第一次月考化学试题(已下线)3.2.1 合金-2021-2022学年高一化学课后培优练(人教版2019必修第一册)(已下线)专题七 金属材料(B卷)-2021-2022学年高一化学优选好题单元专题双测卷(人教版2019必修第一册)(已下线)易错专题24 铝及其化合物的两性特点-【突破易错·冲刺满分】2021-2022学年高一上学期化学期中期末易错专题(人教版2019)广东省江门市蓬江区培英中学2021-2022学年高一下学期期中考试化学试题
名校
9 . 为除去SiO2中的石灰石杂质,下列可选择的最合适的试剂是
| A.盐酸 | B.氢氟酸 | C.稀硫酸 | D.NaOH溶液 |
您最近一年使用:0次
2021-03-25更新
|
256次组卷
|
4卷引用:广东省湛江市2020-2021学年高一下学期期中考试化学试题
名校
解题方法
10 . 中国有广阔的海岸线,建设发展海洋经济、海水的综合利用大有可为。空气吹出法工艺,是目前“海水提溴”的最主要方法之一,其工艺流程如下图所示,试回答下列问题:
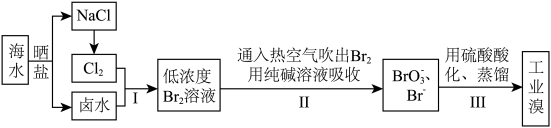
(1)海水日晒得到的盐因为含有较多杂质,称为粗盐。为了得到精制盐,可以用_______ 的办法除去其中的泥沙等不溶物。
(2)以上步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将之转变成化合态的溴,其目的是____________ 。
(3)步骤②通入热空气或水蒸气吹出Br2,利用了溴的________ 。
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(4)流程Ⅱ中涉及的离子反应方程式如下,请在下面横线内填入适当的化学计量数:___ Br2+___  =
= ___  +
+___ Br-+___ CO2↑
(5)上述流程中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏。写出溴与二氧化硫水溶液反应的离子方程式:___________________ 。
(6)流程Ⅲ蒸馏过程中,温度应控制在80~90℃。温度过高或过低都不利于生产,请解释原因:________________________ 。

(1)海水日晒得到的盐因为含有较多杂质,称为粗盐。为了得到精制盐,可以用
(2)以上步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将之转变成化合态的溴,其目的是
(3)步骤②通入热空气或水蒸气吹出Br2,利用了溴的
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(4)流程Ⅱ中涉及的离子反应方程式如下,请在下面横线内填入适当的化学计量数:
 =
=  +
+(5)上述流程中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏。写出溴与二氧化硫水溶液反应的离子方程式:
(6)流程Ⅲ蒸馏过程中,温度应控制在80~90℃。温度过高或过低都不利于生产,请解释原因:
您最近一年使用:0次
2020-10-09更新
|
270次组卷
|
3卷引用:广东省湛江市2018-2019学年高一下学期期末考试化学试题



