1 . 某化工厂欲以工业生产废料(金属铁、铝及其氧化物)为原料制取PAFC(聚合氯化铁铝)[AlFe(OH)nCl6-n]m,设计生产流程如下,请回答下列问题:

(1)用10mol/L的浓盐酸配制2mol/L的稀盐酸500mL, 所取浓盐酸的体积________ mL,所用玻璃仪器除量筒、玻璃棒和胶头滴管外,还有_______ 。
A.500mL容量瓶 B.蒸发皿 C.烧瓶
(2)写出Fe2O3粉末与盐酸反应的离子方程式:_______________ 。
(3)取少量酸性溶液滴加几滴KSCN试剂,溶液变为______ 色,证明含有Fe3+。
(4)通入氯气的目的是___________________ 。
(5)加入NaOH调节pH时,氢氧化钠不宜过多,生成一种红褐色沉淀,写出溶液中Fe3+与过量NaOH反应的离子方程式:______________________ 。

(1)用10mol/L的浓盐酸配制2mol/L的稀盐酸500mL, 所取浓盐酸的体积
A.500mL容量瓶 B.蒸发皿 C.烧瓶
(2)写出Fe2O3粉末与盐酸反应的离子方程式:
(3)取少量酸性溶液滴加几滴KSCN试剂,溶液变为
(4)通入氯气的目的是
(5)加入NaOH调节pH时,氢氧化钠不宜过多,生成一种红褐色沉淀,写出溶液中Fe3+与过量NaOH反应的离子方程式:
您最近一年使用:0次
名校
2 . 硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量,并检验该补血剂是否变质。实验步骤如下:

请回答下列问题:
(1)向操作①的滤液中滴加_______ 溶液后变为红色,则该滤液中含有________ (填离子符号)。
(2)操作②中反应的离子方程式:________________ ,若向操作②得到的溶液中加入足量的铁粉,反应的离子方程式为:________________ 。
(3)操作③中反应的离子方程式:________________ 。
(4)操作④中一系列处理的操作步骤:过滤、________ 、干燥、灼烧、________ 、称量。
(5)假设实验中的损耗忽略不计,则每片补血剂含铁元素的质量为_______ g。(用含a的代数式表示)。

请回答下列问题:
(1)向操作①的滤液中滴加
(2)操作②中反应的离子方程式:
(3)操作③中反应的离子方程式:
(4)操作④中一系列处理的操作步骤:过滤、
(5)假设实验中的损耗忽略不计,则每片补血剂含铁元素的质量为
您最近一年使用:0次
名校
3 . 社会要可持续发展,“绿色化学”要渗透到生产生活中。某同学以“从印刷电路板废液中回收铜,并再生FeCl3溶液”为实验主题设计的实验方案。根据该同学试设计的流程,回答下列问题:
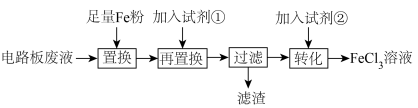
(1)“滤渣”的化学式为___________ 。
(2)根据上面流程:“转化”时,加入的试剂符合条件的是___________。
(3)为了检验是否生成了Fe3+溶液,请写出检验方法:___________ 。
(4)利用FeCl3溶液为原料还可以生成高铁酸钾 ,高铁酸钾是一种新型的净水剂,可以通过下述反应制取:
,高铁酸钾是一种新型的净水剂,可以通过下述反应制取: 。
。
①该反应中还原剂是___________ (填化学式,下同),还原产物为___________ 。
②通过发生的反应可知,物质氧化性:KClO___________ K2FeO4(填“>”或“<”)。
③当反应中有 生成,转移电子的物质的量为
生成,转移电子的物质的量为___________  。
。

(1)“滤渣”的化学式为
(2)根据上面流程:“转化”时,加入的试剂符合条件的是___________。
| A.铁粉 | B.氯水 | C.KMnO4溶液 | D.H2O2溶液 |
(3)为了检验是否生成了Fe3+溶液,请写出检验方法:
(4)利用FeCl3溶液为原料还可以生成高铁酸钾
 ,高铁酸钾是一种新型的净水剂,可以通过下述反应制取:
,高铁酸钾是一种新型的净水剂,可以通过下述反应制取: 。
。①该反应中还原剂是
②通过发生的反应可知,物质氧化性:KClO
③当反应中有
 生成,转移电子的物质的量为
生成,转移电子的物质的量为 。
。
您最近一年使用:0次
名校
解题方法
4 . “侯氏制碱法”是我国化工专家侯德榜为世界制碱工业作出的突出贡献。某实验小组模拟“侯氏制碱法”的工艺流程如下:
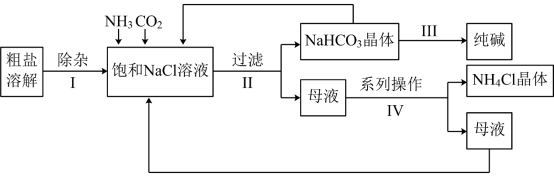
(1)粗盐的溶液中含有 Ca2+、Mg2+、和 ,除杂时可先后依次加入的试剂有BaCl2、NaOH、
,除杂时可先后依次加入的试剂有BaCl2、NaOH、___________ (填化学式)。
(2)系列操作Ⅳ包括:通入NH3、加入NaCl 固体、降温结晶、___________ 得到NH4Cl 晶体。
(3)生成NaHCO3晶体的化学方程式为___________ 。
(4)流程中可循环使用的物质有___________ (填化学式)。
(5)纯碱中可能混有NaHCO3杂质,称取29.6g产品溶于水中,滴加足量Ba(OH)2溶液,过滤,洗涤沉淀。
①将所得沉淀充分干燥,称量,沉淀的质量为59.1g。则产品中Na2CO3的质量分数w(Na2CO3)=___________ (保留三位有效数字)。如果此步骤中,沉淀未干燥充分就称量,则测得w(Na2CO3)___________ (填“偏大” “偏小”或“无影响”)。

(1)粗盐的溶液中含有 Ca2+、Mg2+、和
 ,除杂时可先后依次加入的试剂有BaCl2、NaOH、
,除杂时可先后依次加入的试剂有BaCl2、NaOH、(2)系列操作Ⅳ包括:通入NH3、加入NaCl 固体、降温结晶、
(3)生成NaHCO3晶体的化学方程式为
(4)流程中可循环使用的物质有
(5)纯碱中可能混有NaHCO3杂质,称取29.6g产品溶于水中,滴加足量Ba(OH)2溶液,过滤,洗涤沉淀。
①将所得沉淀充分干燥,称量,沉淀的质量为59.1g。则产品中Na2CO3的质量分数w(Na2CO3)=
您最近一年使用:0次
2024-01-09更新
|
149次组卷
|
4卷引用:广东梅梅州市县东山中学2023-2024学年高一上学期中段考试 化学试题
名校
5 . 铁及其化合物,有着不同的重要用途。请完成下面的问题:
Ⅰ.某化学兴趣小组以菱铁矿(主要成分为FeCO3,含有SiO2、Al2O3等少量杂质)为原料制备氯化铁晶体(FeCl3·6H2O)的实验过程如下:

已知:①SiO2不溶于酸和水; ②Al3++4OH-= AlO +2H2O。
+2H2O。
(1)写出酸溶时发生反应的离子方程式___________ 、Al2O3+6H+=2Al3++3H2O。
(2)操作Ⅰ名称是___________ 。
(3)在氧化过程中,发生反应的离子方程式为___________ 。如何检验铁元素全部以Fe3+形式存在:___________ 。
(4)加入过量NaOH溶液的目的是___________ 。
(5)请补充完整由过滤后得到的固体制备FeCl3·6H2O的实验方案:向过滤后所得固体加___________ 使固体完全溶解,然后___________ ,过滤,用水洗涤固体2-3次,低温干燥,得到FeCl3·6H2O。
Ⅱ.碳酸亚铁(FeCO3)是白色固体,难溶于水,是生产补血剂的重要原料。下图装置利用FeCl2溶液制取FeCO3:
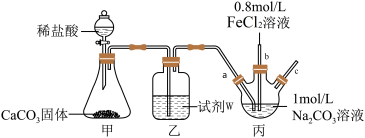
装置丙中操作步骤与现象:①将导管a移出液面,通入一段时间气体,②将导管a插入液面以下,向Na2CO3溶液(碱性)通入一段时间CO2至其呈中性,③通过导管b向丙中滴加一定量FeCl2溶液产生白色沉淀和无色气体,④取丙中混合物,过滤、洗涤、干燥,得到FeCO3固体。
请回答:
(6)试剂w是___________ 。向Na2CO3溶液通入CO2的目的是___________ 。丙装置中制取FeCO3的离子方程式为___________ 。
(7)100mL 0.8mol/L FeCl2 溶液完全反应,最终得到5克FeCO3固体,则产率为___________ (结果保留2位小数)。
Ⅰ.某化学兴趣小组以菱铁矿(主要成分为FeCO3,含有SiO2、Al2O3等少量杂质)为原料制备氯化铁晶体(FeCl3·6H2O)的实验过程如下:

已知:①SiO2不溶于酸和水; ②Al3++4OH-= AlO
 +2H2O。
+2H2O。(1)写出酸溶时发生反应的离子方程式
(2)操作Ⅰ名称是
(3)在氧化过程中,发生反应的离子方程式为
(4)加入过量NaOH溶液的目的是
(5)请补充完整由过滤后得到的固体制备FeCl3·6H2O的实验方案:向过滤后所得固体加
Ⅱ.碳酸亚铁(FeCO3)是白色固体,难溶于水,是生产补血剂的重要原料。下图装置利用FeCl2溶液制取FeCO3:

装置丙中操作步骤与现象:①将导管a移出液面,通入一段时间气体,②将导管a插入液面以下,向Na2CO3溶液(碱性)通入一段时间CO2至其呈中性,③通过导管b向丙中滴加一定量FeCl2溶液产生白色沉淀和无色气体,④取丙中混合物,过滤、洗涤、干燥,得到FeCO3固体。
请回答:
(6)试剂w是
(7)100mL 0.8mol/L FeCl2 溶液完全反应,最终得到5克FeCO3固体,则产率为
您最近一年使用:0次
名校
6 . 砷碱渣中含有大量的Na+、AsO 、OH-、SO
、OH-、SO 等,采用无废气、废水、废渣产生的工艺流程如图:
等,采用无废气、废水、废渣产生的工艺流程如图:

下列说法错误 的是
 、OH-、SO
、OH-、SO 等,采用无废气、废水、废渣产生的工艺流程如图:
等,采用无废气、废水、废渣产生的工艺流程如图:
下列说法
A.开始通入CO2发生反应的离子方程式为CO2+2OH-=CO +H2O +H2O |
| B.脱碳酸盐为NaHCO3反应的的离子方程式为CO2+ Na++OH-= NaHCO3↓ |
C.脱砷的离子方程式为2AsO +5S2-+16H+=As2S5↓+8H2O +5S2-+16H+=As2S5↓+8H2O |
D.脱硫酸根离子时的离子方程式为Ba2++SO =BaSO4↓ =BaSO4↓ |
您最近一年使用:0次
名校
解题方法
7 . 粗盐中仍含有可溶性的CaCl2、MgCl2、Na2SO4等杂质,通过如下操作,可制得精盐:①加入稍过量的Na2CO3溶液;②加入稍过量的NaOH溶液;③加入稍过量的BaCl2溶液;④滴入稀盐酸至无气泡产生:⑤过滤;⑥溶解。正确的操作顺序是
| A.⑥③②①⑤④ | B.⑥①②③⑤④ |
| C.⑥②①④③⑤ | D.⑥⑤②①③④ |
您最近一年使用:0次
名校
8 . 从某含有 、
、 、
、 的工业废液中回收铜并制备氯化铁晶体(
的工业废液中回收铜并制备氯化铁晶体( )的流程如下。下列说法正确的是
)的流程如下。下列说法正确的是

 、
、 、
、 的工业废液中回收铜并制备氯化铁晶体(
的工业废液中回收铜并制备氯化铁晶体( )的流程如下。下列说法正确的是
)的流程如下。下列说法正确的是
A.用酸性 溶液可检验溶液W中是否含有 溶液可检验溶液W中是否含有 |
| B.试剂a、b分别是铁粉和稀硫酸 |
C.加入试剂a过程中,有红色固体析出后,说明溶液中 已经反应完全 已经反应完全 |
| D.若操作Ⅱ前后固体质量减少28 g,则理论上该步骤应产生11.2 L气体 |
您最近一年使用:0次
2024-01-05更新
|
533次组卷
|
4卷引用:广东省东莞市东莞中学松山湖学校2023-2024学年高一上学期期中考试化学试卷
广东省东莞市东莞中学松山湖学校2023-2024学年高一上学期期中考试化学试卷广东省云浮市罗定中学2023-2024学年高一上学期12月月考化学试题(已下线)寒假作业07 铁及其化合物-【寒假分层作业】2024年高一化学寒假培优练(人教版2019必修第一册)广西钦州市第四中学2023-2024学年高一上学期11月考试化学试卷
名校
9 . 为除去括号内的杂质,所选用的试剂或方法错误 的是
| A.CO2气体(HCl):饱和Na2CO3溶液 |
| B.FeCl2溶液(FeCl3溶液):加入足量铁粉,过滤 |
| C.Cl2(HCl):通过饱和食盐水 |
| D.Na2CO3固体(NaHCO3):加热 |
您最近一年使用:0次
2024-01-05更新
|
242次组卷
|
2卷引用:广东省深圳市高级中学2021-2022学年高一上学期期末考试化学试题
名校
10 . 纯碱是一种非常重要的化工原料,在玻璃、肥料、合成洗涤剂等工业中有着广泛的应用.工业上“侯氏制碱法”以NaCl、 、
、 及水等为原料制备纯碱,其反应原理为:
及水等为原料制备纯碱,其反应原理为: .生产纯碱的工艺流程示意图如下:
.生产纯碱的工艺流程示意图如下:

(1)操作A的方法是______ ,该工艺流程中可回收再利用的物质是______ ,得到的 晶体中可能含有少量NaCl、
晶体中可能含有少量NaCl、 等杂质,检验该晶体中是否含有氯离子杂质的操作方法是
等杂质,检验该晶体中是否含有氯离子杂质的操作方法是______ 。
(2)写出焙烧操作中的化学方程式______ 。
(3) 和
和 是两种常见的钠盐,
是两种常见的钠盐, 和
和 溶于水溶液均显
溶于水溶液均显______ (填“酸性”、“中性”或“碱性”).相同温度下在水中的溶解度
______  (填“大于”、“等于”或“小于”),写出向饱和碳酸钠溶液中通入
(填“大于”、“等于”或“小于”),写出向饱和碳酸钠溶液中通入 的离子方程式
的离子方程式______ 。
 、
、 及水等为原料制备纯碱,其反应原理为:
及水等为原料制备纯碱,其反应原理为: .生产纯碱的工艺流程示意图如下:
.生产纯碱的工艺流程示意图如下:
(1)操作A的方法是
 晶体中可能含有少量NaCl、
晶体中可能含有少量NaCl、 等杂质,检验该晶体中是否含有氯离子杂质的操作方法是
等杂质,检验该晶体中是否含有氯离子杂质的操作方法是(2)写出焙烧操作中的化学方程式
(3)
 和
和 是两种常见的钠盐,
是两种常见的钠盐, 和
和 溶于水溶液均显
溶于水溶液均显
 (填“大于”、“等于”或“小于”),写出向饱和碳酸钠溶液中通入
(填“大于”、“等于”或“小于”),写出向饱和碳酸钠溶液中通入 的离子方程式
的离子方程式
您最近一年使用:0次



