解题方法
1 . 一种以黄铁矿烧渣(主要成分为 等)为原料制取硫酸铁晶体的工艺流程如下:(已知:
等)为原料制取硫酸铁晶体的工艺流程如下:(已知: 不溶于水,不和硫酸反应。)
不溶于水,不和硫酸反应。)_____ 。
(2)已知:25.0%硫酸的密度 ,则25.0%硫酸的物质的量浓度为
,则25.0%硫酸的物质的量浓度为______ ;若实验室用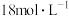 的浓硫酸配制
的浓硫酸配制 硫酸,则需用量筒量
硫酸,则需用量筒量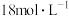 的浓硫酸的体积为
的浓硫酸的体积为_____  。
。
(3)写出“酸浸”中氧化铁与酸反应的离子方程式______ ,“酸浸”后过滤所得滤液中所含的阳离子有_______ (填离子符号)。
(4)“氧化”过程发生反应的离子方程式为_______ ;“氧化”时可用硝酸代替 ,优点是原料成本低,缺点是
,优点是原料成本低,缺点是_______ 。
(5)从“氧化”后的溶液中获得硫酸铁晶体,需经“一系列操作”,则“一系列操作”为______ 、过滤洗涤、烘干。
 等)为原料制取硫酸铁晶体的工艺流程如下:(已知:
等)为原料制取硫酸铁晶体的工艺流程如下:(已知: 不溶于水,不和硫酸反应。)
不溶于水,不和硫酸反应。)
(2)已知:25.0%硫酸的密度
 ,则25.0%硫酸的物质的量浓度为
,则25.0%硫酸的物质的量浓度为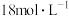 的浓硫酸配制
的浓硫酸配制 硫酸,则需用量筒量
硫酸,则需用量筒量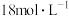 的浓硫酸的体积为
的浓硫酸的体积为 。
。(3)写出“酸浸”中氧化铁与酸反应的离子方程式
(4)“氧化”过程发生反应的离子方程式为
 ,优点是原料成本低,缺点是
,优点是原料成本低,缺点是(5)从“氧化”后的溶液中获得硫酸铁晶体,需经“一系列操作”,则“一系列操作”为
您最近一年使用:0次
名校
解题方法
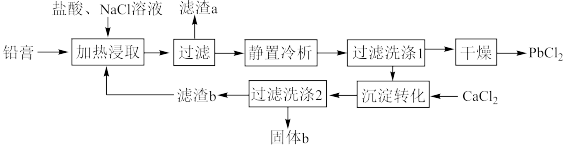
2 . 铅酸蓄电池是全球使用最广泛的化学电源,废铅酸蓄电池铅膏湿法回收铅的工艺研究是当前再生铅回收的重要研究方向,一种利用铅酸蓄电池中铅膏(主要成分为PbSO4、PbO,还含有一些不与流程中试剂反应的物质)制备PbCl2的工艺流程如图所示。请回答下列问题:
②铅酸蓄电池放电时的反应为PbO2+Pb+2H2SO4=2PbSO4+2H2O;
③PbSO4与PbCl2均能与Cl-反应生成[PbCln](n-2)-,[PbCln](n-2)-冷析时转化为PbCl2。
(1)铅酸蓄电池需先放电后再进行“加热浸取”,铅酸蓄电池放电时的负极为___________ (填“Pb”或“PbO2”),正极的电极反应式为___________ ;写出提高“加热浸取”速率的一种方法:___________ 。
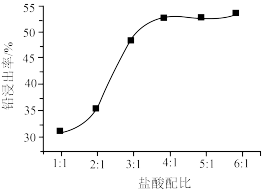
(2)PbO2与盐酸在“加热浸取”时会发生反应生成一种有毒气体和PbCl2,该反应的化学方程式为___________ ;盐酸配比(盐酸配比是指盐酸实际用量与理论用量之比)对铅浸出率的影响如图所示,则工业上一般选择的盐酸配比为___________ ,选择该配比的原因是___________ 。___________ ;“过滤洗涤1”时,可以用___________ (填标号)检验PbCl2是否洗涤干净;“沉淀转化”的目的是降低滤液b中 的浓度,则生成的固体b的主要成分为
的浓度,则生成的固体b的主要成分为___________ (填化学式)。
A.稀硝酸、AgNO3溶液 B.稀硫酸、AgNO3溶液
C.稀硫酸、BaCl2溶液 D.稀盐酸、BaCl2溶液
②铅酸蓄电池放电时的反应为PbO2+Pb+2H2SO4=2PbSO4+2H2O;
③PbSO4与PbCl2均能与Cl-反应生成[PbCln](n-2)-,[PbCln](n-2)-冷析时转化为PbCl2。
(1)铅酸蓄电池需先放电后再进行“加热浸取”,铅酸蓄电池放电时的负极为
(2)PbO2与盐酸在“加热浸取”时会发生反应生成一种有毒气体和PbCl2,该反应的化学方程式为
 的浓度,则生成的固体b的主要成分为
的浓度,则生成的固体b的主要成分为A.稀硝酸、AgNO3溶液 B.稀硫酸、AgNO3溶液
C.稀硫酸、BaCl2溶液 D.稀盐酸、BaCl2溶液
您最近一年使用:0次
名校
3 . 模拟用空气吹出法从海水中提取溴的工艺流程,如下图,请回答下列问题。

(1)将海水浓缩的方法是___________ 。
(2)步骤②通入热空气吹出Br2,利用了Br2的___________ 性。
(3)步骤①反应的离子方程式是___________ ,步骤③反应的离子方程式是___________ ,从理论上分析,下列也能吸收溴的是___________ (填序号)。
A.NaOH B.Na2SO3 C.H2O D.FeCl2
(4)已知海水中Br—含量为64mg/L,依据上述流程,若将5m3海水中的溴元素转化为工业溴,至少需要标准状况下Cl2的体积为___________ L(忽略Cl2的溶解)。

(1)将海水浓缩的方法是
(2)步骤②通入热空气吹出Br2,利用了Br2的
(3)步骤①反应的离子方程式是
A.NaOH B.Na2SO3 C.H2O D.FeCl2
(4)已知海水中Br—含量为64mg/L,依据上述流程,若将5m3海水中的溴元素转化为工业溴,至少需要标准状况下Cl2的体积为
您最近一年使用:0次
名校
解题方法
4 . 六氟锑酸锂 可用作锂离子电池的电解质锂盐,一种以锑白
可用作锂离子电池的电解质锂盐,一种以锑白 为原料,制备
为原料,制备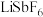 工艺流程如图所示:
工艺流程如图所示:
(1)请写出基态 原子价层电子排布式
原子价层电子排布式_________________ 。
(2)试剂 的化学式为
的化学式为_____________ ;根据流程和元素周期律推断 是
是_____________ 氧化物。
(3)“氧化”时,将溶液升至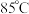 反应,温度不宜过高的原因是
反应,温度不宜过高的原因是_________________________ ;写出“氧化”步骤反应的离子方程式_____________________________ 。
(4)“酸溶”步骤一般使用聚四氟乙烯设备,不能使用金属或陶瓷设备,其原因是_____________ 。
(5)“操作Ⅴ"步骤为_________________ ;“过滤Ⅱ”所得的“母液”返回到_____________ 工序。
 可用作锂离子电池的电解质锂盐,一种以锑白
可用作锂离子电池的电解质锂盐,一种以锑白 为原料,制备
为原料,制备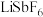 工艺流程如图所示:
工艺流程如图所示: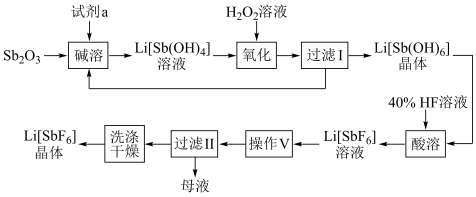
(1)请写出基态
 原子价层电子排布式
原子价层电子排布式(2)试剂
 的化学式为
的化学式为 是
是(3)“氧化”时,将溶液升至
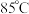 反应,温度不宜过高的原因是
反应,温度不宜过高的原因是(4)“酸溶”步骤一般使用聚四氟乙烯设备,不能使用金属或陶瓷设备,其原因是
(5)“操作Ⅴ"步骤为
您最近一年使用:0次
名校
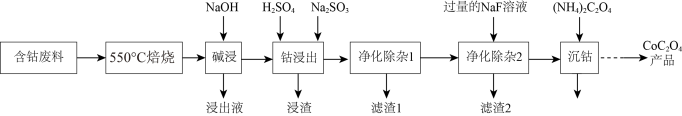
5 . 我国近代化学工业英基人侯德榜先生设计出“侯氏制碱法”,提高了食盐的转化率,缩短了生产流程,减少了对环境的污染。钢仁一中化学实验社团模拟“侯氏制碱法”开展如下项目式学习:
项目一:粗盐的提纯
粗盐中除了含有泥沙之外,还含有少量 等杂质离子,粗盐提纯的流程如图所示:
等杂质离子,粗盐提纯的流程如图所示: 分别为足量的
分别为足量的_____________ 、_____________ 。
(2)操作2的名称是_____________________ 。
(3)“滤液”中加入足量的试剂 生成气泡的离子方程式为
生成气泡的离子方程式为_____________________________ 。
项目二:模拟“侯氏制碱法“利用上述实验制得的 全部用于制备纯碱,工艺流程如图所示:
全部用于制备纯碱,工艺流程如图所示:

(4)氮化和碳酸化过程在如图所示装置中进行, 导管应通入的气体是
导管应通入的气体是_____________ (填化学式),仪器 的作用是
的作用是_____________________________________________ 。
(5)写出煅烧固体时发生的化学方程式:_________________________________________________ 。
(6)称取了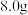 粗盐进行实验,最终制得
粗盐进行实验,最终制得 纯碱,假设完全转化,则粗盐的纯度是
纯碱,假设完全转化,则粗盐的纯度是_________  。(保留2位有效数字)
。(保留2位有效数字)
项目一:粗盐的提纯
粗盐中除了含有泥沙之外,还含有少量
 等杂质离子,粗盐提纯的流程如图所示:
等杂质离子,粗盐提纯的流程如图所示:
 分别为足量的
分别为足量的(2)操作2的名称是
(3)“滤液”中加入足量的试剂
 生成气泡的离子方程式为
生成气泡的离子方程式为项目二:模拟“侯氏制碱法“利用上述实验制得的
 全部用于制备纯碱,工艺流程如图所示:
全部用于制备纯碱,工艺流程如图所示:
(4)氮化和碳酸化过程在如图所示装置中进行,
 导管应通入的气体是
导管应通入的气体是 的作用是
的作用是(5)写出煅烧固体时发生的化学方程式:
(6)称取了
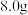 粗盐进行实验,最终制得
粗盐进行实验,最终制得 纯碱,假设完全转化,则粗盐的纯度是
纯碱,假设完全转化,则粗盐的纯度是 。(保留2位有效数字)
。(保留2位有效数字)
您最近一年使用:0次
解题方法
6 . 通过海水晾晒可得粗盐,粗盐中除NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质,需要提纯后才能综合利用。某同学利用给定试剂NaOH溶液、BaCl2溶液、Na2CO3溶液和盐酸,设计了如图粗盐精制的实验流程,下列说法正确的是

| A.试剂①可以是Na2CO3溶液 |
| B.每一步加入的除杂试剂一定需要足量 |
| C.操作a是过滤,为了快速过滤,可以在过滤时用玻璃棒轻轻搅拌 |
D.检验SO 是否除净的操作:取少量溶液C,加入BaCl2溶液有白色沉淀,说明未除尽 是否除净的操作:取少量溶液C,加入BaCl2溶液有白色沉淀,说明未除尽 |
您最近一年使用:0次
名校
解题方法
7 . 硝酸铜是一种重要的化工原料,可由工业含铜废料制备,含铜废料的主要成分为Cu、CuS、CuSO4等,制备流程如图所示:
(1)“焙烧”时,CuS与空气中的O2反应生成CuO和SO2,该反应的化学方程式为_______ ,提高“焙烧”效率的方法为_______ 。(任写一种)
(2)“过滤”所得滤液中溶质的主要成分为_______ 。
(3)①“淘洗”所用时溶液A可以是_______ 。(填标号)。
a.稀硝酸 b.浓硝酸 c.稀硫酸 d.㳖硫酸
②如何证明“淘洗”已完全_______ 。
(4)“反应”阶段所用的试剂是20%的HNO3溶液和10%的H2O2溶液,反应过程中无红棕色气体生成。
①理论上反应所消耗的H2O2和HNO3的物质的量之比为_______ 。
②若不加10%的H2O2溶液,只用20%的HNO3溶液,随着反应的进行,温度上升并出现大量红棕色气体,反应的离子方程式为_______ 。
(5)某工厂用m1kg上述工业含铜废料(含铜元素80%)制备Cu(NO3)2•3H2O,最终得到产品m2kg,产率为_______ 。(分数化为最简)
(1)“焙烧”时,CuS与空气中的O2反应生成CuO和SO2,该反应的化学方程式为
(2)“过滤”所得滤液中溶质的主要成分为
(3)①“淘洗”所用时溶液A可以是
a.稀硝酸 b.浓硝酸 c.稀硫酸 d.㳖硫酸
②如何证明“淘洗”已完全
(4)“反应”阶段所用的试剂是20%的HNO3溶液和10%的H2O2溶液,反应过程中无红棕色气体生成。
①理论上反应所消耗的H2O2和HNO3的物质的量之比为
②若不加10%的H2O2溶液,只用20%的HNO3溶液,随着反应的进行,温度上升并出现大量红棕色气体,反应的离子方程式为
(5)某工厂用m1kg上述工业含铜废料(含铜元素80%)制备Cu(NO3)2•3H2O,最终得到产品m2kg,产率为
您最近一年使用:0次
解题方法
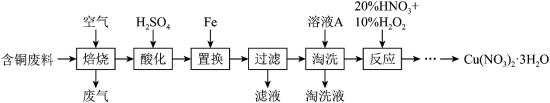
8 . 草酸钴是制作氧化钴和金属钴的原料,一种利用含钴废料(主要成分为Co2O3,含少量Fe2O3、ZnO、Al2O3、CaO、MgO、碳及有机物等)制取CoC2O4的工艺流程如下:
②ZnO与Al2O3化学性质相似,既能溶于强酸又能溶于强碱
(1)“550℃焙烧”的目的是_______ 。
(2)“浸出液”的主要成分是_______ 。
(3)“钴浸出”过程中Co3+转化为Co2+,反应的离子方程式为_______ 。
(4)“净化除杂1”过程中,先在40 ~ 50℃加入H2O2,控制温度不能太高的原因是_______ ,H2O2的作用是_______ (用离子方程式表示)。
(5)在空气中焙烧CoC2O4生成Co3O4和一种气体,请写出该反应的化学方程式:_______ 。
②ZnO与Al2O3化学性质相似,既能溶于强酸又能溶于强碱
(1)“550℃焙烧”的目的是
(2)“浸出液”的主要成分是
(3)“钴浸出”过程中Co3+转化为Co2+,反应的离子方程式为
(4)“净化除杂1”过程中,先在40 ~ 50℃加入H2O2,控制温度不能太高的原因是
(5)在空气中焙烧CoC2O4生成Co3O4和一种气体,请写出该反应的化学方程式:
您最近一年使用:0次
名校
9 . 金属钛硬度大、熔点高、耐腐蚀,易被氧化,被誉为“未来金属”。以钛铁矿(主要成分FeTiO3)为主要原料冶炼金属钛,生产的工艺流程图如图,其中钛铁矿与浓硫酸发生反应的化学方程式为:FeTiO3 + 2H2SO4 = TiOSO4 + FeSO4 + 2H2O。已知TiO2熔点为1850℃,回答下列问题:_____ ;钛酸亚铁(FeTiO3)中钛元素的化合价为_____ 价。
(2)滤液Ⅰ冷却结晶获得绿矾(FeSO4·7H2O)的实验操作依次为___ 、____ 、过滤、洗涤、干燥(填写操作名称)。
(3)滤液Ⅱ中主要物质是TiOSO4,反应①的化学方程式是_____________ 。
(4)反应②生成TiCl4和CO,其化学反应方程式为________ 。
(5)CO与H2反应可制备CH3OH,由CH3OH和O2构成的质子交换膜燃料电池总反应为2CH3OH +3O2 = 2CO2 + 4H2O,负极的电极反应式为______ 。若外电路中转移2mol电子,则上述燃料电池所消耗的O2在标准状况下的体积为______ L。

(2)滤液Ⅰ冷却结晶获得绿矾(FeSO4·7H2O)的实验操作依次为
(3)滤液Ⅱ中主要物质是TiOSO4,反应①的化学方程式是
(4)反应②生成TiCl4和CO,其化学反应方程式为
(5)CO与H2反应可制备CH3OH,由CH3OH和O2构成的质子交换膜燃料电池总反应为2CH3OH +3O2 = 2CO2 + 4H2O,负极的电极反应式为
您最近一年使用:0次
10 . 通过海水晾晒可以得到粗盐,粗盐除含有NaCl外,还含有 、
、 、
、 以及泥沙等杂质,其除杂过程如下:
以及泥沙等杂质,其除杂过程如下:
 、
、 、
、 以及泥沙等杂质,其除杂过程如下:
以及泥沙等杂质,其除杂过程如下:
| A.该粗盐除杂过程不涉及到氧化还原反应 |
| B.盐酸作用是调节溶液pH,使溶液呈中性或微酸性,可以用硫酸替代 |
C.检验 是否除净:取少量滤液,加稀盐酸酸化,再加 是否除净:取少量滤液,加稀盐酸酸化,再加 溶液 溶液 |
| D.该除杂过程分别在溶解、过滤、蒸发三操作中3次用到玻璃棒 |
您最近一年使用:0次



