名校
1 . “以废治废”是基于“绿色化学”观念治理污染的思路。用工业废碱渣(主要成分为 )吸收烟气中的
)吸收烟气中的 ,得到亚硫酸钠
,得到亚硫酸钠 粗品。其流程如下。
粗品。其流程如下。 的溶解,可采取的措施是
的溶解,可采取的措施是_______ (写出一种即可)。
(2)过程①进行的操作是_______ 。
(3)上述流程中;通入“含 的烟气”,发生反应的化学方程式为
的烟气”,发生反应的化学方程式为_______ 。
(4)上述流程中,加入NaOH后,发生反应的离子方程式为_______ 。
(5)设计实验证明亚硫酸钠粗品含有少量 的方案是:在一支试管中,加入少量亚硫酸钠粗品,用适量蒸馏水溶解,
的方案是:在一支试管中,加入少量亚硫酸钠粗品,用适量蒸馏水溶解,_______ ,出现白色沉淀,则证明含有 。
。
(6) 可用于处理酸性废水中的
可用于处理酸性废水中的 (转化为
(转化为 ),发生反应的离子方程式为
),发生反应的离子方程式为_______ 。
(7)某化工厂用如图所示工艺流程吸收烟气中的 。在标准状况下,当除去
。在标准状况下,当除去 时,消耗
时,消耗 的物质的量为
的物质的量为_______ mol。
 )吸收烟气中的
)吸收烟气中的 ,得到亚硫酸钠
,得到亚硫酸钠 粗品。其流程如下。
粗品。其流程如下。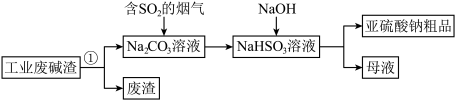
 的溶解,可采取的措施是
的溶解,可采取的措施是(2)过程①进行的操作是
(3)上述流程中;通入“含
 的烟气”,发生反应的化学方程式为
的烟气”,发生反应的化学方程式为(4)上述流程中,加入NaOH后,发生反应的离子方程式为
(5)设计实验证明亚硫酸钠粗品含有少量
 的方案是:在一支试管中,加入少量亚硫酸钠粗品,用适量蒸馏水溶解,
的方案是:在一支试管中,加入少量亚硫酸钠粗品,用适量蒸馏水溶解, 。
。(6)
 可用于处理酸性废水中的
可用于处理酸性废水中的 (转化为
(转化为 ),发生反应的离子方程式为
),发生反应的离子方程式为(7)某化工厂用如图所示工艺流程吸收烟气中的
 。在标准状况下,当除去
。在标准状况下,当除去 时,消耗
时,消耗 的物质的量为
的物质的量为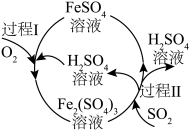
您最近一年使用:0次
解题方法
2 . 通过海水晾晒可得粗盐,粗盐中除NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质,需要提纯后才能综合利用。某同学利用给定试剂NaOH溶液、BaCl2溶液、Na2CO3溶液和盐酸,设计了如图粗盐精制的实验流程,下列说法正确的是

| A.试剂①可以是Na2CO3溶液 |
| B.每一步加入的除杂试剂一定需要足量 |
| C.操作a是过滤,为了快速过滤,可以在过滤时用玻璃棒轻轻搅拌 |
D.检验SO 是否除净的操作:取少量溶液C,加入BaCl2溶液有白色沉淀,说明未除尽 是否除净的操作:取少量溶液C,加入BaCl2溶液有白色沉淀,说明未除尽 |
您最近一年使用:0次
解题方法
3 . 某化学实验室产生的废液中含有 、
、 、
、 三种金属离子,实验室设计如图所示方案对废液进行处理,以回收金属并制得氧化铁,保护环境。
三种金属离子,实验室设计如图所示方案对废液进行处理,以回收金属并制得氧化铁,保护环境。
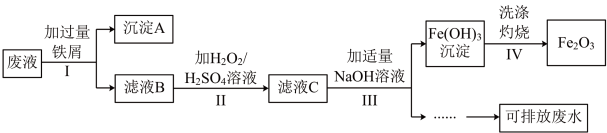
回答下列问题:
(1)步骤Ⅰ中分离沉淀A和滤液B的操作是_____ ,在实验室进行该操作时需要的玻璃仪器有_____ 。
(2)沉淀A中含有的金属单质是铁、_____ (填名称)。
(3)步骤Ⅱ中加入 溶液目的是
溶液目的是_____ (用离子方程式表示)。
(4)请检验步骤Ⅲ中 是否沉淀完全
是否沉淀完全_____
(5)“可排放废水”中含有的主要离子是_____ (填离子符号)。
 、
、 、
、 三种金属离子,实验室设计如图所示方案对废液进行处理,以回收金属并制得氧化铁,保护环境。
三种金属离子,实验室设计如图所示方案对废液进行处理,以回收金属并制得氧化铁,保护环境。
回答下列问题:
(1)步骤Ⅰ中分离沉淀A和滤液B的操作是
(2)沉淀A中含有的金属单质是铁、
(3)步骤Ⅱ中加入
 溶液目的是
溶液目的是(4)请检验步骤Ⅲ中
 是否沉淀完全
是否沉淀完全(5)“可排放废水”中含有的主要离子是
您最近一年使用:0次
解题方法
4 . 以黄铁矿(主要成分FeS2)为原料生产硫酸,应将产出的炉渣和尾气进行资源化综合利用,减轻对环境的污染。其中一种流程如图所示。
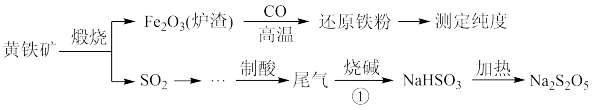
Na2S2O5:焦亚硫酸钠,白色粉末,水溶液显酸性,受潮易分解,遇强酸则放出一种刺激性气味的气体,是一种化工原料,常用作抗氧化剂。
(1)煅烧前,黄铁矿需要研磨,目的是_________________________________ 。
(2)煅烧黄铁矿的化学方程式是_________________________________ 。
(3)因为Na2S2O5具有_________ 性,导致商品Na2S2O5中不可避免地存在Na2SO4。检验其中含有SO 的方法是
的方法是_______________________________________ 。
(4)Na2S2O5可用于葡萄酒的抗氧化剂。用碘标准液可测定葡萄酒中Na2S2O5的残留量,请配平该反应的离子方程式:________ 。
____ S2O + _____I2 + _______ = _______ + _______ + _______
+ _____I2 + _______ = _______ + _______ + _______
(5)查阅资料知:“尾气”可用双碱脱硫法处理,其过程如图所示。
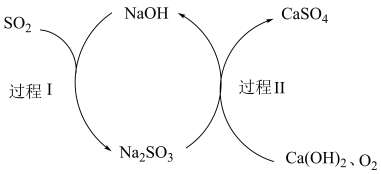
①写出过程I的离子反应方程式__________________________ 。

Na2S2O5:焦亚硫酸钠,白色粉末,水溶液显酸性,受潮易分解,遇强酸则放出一种刺激性气味的气体,是一种化工原料,常用作抗氧化剂。
(1)煅烧前,黄铁矿需要研磨,目的是
(2)煅烧黄铁矿的化学方程式是
(3)因为Na2S2O5具有
 的方法是
的方法是(4)Na2S2O5可用于葡萄酒的抗氧化剂。用碘标准液可测定葡萄酒中Na2S2O5的残留量,请配平该反应的离子方程式:
____ S2O
 + _____I2 + _______ = _______ + _______ + _______
+ _____I2 + _______ = _______ + _______ + _______(5)查阅资料知:“尾气”可用双碱脱硫法处理,其过程如图所示。

①写出过程I的离子反应方程式
②过程II反应中氧化剂与还原剂的物质的量之比为
您最近一年使用:0次
解题方法
5 . 海水是巨大的资源宝库,从海水中提取食盐和溴的过程如图所示:

(1)写出工业上由食盐制备
 的离子方程式:
的离子方程式:(2)步骤Ⅰ中已获得
 ,步骤Ⅱ中又将
,步骤Ⅱ中又将 转化为
转化为 和
和 ,其目的是
,其目的是(3)步骤Ⅱ中通入热空气吹出
 ,利用了
,利用了 的___________(填标号)。
的___________(填标号)。| A.氧化性 | B.还原性 | C.挥发性 | D.腐蚀性 |
(4)步骤Ⅱ中用纯碱溶液吸收
 ,该反应的化学方程式为
,该反应的化学方程式为(5)从理论上考虑,下列物质也能吸收
 的是___________(填标号)。
的是___________(填标号)。A. | B.NaCl溶液 | C. 溶液 溶液 | D. 溶液 溶液 |
(6)查阅资料知,
 的沸点为58.8 ℃,微溶于水,有毒性和强腐蚀性。步骤Ⅲ中对蒸馏烧瓶采取的加热方式是
的沸点为58.8 ℃,微溶于水,有毒性和强腐蚀性。步骤Ⅲ中对蒸馏烧瓶采取的加热方式是
您最近一年使用:0次
名校
解题方法
6 . 除去泥沙等不溶物的粗盐含有氯化镁、氯化钙、硫酸钠等杂质,某实验小组设计的精制过程如图所示。

A.X、Y的化学式分别为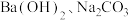 |
| B.加入X溶液和Y溶液的顺序可以颠倒 |
| C.沉降后取少量清液,继续滴加除杂试剂后无沉淀,说明该试剂已过量 |
| D.在蒸发皿中加热蒸发至大量精盐析出时停止加热,少量水分用余热蒸干 |
您最近一年使用:0次
2024-03-02更新
|
358次组卷
|
3卷引用:云南师范大学附属中学2023-2024学年高一下学期第一次月考化学试题
名校
7 . 铁有两种氯化物,都是重要的化工试剂。查阅有关资料如下:
氯化铁:熔点为306℃,沸点为315℃;易吸收空气中的水分而潮解。工业上采用向500~600℃的铁粉中通入氯气来生产无水氯化铁。
氯化亚铁:熔点为670℃,可升华。工业上采用向炽热铁粉中通入氯化氢来生产无水氯化亚铁。
某化学活动小组用如图所示的装置(夹持装置略去)模拟工业生产制备无水氯化铁。请回答下列问题:
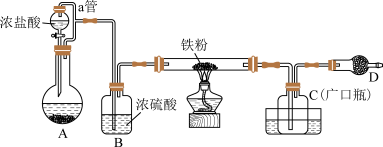
(1)装置A中,用 与浓盐酸反应制取氯气,写出反应的离子方程式:
与浓盐酸反应制取氯气,写出反应的离子方程式:___________ 。
(2)装置A中导管a的作用是___________ 。C放置在盛冷水的水槽中,冷水浴的作用是___________ 。
(3)装置D的名称是___________ ,仪器D中装的药品可以是___________ (填序号)。
A. B.碱石灰 C.
B.碱石灰 C. D.浓硫酸
D.浓硫酸
(4)定性分析。取装置C中的少量产物溶于稀硫酸中配成稀溶液待用。若产物中混有 ,是否可用酸性
,是否可用酸性 溶液检验
溶液检验 的存在?
的存在?___________ (填“是”或“否”);理由是___________ 。
(5)定量分析。取装置C中的产物,按以下步骤进行测定:①称取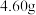 产品溶于过量的稀盐酸中;②加入足量
产品溶于过量的稀盐酸中;②加入足量 溶液;③再加入足量
溶液;③再加入足量 溶液;④过滤、洗涤后灼烧沉淀;⑤称量所得红棕色固体为
溶液;④过滤、洗涤后灼烧沉淀;⑤称量所得红棕色固体为 。写出加入足量
。写出加入足量 溶液发生反应的离子方程式:
溶液发生反应的离子方程式:___________ ,计算该样品中铁元素的质量分数为___________ %(结果精确到小数点后两位)。
(6)由(5)定量分析数据得出结论,并提出改进措施。
①对比氯化铁中铁元素的质量分数为34.46%,说明含有 杂质。
杂质。
②若要得到较纯净的无水氯化铁,实验装置可进行的改进措施是___________ 。
氯化铁:熔点为306℃,沸点为315℃;易吸收空气中的水分而潮解。工业上采用向500~600℃的铁粉中通入氯气来生产无水氯化铁。
氯化亚铁:熔点为670℃,可升华。工业上采用向炽热铁粉中通入氯化氢来生产无水氯化亚铁。
某化学活动小组用如图所示的装置(夹持装置略去)模拟工业生产制备无水氯化铁。请回答下列问题:

(1)装置A中,用
 与浓盐酸反应制取氯气,写出反应的离子方程式:
与浓盐酸反应制取氯气,写出反应的离子方程式:(2)装置A中导管a的作用是
(3)装置D的名称是
A.
 B.碱石灰 C.
B.碱石灰 C. D.浓硫酸
D.浓硫酸(4)定性分析。取装置C中的少量产物溶于稀硫酸中配成稀溶液待用。若产物中混有
 ,是否可用酸性
,是否可用酸性 溶液检验
溶液检验 的存在?
的存在?(5)定量分析。取装置C中的产物,按以下步骤进行测定:①称取
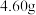 产品溶于过量的稀盐酸中;②加入足量
产品溶于过量的稀盐酸中;②加入足量 溶液;③再加入足量
溶液;③再加入足量 溶液;④过滤、洗涤后灼烧沉淀;⑤称量所得红棕色固体为
溶液;④过滤、洗涤后灼烧沉淀;⑤称量所得红棕色固体为 。写出加入足量
。写出加入足量 溶液发生反应的离子方程式:
溶液发生反应的离子方程式:(6)由(5)定量分析数据得出结论,并提出改进措施。
①对比氯化铁中铁元素的质量分数为34.46%,说明含有
 杂质。
杂质。②若要得到较纯净的无水氯化铁,实验装置可进行的改进措施是
您最近一年使用:0次
2024-02-10更新
|
263次组卷
|
2卷引用:云南师范大学附属中学2023-2024学年高一上学期1月教学测评期末化学试题
8 . 回答下列问题:
I.Na2CO3在轻工、建材、纺织、国防、医药等工业中有重要的应用。工业碳酸钠(纯度约为 98%)中含有 Ca2+、Mg2+、Fe3+、Cl-和 SO 等杂质,提纯工艺线路如下:
等杂质,提纯工艺线路如下:

已知:碳酸镁微溶,氢氧化镁难溶,碳酸钠的饱和溶液在不同温度下析出的溶质如下所示:

请回答下列问题:
(1)工业上常用煅烧 NaHCO3 的方法得到碳酸钠,该反应的化学方程式为:_____ 。
(2)试剂 A 是_____ ,“母液”中除了含有 Na+、CO 、OH-外,还含有
、OH-外,还含有_____ 等离子,过滤要“趁热”的目的是_____ 。
Ⅱ.稀土是一种重要的战略资源,我国稀土出口量世界第一、饰(Ce)是一种典型的稀土元素,其在自然界中主要以氟碳铈矿(主要成分为)形式存在。工业上利用氟碳铈矿制取 的一种工艺流程如图:
的一种工艺流程如图:

回答下列问题:
(3)已知 中C为+4价,F为-1价,在空气中焙烧
中C为+4价,F为-1价,在空气中焙烧 的反应中Ce元素被
的反应中Ce元素被_____ (填“氧化”或“还原”),该反应中氧化剂与还原剂物质的量之比为_____ 。
(4)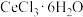 属于
属于_____ (填“纯净物”或“混合物”)。
(5)酸浸过程中用稀硫酸和 。写出稀硫酸、
。写出稀硫酸、 与
与 反应的离子方程式:
反应的离子方程式:_____ 。
(6)室温下,粒子直径为1~10nm的 分散到水中形成分散系。如何检验该分散系
分散到水中形成分散系。如何检验该分散系_____ 。(填实验操作、现象)。
(7)准确称取 样品置于锥形瓶中,加入适量过硫酸铵溶液将
样品置于锥形瓶中,加入适量过硫酸铵溶液将 氧化为
氧化为 ,然后加入
,然后加入 与之恰好反应完。(已知:
与之恰好反应完。(已知: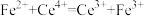 )该样品中
)该样品中 的质量分数为
的质量分数为_____ (结果保留三位有效数字)。
I.Na2CO3在轻工、建材、纺织、国防、医药等工业中有重要的应用。工业碳酸钠(纯度约为 98%)中含有 Ca2+、Mg2+、Fe3+、Cl-和 SO
 等杂质,提纯工艺线路如下:
等杂质,提纯工艺线路如下:
已知:碳酸镁微溶,氢氧化镁难溶,碳酸钠的饱和溶液在不同温度下析出的溶质如下所示:

请回答下列问题:
(1)工业上常用煅烧 NaHCO3 的方法得到碳酸钠,该反应的化学方程式为:
(2)试剂 A 是
 、OH-外,还含有
、OH-外,还含有Ⅱ.稀土是一种重要的战略资源,我国稀土出口量世界第一、饰(Ce)是一种典型的稀土元素,其在自然界中主要以氟碳铈矿(主要成分为)形式存在。工业上利用氟碳铈矿制取
 的一种工艺流程如图:
的一种工艺流程如图:
回答下列问题:
(3)已知
 中C为+4价,F为-1价,在空气中焙烧
中C为+4价,F为-1价,在空气中焙烧 的反应中Ce元素被
的反应中Ce元素被(4)
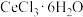 属于
属于(5)酸浸过程中用稀硫酸和
 。写出稀硫酸、
。写出稀硫酸、 与
与 反应的离子方程式:
反应的离子方程式:(6)室温下,粒子直径为1~10nm的
 分散到水中形成分散系。如何检验该分散系
分散到水中形成分散系。如何检验该分散系(7)准确称取
 样品置于锥形瓶中,加入适量过硫酸铵溶液将
样品置于锥形瓶中,加入适量过硫酸铵溶液将 氧化为
氧化为 ,然后加入
,然后加入 与之恰好反应完。(已知:
与之恰好反应完。(已知: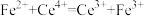 )该样品中
)该样品中 的质量分数为
的质量分数为
您最近一年使用:0次
解题方法
9 . 资源的回收利用,对可持续发展有着重要意义。某工业废料中主要含 、
、 等,现欲利用如图工业流程回收某些金属资源。
等,现欲利用如图工业流程回收某些金属资源。
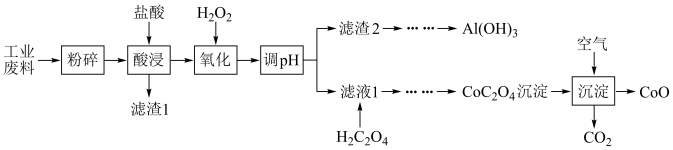
已知:①空气中氧气的体积分数约为20%。回答下列问题:
(1)“粉碎”的目的为___________ ,调节pH后的实验操作是___________ ;
(2)“氧化”的目的是将 氧化为
氧化为 ,其反应的离子方程式为
,其反应的离子方程式为___________ ;“氧化”过程中温度控制在 ,避免温度过高的原因为
,避免温度过高的原因为___________ ;
(3) 的化合物一般都容易被氧化,比如氢氧化亚铁在潮湿的空气中被氧化而发生变色,最终变为
的化合物一般都容易被氧化,比如氢氧化亚铁在潮湿的空气中被氧化而发生变色,最终变为___________ 色,写出其化学方程式___________ ;
(4)新型富钴电池常用到 的化合物
的化合物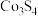 ,其化学性质与
,其化学性质与 相似,则
相似,则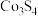 中Co的化合价为
中Co的化合价为___________ ;
(5)“煅烧”反应的化学方程式为___________ ,每制备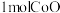 ,至少需要标准状况下的空气体积为
,至少需要标准状况下的空气体积为___________ L。
 、
、 等,现欲利用如图工业流程回收某些金属资源。
等,现欲利用如图工业流程回收某些金属资源。
已知:①空气中氧气的体积分数约为20%。回答下列问题:
(1)“粉碎”的目的为
(2)“氧化”的目的是将
 氧化为
氧化为 ,其反应的离子方程式为
,其反应的离子方程式为 ,避免温度过高的原因为
,避免温度过高的原因为(3)
 的化合物一般都容易被氧化,比如氢氧化亚铁在潮湿的空气中被氧化而发生变色,最终变为
的化合物一般都容易被氧化,比如氢氧化亚铁在潮湿的空气中被氧化而发生变色,最终变为(4)新型富钴电池常用到
 的化合物
的化合物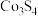 ,其化学性质与
,其化学性质与 相似,则
相似,则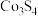 中Co的化合价为
中Co的化合价为(5)“煅烧”反应的化学方程式为
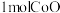 ,至少需要标准状况下的空气体积为
,至少需要标准状况下的空气体积为
您最近一年使用:0次
名校
解题方法
10 . 利用废旧镀锌铁皮制备磁性纳米级 及ZnO,制备流程图如下:
及ZnO,制备流程图如下:

已知反应:①
②
回答下列问题:
(1)步骤Ⅰ中的分离操作名称是_______ ,溶液A中的溶质有_____ (填化学式)
(2)步骤Ⅲ中反应的离子方程式是___________ 。
(3)步骤Ⅳ中反应的离子方程式是___________ 。
(4)步骤Ⅵ的主要操作是_______ 。
(5)如何检验溶液C中的Fe2+离子_________ 。
 及ZnO,制备流程图如下:
及ZnO,制备流程图如下:
已知反应:①

②

回答下列问题:
(1)步骤Ⅰ中的分离操作名称是
(2)步骤Ⅲ中反应的离子方程式是
(3)步骤Ⅳ中反应的离子方程式是
(4)步骤Ⅵ的主要操作是
(5)如何检验溶液C中的Fe2+离子
您最近一年使用:0次



