解题方法
1 . 废弃物的综合利用有利于节约资源、保护环境。实验室利用废旧电池的铜帽(Cu、Zn总含量约为99%)制备 和
和 的部分实验步骤如下:
的部分实验步骤如下: ”步骤中,为加快溶解速率,可采取的措施是
”步骤中,为加快溶解速率,可采取的措施是___________ 。(任写一种方法)。
(2)从“滤液 ”中提取
”中提取 的实验步骤依次为
的实验步骤依次为___________ 、过滤、冰水洗涤、低温干燥,其中冰水洗涤晶体的目的是___________ 。
(3)在“溶解 ”步骤中,发生反应的化学方程式为
”步骤中,发生反应的化学方程式为___________ 。
(4)为测定产品中 的纯度,称取1.270g样品,溶于稀硫酸并稀释至250mL,取出25.00mL溶液于锥形瓶中,加入过量的KI溶液充分反应,再向其中逐滴加入0.02000
的纯度,称取1.270g样品,溶于稀硫酸并稀释至250mL,取出25.00mL溶液于锥形瓶中,加入过量的KI溶液充分反应,再向其中逐滴加入0.02000
 溶液至刚好完全反应,消耗
溶液至刚好完全反应,消耗 溶液25.00mL。
溶液25.00mL。
已知: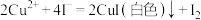 ,
, 。请依据实验数据计算样品中
。请依据实验数据计算样品中 的质量分数
的质量分数___________ (写出计算过程,结果保留2位小数)。
 和
和 的部分实验步骤如下:
的部分实验步骤如下: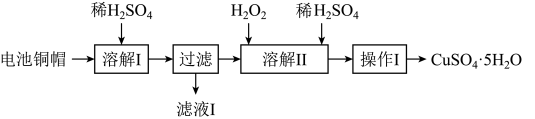
 ”步骤中,为加快溶解速率,可采取的措施是
”步骤中,为加快溶解速率,可采取的措施是(2)从“滤液
 ”中提取
”中提取 的实验步骤依次为
的实验步骤依次为(3)在“溶解
 ”步骤中,发生反应的化学方程式为
”步骤中,发生反应的化学方程式为(4)为测定产品中
 的纯度,称取1.270g样品,溶于稀硫酸并稀释至250mL,取出25.00mL溶液于锥形瓶中,加入过量的KI溶液充分反应,再向其中逐滴加入0.02000
的纯度,称取1.270g样品,溶于稀硫酸并稀释至250mL,取出25.00mL溶液于锥形瓶中,加入过量的KI溶液充分反应,再向其中逐滴加入0.02000
 溶液至刚好完全反应,消耗
溶液至刚好完全反应,消耗 溶液25.00mL。
溶液25.00mL。已知:
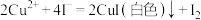 ,
, 。请依据实验数据计算样品中
。请依据实验数据计算样品中 的质量分数
的质量分数
您最近一年使用:0次
解题方法
2 . 废弃物的综合利用有利于节约资源、保护环境。实验室利用废旧电池的铜帽(Cu、Zn总含量约为99%)制备ZnSO4·7H2O和CuSO4·5H2O的部分实验步骤如下:
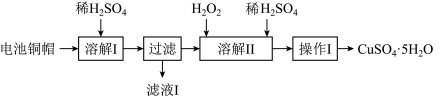
(1)在“溶解I”步骤中,为加快溶解速率,可采取的措施是_______ (任写一种方法)。
(2)从“滤液I”中提取ZnSO4·7H2O的实验步骤依次为_______ 、_______ 、过滤、冰水洗涤、低温干燥。
(3)仔细分析流程,在“溶解II”步骤中,发生反应的化学方程式为_______ (用双线桥标出电子转移的方向和数目)。
(4)为测定产品中CuSO4·5H2O的纯度,称取1.270g样品,溶于稀硫酸并稀释至250mL,取出25.00mL溶液于锥形瓶中,加入过量的KI溶液充分反应,再向其中逐滴加入0.02000mol/LNa2S2O3标准溶液至滴定终点,消耗Na2S2O3溶液25.00mL。
已知:2CuSO4+4KI=2CuI(白色)+I2+2K2SO4;2Na2S2O3+I2=2NaI+Na2S4O6
请依据实验数据计算样品中CuSO4·5H2O的质量分数_______ (写出计算过程,结果用百分数表示,小数点后保留1位有效数字)。

(1)在“溶解I”步骤中,为加快溶解速率,可采取的措施是
(2)从“滤液I”中提取ZnSO4·7H2O的实验步骤依次为
(3)仔细分析流程,在“溶解II”步骤中,发生反应的化学方程式为
(4)为测定产品中CuSO4·5H2O的纯度,称取1.270g样品,溶于稀硫酸并稀释至250mL,取出25.00mL溶液于锥形瓶中,加入过量的KI溶液充分反应,再向其中逐滴加入0.02000mol/LNa2S2O3标准溶液至滴定终点,消耗Na2S2O3溶液25.00mL。
已知:2CuSO4+4KI=2CuI(白色)+I2+2K2SO4;2Na2S2O3+I2=2NaI+Na2S4O6
请依据实验数据计算样品中CuSO4·5H2O的质量分数
您最近一年使用:0次
3 . 现有含有 杂质的
杂质的 样品1.95g,某同学在实验室用如图装置(部分夹持仪器已省略)测定其杂质含量:
样品1.95g,某同学在实验室用如图装置(部分夹持仪器已省略)测定其杂质含量:
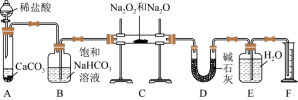
已知:碱石灰主要含有氧化钙和氢氧化钠
回答下列问题:
(1)将仪器连接好后,首先要进行的实验操作是_____ 。
(2)装置B中饱和碳酸氢钠的作用是除去 中HCl气体,该过程涉及的离子反应方程式是
中HCl气体,该过程涉及的离子反应方程式是_____ 。
(3)写出装置C中 和
和 反应的化学方程式:
反应的化学方程式:_____ 。
(4)若无装置D,测得样品中 的质量分数
的质量分数_____ (填“偏高”“偏低”或“无影响”)。
(5)1.95g样品充分反应后,待冷却后读出装置F中水的体积,将其折算成产生气体的质量为0.24g,则样品中 的质量分数为
的质量分数为_____ 。
(6)若除去 粉末中的
粉末中的 ,采用的简单方法为
,采用的简单方法为_____ 。
(7)若将 投入到含有下列离子的溶液中:
投入到含有下列离子的溶液中: 、
、 、
、 、
、 、
、 、
、 ,反应完毕后,溶液中上述离子数目几乎不变的有
,反应完毕后,溶液中上述离子数目几乎不变的有__________ (填离子符号)。
 杂质的
杂质的 样品1.95g,某同学在实验室用如图装置(部分夹持仪器已省略)测定其杂质含量:
样品1.95g,某同学在实验室用如图装置(部分夹持仪器已省略)测定其杂质含量:
已知:碱石灰主要含有氧化钙和氢氧化钠
回答下列问题:
(1)将仪器连接好后,首先要进行的实验操作是
(2)装置B中饱和碳酸氢钠的作用是除去
 中HCl气体,该过程涉及的离子反应方程式是
中HCl气体,该过程涉及的离子反应方程式是(3)写出装置C中
 和
和 反应的化学方程式:
反应的化学方程式:(4)若无装置D,测得样品中
 的质量分数
的质量分数(5)1.95g样品充分反应后,待冷却后读出装置F中水的体积,将其折算成产生气体的质量为0.24g,则样品中
 的质量分数为
的质量分数为(6)若除去
 粉末中的
粉末中的 ,采用的简单方法为
,采用的简单方法为(7)若将
 投入到含有下列离子的溶液中:
投入到含有下列离子的溶液中: 、
、 、
、 、
、 、
、 、
、 ,反应完毕后,溶液中上述离子数目几乎不变的有
,反应完毕后,溶液中上述离子数目几乎不变的有
您最近一年使用:0次
2024-04-07更新
|
79次组卷
|
2卷引用:江西省宜春市丰城市第九中学2023-2024学年高一下学期4月月考化学试题
名校
解题方法
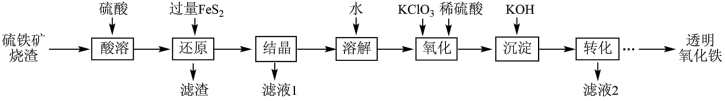
4 . 由硫铁矿烧渣(主要成分为 、
、 、
、 和
和 )得到绿矾(
)得到绿矾( ),然后制取透明氧化铁颜料的流程如下:
),然后制取透明氧化铁颜料的流程如下:
已知:①透明氧化铁又称纳米氧化铁,粒子直径极其微小(10~90nm),包括氧化铁黄(FeOOH)和氧化铁红( ),难溶于水;
),难溶于水;
②“还原”时, 能将
能将 中的硫元素氧化为+6价。
中的硫元素氧化为+6价。
回答下列问题:
(1)“酸溶”时用到的480mL0.5mol/L的稀硫酸需要用18.4mol/L浓硫酸配制,配制时所需的玻璃仪器除量筒、烧杯、玻璃棒外,还需要___________ 、___________ ,需要用量筒量取浓硫酸的体积为___________ ,配制溶液操作中,若定容时俯视刻度线,则所配稀硫酸的浓度___________ (填“偏大”、“偏小”或“无影响”)。
(2)“滤渣”中的主要成分有过量的 和
和___________ (填化学式)。
(3)“还原”过程中涉及的离子方程式为___________ 。
(4)流程中“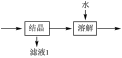 ”环节的目的是
”环节的目的是___________ 。
(5)“沉淀”采用分批加入KOH溶液,并不断搅拌,这样操作不但可以得到色泽纯正的氢氧化铁,而且还可以___________ 。
(6)可用分光光度法测定制得的透明氧化铁中氧化铁黄和氧化铁红的含量。已知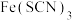 的吸光度A(对特定波长光的吸收程度)与
的吸光度A(对特定波长光的吸收程度)与 标准溶液浓度的关系如图所示:
标准溶液浓度的关系如图所示:
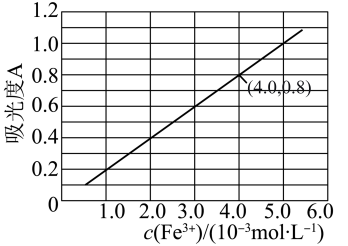
称取3.47g透明氧化铁,用稀硫酸溶解并定容至1L,准确移取该溶液10.00mL,加入足量KSCN溶液,再用蒸馏水定容至100mL。测得溶液吸光度A=0.8,则透明氧化铁中氧化铁红( )的质量分数为
)的质量分数为___________ %(保留小数点后一位)。
 、
、 、
、 和
和 )得到绿矾(
)得到绿矾( ),然后制取透明氧化铁颜料的流程如下:
),然后制取透明氧化铁颜料的流程如下:
已知:①透明氧化铁又称纳米氧化铁,粒子直径极其微小(10~90nm),包括氧化铁黄(FeOOH)和氧化铁红(
 ),难溶于水;
),难溶于水;②“还原”时,
 能将
能将 中的硫元素氧化为+6价。
中的硫元素氧化为+6价。回答下列问题:
(1)“酸溶”时用到的480mL0.5mol/L的稀硫酸需要用18.4mol/L浓硫酸配制,配制时所需的玻璃仪器除量筒、烧杯、玻璃棒外,还需要
(2)“滤渣”中的主要成分有过量的
 和
和(3)“还原”过程中涉及的离子方程式为
(4)流程中“
 ”环节的目的是
”环节的目的是(5)“沉淀”采用分批加入KOH溶液,并不断搅拌,这样操作不但可以得到色泽纯正的氢氧化铁,而且还可以
(6)可用分光光度法测定制得的透明氧化铁中氧化铁黄和氧化铁红的含量。已知
 的吸光度A(对特定波长光的吸收程度)与
的吸光度A(对特定波长光的吸收程度)与 标准溶液浓度的关系如图所示:
标准溶液浓度的关系如图所示:
称取3.47g透明氧化铁,用稀硫酸溶解并定容至1L,准确移取该溶液10.00mL,加入足量KSCN溶液,再用蒸馏水定容至100mL。测得溶液吸光度A=0.8,则透明氧化铁中氧化铁红(
 )的质量分数为
)的质量分数为
您最近一年使用:0次
名校
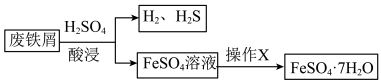
5 . 综合利用废弃物,对资源利用和环境保护具有现实意义。以废铁屑(含少量 等杂质)为原料,制备硫酸亚铁晶体(
等杂质)为原料,制备硫酸亚铁晶体( ),流程示意图如下。
),流程示意图如下。
(1)酸浸过程中, 的作用是
的作用是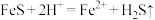 、
、 、
、___________ (用离子方程式表示)。
(2)酸浸时间对所得溶液的成分影响如下表所示。
①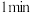 时检验,溶液变红,写出离子方程式
时检验,溶液变红,写出离子方程式___________
② 时检验,用离子方程式表示溶液未变红的原因
时检验,用离子方程式表示溶液未变红的原因___________ 。
③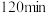 时检验,溶液复又变红,用文字说明原因
时检验,溶液复又变红,用文字说明原因___________ 。
(3)已知: 受热易失水。操作X为:
受热易失水。操作X为: ___________ 。
(4)测定所得硫酸亚铁晶体中 的含量,步骤如下:
的含量,步骤如下:
Ⅰ.称取 硫酸亚铁晶体样品,配制成
硫酸亚铁晶体样品,配制成 溶液。
溶液。
Ⅱ.取出 溶液,加入适量稀硫酸,滴入
溶液,加入适量稀硫酸,滴入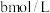 的
的 溶液,至反应完全共消耗
溶液,至反应完全共消耗 溶液
溶液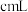 。
。
①依题意完善Ⅱ中 氧化
氧化 的离子方程式
的离子方程式________

 ___________
___________
 ___________
___________
②计算硫酸亚铁晶体样品中 的质量分数
的质量分数___________ 。
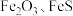 等杂质)为原料,制备硫酸亚铁晶体(
等杂质)为原料,制备硫酸亚铁晶体( ),流程示意图如下。
),流程示意图如下。
(1)酸浸过程中,
 的作用是
的作用是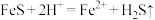 、
、 、
、(2)酸浸时间对所得溶液的成分影响如下表所示。
| 酸浸时间 |  |  |  |
用 溶液检验 溶液检验 | 变红 | 未变红 | 变红 |
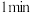 时检验,溶液变红,写出离子方程式
时检验,溶液变红,写出离子方程式②
 时检验,用离子方程式表示溶液未变红的原因
时检验,用离子方程式表示溶液未变红的原因③
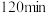 时检验,溶液复又变红,用文字说明原因
时检验,溶液复又变红,用文字说明原因(3)已知:
 受热易失水。操作X为:
受热易失水。操作X为: (4)测定所得硫酸亚铁晶体中
 的含量,步骤如下:
的含量,步骤如下:Ⅰ.称取
 硫酸亚铁晶体样品,配制成
硫酸亚铁晶体样品,配制成 溶液。
溶液。Ⅱ.取出
 溶液,加入适量稀硫酸,滴入
溶液,加入适量稀硫酸,滴入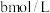 的
的 溶液,至反应完全共消耗
溶液,至反应完全共消耗 溶液
溶液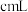 。
。①依题意完善Ⅱ中
 氧化
氧化 的离子方程式
的离子方程式
 ___________
___________
 ___________
___________②计算硫酸亚铁晶体样品中
 的质量分数
的质量分数
您最近一年使用:0次
2024-03-27更新
|
221次组卷
|
4卷引用:江西省丰城中学2023-2024学年高一下学期开学化学试题
名校
解题方法
6 . 以废铁屑(含少量Fe2O3、FeS等杂质)为原料,制备硫酸亚铁晶体(FeSO4·7H2O),流程示意图如下。(已知:FeSO4·7H2O晶体受热易失水。)
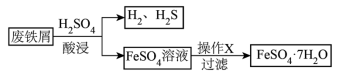
(1)H2SO4的电离方程式是_______ 。
(2)酸浸时间对所得溶液的成分影响如下表所示。
①1min时检验,溶液变红,说明所得溶液中含有_______ 。
②30min时检验,用离子方程式表示溶液未变红的原因_______ 。
③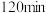 时检验,溶液复又变红,用离子方程式说明原因
时检验,溶液复又变红,用离子方程式说明原因_______ 。
④操作X是_______ 。
(3)测定所得硫酸亚铁晶体中 的含量,步骤如下:
的含量,步骤如下:
Ⅰ:称取ag硫酸亚铁晶体样品,配制成100mL溶液。
Ⅱ:取出 溶液,加入适量稀硫酸,滴入bmol·L-1的
溶液,加入适量稀硫酸,滴入bmol·L-1的 溶液,至反应完全共消耗
溶液,至反应完全共消耗 溶液cmL。
溶液cmL。
①Ⅱ中 氧化
氧化 的离子方程式是
的离子方程式是_______ 。
②计算硫酸亚铁晶体样品中 的质量分数
的质量分数_______ 。

(1)H2SO4的电离方程式是
(2)酸浸时间对所得溶液的成分影响如下表所示。
| 酸浸时间 | 1min | 30min | 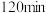 |
| 用KSCN溶液检验 | 变红 | 未变红 | 变红 |
②30min时检验,用离子方程式表示溶液未变红的原因
③
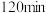 时检验,溶液复又变红,用离子方程式说明原因
时检验,溶液复又变红,用离子方程式说明原因④操作X是
(3)测定所得硫酸亚铁晶体中
 的含量,步骤如下:
的含量,步骤如下:Ⅰ:称取ag硫酸亚铁晶体样品,配制成100mL溶液。
Ⅱ:取出
 溶液,加入适量稀硫酸,滴入bmol·L-1的
溶液,加入适量稀硫酸,滴入bmol·L-1的 溶液,至反应完全共消耗
溶液,至反应完全共消耗 溶液cmL。
溶液cmL。①Ⅱ中
 氧化
氧化 的离子方程式是
的离子方程式是②计算硫酸亚铁晶体样品中
 的质量分数
的质量分数
您最近一年使用:0次
7 . Ⅰ.“价类”二维图是学习元素及其化合物的重要工具.如图所示是铁及其化合物的“价类”二维图。__________ 、__________ ;Z在空气中转化为W的化学方程式为__________ 。
(2)含重铬酸根离子 的工业废水有毒,必须经过处理达标后才能排放。工业上常用绿矾
的工业废水有毒,必须经过处理达标后才能排放。工业上常用绿矾 作处理剂,发生反应的离子方程式为
作处理剂,发生反应的离子方程式为 ,则该反应中还原性:
,则该反应中还原性:
______ (填“>”或“<”) 。该反应中,每生成
。该反应中,每生成 ,消耗
,消耗 的质量为
的质量为__________ g。
Ⅱ.硫酸亚铁晶体 在医药上作补血剂。某课外小组取10片补血剂总质量w g,通过一系列反应转变为
在医药上作补血剂。某课外小组取10片补血剂总质量w g,通过一系列反应转变为 来测定该补血剂中铁元素的含量。实验步骤如下:
来测定该补血剂中铁元素的含量。实验步骤如下:
(3)某同学发现部分补血剂药片表面发黄,怀疑该补铁剂已经变质,遂取少量步骤①的滤液,滴加__________ 后,溶液变为红色,证实了怀疑。
(4)步骤②反应的离子方程式为__________ ,下列物质中可以用来代替该步骤中的 是
是__________ (填序号)。
① 溶液 ②氯水 ③稀盐酸 ④碳酸钠
溶液 ②氯水 ③稀盐酸 ④碳酸钠
(5)服用维生素C可使食物中的 转化为
转化为 ,从而实现科学补铁,在这个过程中体现出维生素C的
,从而实现科学补铁,在这个过程中体现出维生素C的__________ 性。假设实验中的损耗忽略不计,则该补血剂含铁元素的质量分数为__________ 。

(2)含重铬酸根离子
 的工业废水有毒,必须经过处理达标后才能排放。工业上常用绿矾
的工业废水有毒,必须经过处理达标后才能排放。工业上常用绿矾 作处理剂,发生反应的离子方程式为
作处理剂,发生反应的离子方程式为 ,则该反应中还原性:
,则该反应中还原性:
 。该反应中,每生成
。该反应中,每生成 ,消耗
,消耗 的质量为
的质量为Ⅱ.硫酸亚铁晶体
 在医药上作补血剂。某课外小组取10片补血剂总质量w g,通过一系列反应转变为
在医药上作补血剂。某课外小组取10片补血剂总质量w g,通过一系列反应转变为 来测定该补血剂中铁元素的含量。实验步骤如下:
来测定该补血剂中铁元素的含量。实验步骤如下:
(3)某同学发现部分补血剂药片表面发黄,怀疑该补铁剂已经变质,遂取少量步骤①的滤液,滴加
(4)步骤②反应的离子方程式为
 是
是①
 溶液 ②氯水 ③稀盐酸 ④碳酸钠
溶液 ②氯水 ③稀盐酸 ④碳酸钠(5)服用维生素C可使食物中的
 转化为
转化为 ,从而实现科学补铁,在这个过程中体现出维生素C的
,从而实现科学补铁,在这个过程中体现出维生素C的
您最近一年使用:0次
2024-01-24更新
|
143次组卷
|
2卷引用:四川省内江市2023-2024学年高一上学期期末检测题化学试题
8 . 工业上,处理低晶位黄铜矿【二硫化亚铁 】含量较低常采用生物堆浸法。堆浸所得的溶液可用于制备绿矾
】含量较低常采用生物堆浸法。堆浸所得的溶液可用于制备绿矾 和胆矾
和胆矾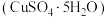 相关流程如图所示。
相关流程如图所示。

(1)低品位黄铜矿研磨的作用是___________ 。
(2)生物堆浸过程的反应在T.f细菌的作用下进行,主要包括两个阶段,第一阶段的反应为 ,第二阶段部分
,第二阶段部分 继续和氧气反应转变成
继续和氧气反应转变成 。第一阶段中消耗
。第一阶段中消耗 转移电子
转移电子___________ mol,第二阶段反应的离子方程式是___________ 。
(3)过程I是在酸性条件下,加入 固体,试分析加入该试剂的目的
固体,试分析加入该试剂的目的___________ 。能检验溶液X中含有 的试剂是
的试剂是___________ (填字母)。
A.NaOH溶液 B.KSCN溶液 C.酸性 溶液
溶液
(4)过程Ⅱ用 和稀硫酸处理后,
和稀硫酸处理后, 完全溶解生成了
完全溶解生成了 溶液,写出该反应的化学方程式
溶液,写出该反应的化学方程式___________ 。其中 的作用是
的作用是___________ (填“氧化剂”或“还原剂”)。
(5)绿矾的纯度可通过与 溶液反应来测定。取10.00g绿矾样品,加入硫酸溶解,再加入
溶液反应来测定。取10.00g绿矾样品,加入硫酸溶解,再加入 的
的 溶液,当
溶液,当 全部转化为
全部转化为 ,共消耗
,共消耗 溶液
溶液 转化为
转化为 且与杂质不反应),计算样品中绿矾晶体的质量分数为
且与杂质不反应),计算样品中绿矾晶体的质量分数为___________ 。实验室保存 溶液时,为了防止其被氧化,常在试剂瓶中加入的物质是
溶液时,为了防止其被氧化,常在试剂瓶中加入的物质是___________ 。
 】含量较低常采用生物堆浸法。堆浸所得的溶液可用于制备绿矾
】含量较低常采用生物堆浸法。堆浸所得的溶液可用于制备绿矾 和胆矾
和胆矾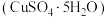 相关流程如图所示。
相关流程如图所示。
(1)低品位黄铜矿研磨的作用是
(2)生物堆浸过程的反应在T.f细菌的作用下进行,主要包括两个阶段,第一阶段的反应为
 ,第二阶段部分
,第二阶段部分 继续和氧气反应转变成
继续和氧气反应转变成 。第一阶段中消耗
。第一阶段中消耗 转移电子
转移电子(3)过程I是在酸性条件下,加入
 固体,试分析加入该试剂的目的
固体,试分析加入该试剂的目的 的试剂是
的试剂是A.NaOH溶液 B.KSCN溶液 C.酸性
 溶液
溶液(4)过程Ⅱ用
 和稀硫酸处理后,
和稀硫酸处理后, 完全溶解生成了
完全溶解生成了 溶液,写出该反应的化学方程式
溶液,写出该反应的化学方程式 的作用是
的作用是(5)绿矾的纯度可通过与
 溶液反应来测定。取10.00g绿矾样品,加入硫酸溶解,再加入
溶液反应来测定。取10.00g绿矾样品,加入硫酸溶解,再加入 的
的 溶液,当
溶液,当 全部转化为
全部转化为 ,共消耗
,共消耗 溶液
溶液 转化为
转化为 且与杂质不反应),计算样品中绿矾晶体的质量分数为
且与杂质不反应),计算样品中绿矾晶体的质量分数为 溶液时,为了防止其被氧化,常在试剂瓶中加入的物质是
溶液时,为了防止其被氧化,常在试剂瓶中加入的物质是
您最近一年使用:0次
名校
9 . 铁是人体不可缺少的微量元素,硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量,并检验该补血剂是否变质,设计实验步骤如下:

(1)步骤①用到的玻璃仪器有___________
(2)步骤②加入氯水的目的是___________ ;若改为H2O2也能达到相同的目的,发生反应的离子方程式为___________ ;反应后所得溶液能溶解铜,写出发生反应的离子方程式___________ 。
(3)步骤④中一系列操作步骤为___________ 、洗涤、灼烧、冷却、称量。
(4)取补血剂药片研细,溶于 的硫酸中,过滤。取滤液加
的硫酸中,过滤。取滤液加___________ (填化学式)溶液,溶液变红说明该补血剂已变质。向变色后的溶液中加入橙汁,溶液红色褪去,再向褪色后的溶液中滴入FeCl3溶液,溶液又变为红色,说明橙汁中含具有___________ (填“氧化”或“还原”)性的物质。
(5)若实验无损耗,则该补血剂含铁元素的质量分数为___________ (用含m、n的式子表示)。

(1)步骤①用到的玻璃仪器有
(2)步骤②加入氯水的目的是
(3)步骤④中一系列操作步骤为
(4)取补血剂药片研细,溶于
 的硫酸中,过滤。取滤液加
的硫酸中,过滤。取滤液加(5)若实验无损耗,则该补血剂含铁元素的质量分数为
您最近一年使用:0次
名校
解题方法
10 . 俄国化学家门捷列夫在研究周期表时预言了“类硅”元素锗Ge和“类铝”元素镓Ga等11种元素。一种提纯二氧化锗粗品(主要含 、
、 )的工艺如下:
)的工艺如下:

已知:① 与碱反应生成
与碱反应生成 ;
; 与碱反应生成
与碱反应生成 ;
;
② 极易发生水解反应生成
极易发生水解反应生成 ;
;
(1)Ge位于同主族Si的下一周期,Ge在周期表中的位置是___________ 。
(2)“氧化”过程是在碱性条件下将 氧化为
氧化为 ,则还原产物是
,则还原产物是___________ (填化学式)
(3)工业上与蒸馏操作相关的设备有___________
(4)高纯二氧化锗的含量常采用碘酸钾( )法进行测定。步骤如下:
)法进行测定。步骤如下:
a.称取一定质量的高纯二氧化锗样品,加入氢氧化钠在电炉溶解,生成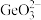
b.加入次亚磷酸钠溶液还原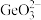 为
为
c.用 的碘酸钾溶液滴入上述b溶液中,并先后发生如下反应:
的碘酸钾溶液滴入上述b溶液中,并先后发生如下反应: ;
; (已知20℃以下,次亚磷酸钠与
(已知20℃以下,次亚磷酸钠与 和
和 均不反应)。
均不反应)。
为准确计算样品中二氧化锗的质量分数,应选用___________ 作指示剂,当出现___________ 的实验现象时可证明 与
与 已完全反应。
已完全反应。
 、
、 )的工艺如下:
)的工艺如下:
已知:①
 与碱反应生成
与碱反应生成 ;
; 与碱反应生成
与碱反应生成 ;
;②
 极易发生水解反应生成
极易发生水解反应生成 ;
;(1)Ge位于同主族Si的下一周期,Ge在周期表中的位置是
(2)“氧化”过程是在碱性条件下将
 氧化为
氧化为 ,则还原产物是
,则还原产物是(3)工业上与蒸馏操作相关的设备有___________
| A.分馏塔 | B.离心萃取机 | C.冷凝塔 | D.加压过滤机 |
 )法进行测定。步骤如下:
)法进行测定。步骤如下:a.称取一定质量的高纯二氧化锗样品,加入氢氧化钠在电炉溶解,生成
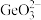
b.加入次亚磷酸钠溶液还原
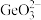 为
为
c.用
 的碘酸钾溶液滴入上述b溶液中,并先后发生如下反应:
的碘酸钾溶液滴入上述b溶液中,并先后发生如下反应: ;
; (已知20℃以下,次亚磷酸钠与
(已知20℃以下,次亚磷酸钠与 和
和 均不反应)。
均不反应)。为准确计算样品中二氧化锗的质量分数,应选用
 与
与 已完全反应。
已完全反应。
您最近一年使用:0次



