1 . Ⅰ.二氧化氯(ClO2)是一种高效消毒剂,易溶于水,沸点为11.0℃,极易爆炸。在干燥空气稀释条件下,用干燥的氯气与固体亚氯酸钠制备二氧化氯,装置如图:
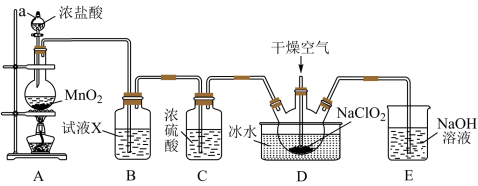
(1)装置A中反应的化学方程式为___________ 。
(2)试剂X是___________ 。
(3)装置D中冰水的主要作用是_______ ,装置D内发生反应的化学方程式为________ 。
(4)工业上对氯气的需求量很大。常利用电解饱和食盐水的方法来制取氯气,该反应的化学方程式为___________ 。
(5)工业上,用双氧水与NaClO3在稀硫酸酸化下反应制备ClO2,则反应的化学方程式为___________ 。
(6)已知NaClO2饱和溶液在不同温度时析出的晶体情况如表。
利用NaClO2溶液制得NaClO2晶体的操作步骤:_______ 、38~60℃的温水洗涤、低于60℃干燥。
Ⅱ.某同学研究84消毒液的漂白性,实验如下。
资料:84消毒液中含氯微粒主要有ClO-、Cl-、HClO:相同浓度时,HClO的氧化性强于ClO-;ORP是反映水溶液中所有物质表现出来的氧化-还原性,ORP值越大,氧化性越强。
①向2mL84消毒液中加入2mL水后,放入红色纸片,观察到纸片慢慢褪色。
②向2mL84消毒液中加入2mL白醋后,放入红色纸片,观察到纸片迅速褪色。
③测得84消毒液在不同温度时ORP随时间的变化曲线如下。
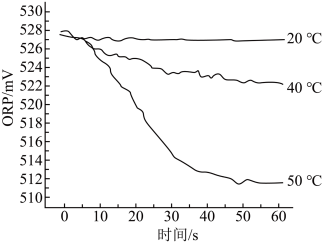
(7)①已知白醋显酸性,不具有漂白性。实验①②现象不同的原因是___________ 。
②实验表明,向84消毒液中加入较多稀盐酸时会产生氯气,生成氯气的方程式是___________ 。
③由实验③可得不同温度下ORP值不同的原因可能是___________ 。
(8)针对不同物品的消毒,84消毒液需要稀释到不同的浓度来使用。取含次氯酸钠14.9g/L的84消毒液1mL,加水稀释至100mL,则稀释后的溶液中次氯酸钠的物质的量浓度为___________ mol/L。

(1)装置A中反应的化学方程式为
(2)试剂X是
(3)装置D中冰水的主要作用是
(4)工业上对氯气的需求量很大。常利用电解饱和食盐水的方法来制取氯气,该反应的化学方程式为
(5)工业上,用双氧水与NaClO3在稀硫酸酸化下反应制备ClO2,则反应的化学方程式为
(6)已知NaClO2饱和溶液在不同温度时析出的晶体情况如表。
| 温度 | <38℃ | 38℃~60℃ | >60℃ |
| 析出晶体 | NaClO2·3H2O | NaClO2 | 分解成NaClO3和NaCl |
Ⅱ.某同学研究84消毒液的漂白性,实验如下。
资料:84消毒液中含氯微粒主要有ClO-、Cl-、HClO:相同浓度时,HClO的氧化性强于ClO-;ORP是反映水溶液中所有物质表现出来的氧化-还原性,ORP值越大,氧化性越强。
①向2mL84消毒液中加入2mL水后,放入红色纸片,观察到纸片慢慢褪色。
②向2mL84消毒液中加入2mL白醋后,放入红色纸片,观察到纸片迅速褪色。
③测得84消毒液在不同温度时ORP随时间的变化曲线如下。

(7)①已知白醋显酸性,不具有漂白性。实验①②现象不同的原因是
②实验表明,向84消毒液中加入较多稀盐酸时会产生氯气,生成氯气的方程式是
③由实验③可得不同温度下ORP值不同的原因可能是
(8)针对不同物品的消毒,84消毒液需要稀释到不同的浓度来使用。取含次氯酸钠14.9g/L的84消毒液1mL,加水稀释至100mL,则稀释后的溶液中次氯酸钠的物质的量浓度为
您最近一年使用:0次
名校
解题方法
2 . 浩瀚的海洋中蕴藏着丰富的资源。从海水中可以提取很多有用的物质。
Ⅰ.提溴工业。用海水晒盐之后的盐卤可提取溴,提取流程如图:
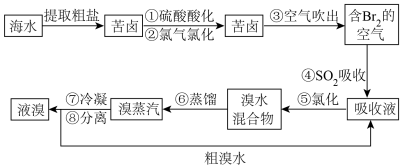
(1)用热空气能将溴单质吹出的原因是___________ 。
(2)写出④发生反应的化学方程式___________ 。
(3)已知某溶液中 、
、 、
、 的物质的量之比为2:3:4,现欲使溶液中的
的物质的量之比为2:3:4,现欲使溶液中的 、
、 、
、 的物质的量之比为变为4:3:2,那么通入
的物质的量之比为变为4:3:2,那么通入 的物质的量是原溶液中
的物质的量是原溶液中 的物质的量的
的物质的量的___________ 。
Ⅱ.提取碘。活性炭吸附法是工业提取碘的方法之一,其流程如下:
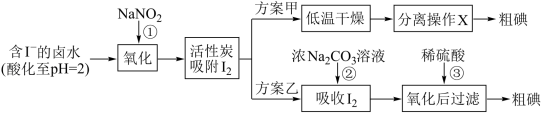
资料显示:
ⅰ.pH=2时, 溶液只能将
溶液只能将 氧化为
氧化为 ,同时生成NO
,同时生成NO
ⅱ.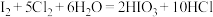 ;氧化性:
;氧化性: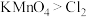
ⅲ.
(4)请列举除蒸馏法外海水淡化的一种方法:___________ 。
(5)写出反应①的离子方程式___________ 。
(6)方案甲中,根据 的特性,分离操作X应为
的特性,分离操作X应为___________ 、冷凝结晶。
(7) 、酸性
、酸性 等都是常用的强氧化剂,但该工艺中氧化卤水中的
等都是常用的强氧化剂,但该工艺中氧化卤水中的 却选择了价格较高的
却选择了价格较高的 ,原因是
,原因是___________ 。
(8)方案乙中,已知反应③过滤后,滤液中仍存在少量的 、
、 。为了检验滤液中的
。为了检验滤液中的 ,某小组同学设计如下实验方案,请将实验步骤补充完整。
,某小组同学设计如下实验方案,请将实验步骤补充完整。
实验中可供选择的试剂:稀 、淀粉溶液、
、淀粉溶液、 溶液、
溶液、 。
。
a.将滤液用 多次萃取、分液,直到水层用淀粉溶液检验不出碘单质存在,
多次萃取、分液,直到水层用淀粉溶液检验不出碘单质存在,
b.从水层取少量溶液于试管中,___________ 。
Ⅰ.提溴工业。用海水晒盐之后的盐卤可提取溴,提取流程如图:

(1)用热空气能将溴单质吹出的原因是
(2)写出④发生反应的化学方程式
(3)已知某溶液中
 、
、 、
、 的物质的量之比为2:3:4,现欲使溶液中的
的物质的量之比为2:3:4,现欲使溶液中的 、
、 、
、 的物质的量之比为变为4:3:2,那么通入
的物质的量之比为变为4:3:2,那么通入 的物质的量是原溶液中
的物质的量是原溶液中 的物质的量的
的物质的量的Ⅱ.提取碘。活性炭吸附法是工业提取碘的方法之一,其流程如下:

资料显示:
ⅰ.pH=2时,
 溶液只能将
溶液只能将 氧化为
氧化为 ,同时生成NO
,同时生成NOⅱ.
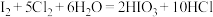 ;氧化性:
;氧化性: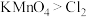
ⅲ.

(4)请列举除蒸馏法外海水淡化的一种方法:
(5)写出反应①的离子方程式
(6)方案甲中,根据
 的特性,分离操作X应为
的特性,分离操作X应为(7)
 、酸性
、酸性 等都是常用的强氧化剂,但该工艺中氧化卤水中的
等都是常用的强氧化剂,但该工艺中氧化卤水中的 却选择了价格较高的
却选择了价格较高的 ,原因是
,原因是(8)方案乙中,已知反应③过滤后,滤液中仍存在少量的
 、
、 。为了检验滤液中的
。为了检验滤液中的 ,某小组同学设计如下实验方案,请将实验步骤补充完整。
,某小组同学设计如下实验方案,请将实验步骤补充完整。实验中可供选择的试剂:稀
 、淀粉溶液、
、淀粉溶液、 溶液、
溶液、 。
。a.将滤液用
 多次萃取、分液,直到水层用淀粉溶液检验不出碘单质存在,
多次萃取、分液,直到水层用淀粉溶液检验不出碘单质存在,b.从水层取少量溶液于试管中,
您最近一年使用:0次
2023-05-25更新
|
361次组卷
|
2卷引用:天津市第一中学2022—2023学年高一下学期第二次月考化学试题
3 . Ⅰ.某工厂的酸性废水中主要含有Fe3+、Cu2+等离子,为了减少污染并变废为宝,工程师们设计了如图流程,回收铜和绿矾(FeSO4·7H2O)。
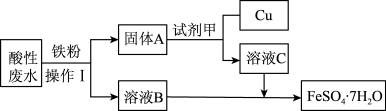
(1)操作1是_______ ;试剂甲是_______ (填化学式)。
(2)获得的FeSO4·7H2O需密闭保存,原因是_______ 。
(3)绿矾可消除某种酸性工业废水中+6价铬( )的污染,使之转化为毒性较小的Cr3+,该反应的离子方程式是
)的污染,使之转化为毒性较小的Cr3+,该反应的离子方程式是_______ 。
(4)黄铜是铜锌合金,是用来制造铜钱的原料,能鉴别黄铜中有金属锌的试剂是_______ (填化学式)。
Ⅱ.某小组为探究Cl2、Br2、I2的氧化性强弱,设计实验如下:
【查阅资料】稀溴水呈黄色;浓溴水呈红棕色;碘水呈棕黄色。
氧化性强弱探究:
【分析与解释】
(5)实验Ⅰ中a试管中反应的离子方程式是_______ 。
(6)通过实验Ⅰ可以得出的结论是_______ 。
(7)①甲同学认为:实验Ⅱ观察到_______ 现象,得出氧化性Br2>I2。
②乙同学对上述实验进行反思,认为实验Ⅱ不能充分证明氧化性Br2>I2,他补做了实验Ⅲ。
补做实验Ⅲ的目的是_______ 。

(1)操作1是
(2)获得的FeSO4·7H2O需密闭保存,原因是
(3)绿矾可消除某种酸性工业废水中+6价铬(
 )的污染,使之转化为毒性较小的Cr3+,该反应的离子方程式是
)的污染,使之转化为毒性较小的Cr3+,该反应的离子方程式是(4)黄铜是铜锌合金,是用来制造铜钱的原料,能鉴别黄铜中有金属锌的试剂是
Ⅱ.某小组为探究Cl2、Br2、I2的氧化性强弱,设计实验如下:
【查阅资料】稀溴水呈黄色;浓溴水呈红棕色;碘水呈棕黄色。
氧化性强弱探究:
| 实验Ⅰ | 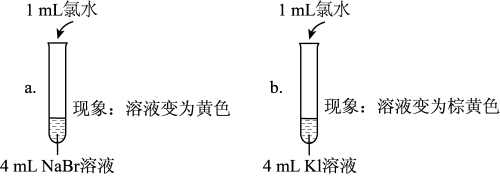 |
| 实验Ⅱ | 取a中的黄色溶液少许,加入KI溶液,再加入淀粉溶液 |
(5)实验Ⅰ中a试管中反应的离子方程式是
(6)通过实验Ⅰ可以得出的结论是
(7)①甲同学认为:实验Ⅱ观察到
②乙同学对上述实验进行反思,认为实验Ⅱ不能充分证明氧化性Br2>I2,他补做了实验Ⅲ。
| 实验Ⅲ | 另取a中的黄色溶液少许,先加入足量的NaBr固体,充分振荡,然后加入KI溶液和淀粉溶液 |
您最近一年使用:0次
2022-04-15更新
|
102次组卷
|
2卷引用:河北省衡水市武强中学2021-2022学年高一上学期第三次月考化学试题
解题方法
4 . 以软锰矿(主要成分是 ,含有
,含有 、FeO、
、FeO、 等少量杂质)为主要原料,制取高纯
等少量杂质)为主要原料,制取高纯 ,流程如图所示。
,流程如图所示。
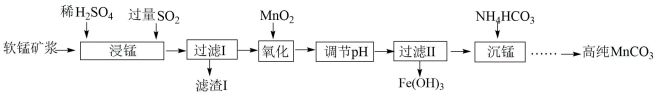
已知: 难溶于水,且不与稀
难溶于水,且不与稀 、
、 反应。
反应。
回答下列问题:
(1)FeO属于___________ (填“酸性”或“碱性”)氧化物,将其在空气中加热能迅速被氧化为___________ 。
(2)“浸锰”步骤中, 与
与 发生反应,在此过程中
发生反应,在此过程中 表现了
表现了___________ (填“氧化性”或“还原性”)。
(3)经“过滤I”后,溶液中所含金属离子为___________ (填离子符号)。
(4)“氧化”步骤中,加入 的作用为
的作用为___________ (用化学方程式表示)。
(5)“沉锰”步骤中,除了生成产品 外,还有气体生成,该反应的离子方程式为
外,还有气体生成,该反应的离子方程式为______ 。
(6)取23.0g所得产品(高纯 )溶于足量的盐酸中,共产生
)溶于足量的盐酸中,共产生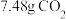 ,计算产品中碳酸锰的质量分数为
,计算产品中碳酸锰的质量分数为___________ %。
 ,含有
,含有 、FeO、
、FeO、 等少量杂质)为主要原料,制取高纯
等少量杂质)为主要原料,制取高纯 ,流程如图所示。
,流程如图所示。
已知:
 难溶于水,且不与稀
难溶于水,且不与稀 、
、 反应。
反应。回答下列问题:
(1)FeO属于
(2)“浸锰”步骤中,
 与
与 发生反应,在此过程中
发生反应,在此过程中 表现了
表现了(3)经“过滤I”后,溶液中所含金属离子为
(4)“氧化”步骤中,加入
 的作用为
的作用为(5)“沉锰”步骤中,除了生成产品
 外,还有气体生成,该反应的离子方程式为
外,还有气体生成,该反应的离子方程式为(6)取23.0g所得产品(高纯
 )溶于足量的盐酸中,共产生
)溶于足量的盐酸中,共产生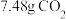 ,计算产品中碳酸锰的质量分数为
,计算产品中碳酸锰的质量分数为
您最近一年使用:0次
2023-12-12更新
|
269次组卷
|
2卷引用:辽宁省部分学校2023-2024学年高一上学期12月月考化学试题
5 . (Ⅰ)已知A为常见的金属单质。B俗称磁性氯化铁。根据如图所示的关系:
B:_______ D:_______ 。
(2)写出③的离子方程式:_______ 。
(3)写出④的化学方程式:_______ 。
(4)写出⑤的化学方程式:_______ 。
(5)写出E→F的现象_______ 。
写出E→F的化学方程式_______ 。
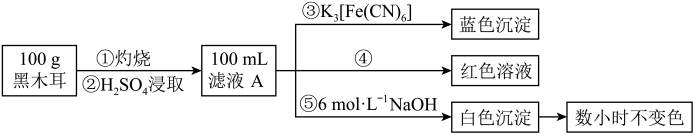
(Ⅱ)某兴趣小组同学为探究黑木耳中的含铁量,进行如下实验。已知:
ⅰ.黑木耳富含蛋白质、糖类、卵磷脂、铁及一些还原性物质等。每100克黑木耳含铁高达185毫克。
ⅱ.紫色的 溶液在酸性条件下有强氧化性,其还原产物是无色的
溶液在酸性条件下有强氧化性,其还原产物是无色的 。
。
ⅲ. 与铁氰化钾(
与铁氰化钾(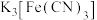 )溶液反应生成蓝色沉淀。
)溶液反应生成蓝色沉淀。
为确定黑木耳中含有铁元素,甲同学设计实验方案如图。_______ 。
(7)步骤④检验 所用试剂是
所用试剂是_______ 溶液。
(8)下列有关上述实验得出的结论正确的是_______ (填字母符号)。
a.黑木耳中一定含 和
和
b.滤液A中一定含 和
和
c.白色沉淀中一定含
为测定黑木耳中铁元素的含量,乙同学设计实验方案如下。
(10)步骤⑦中观察到的实验现象是_______ ,反应的离子方程式是_______ 。

B:
(2)写出③的离子方程式:
(3)写出④的化学方程式:
(4)写出⑤的化学方程式:
(5)写出E→F的现象
写出E→F的化学方程式
(Ⅱ)某兴趣小组同学为探究黑木耳中的含铁量,进行如下实验。已知:
ⅰ.黑木耳富含蛋白质、糖类、卵磷脂、铁及一些还原性物质等。每100克黑木耳含铁高达185毫克。
ⅱ.紫色的
 溶液在酸性条件下有强氧化性,其还原产物是无色的
溶液在酸性条件下有强氧化性,其还原产物是无色的 。
。ⅲ.
 与铁氰化钾(
与铁氰化钾(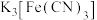 )溶液反应生成蓝色沉淀。
)溶液反应生成蓝色沉淀。为确定黑木耳中含有铁元素,甲同学设计实验方案如图。
(7)步骤④检验
 所用试剂是
所用试剂是(8)下列有关上述实验得出的结论正确的是
a.黑木耳中一定含
 和
和
b.滤液A中一定含
 和
和
c.白色沉淀中一定含

为测定黑木耳中铁元素的含量,乙同学设计实验方案如下。
| A.Na | B.Zn | C.Fe | D.Cu |
(10)步骤⑦中观察到的实验现象是
您最近一年使用:0次
名校
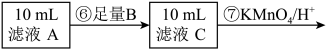
6 . 回答下列问题:
(1)实验室里需要纯净的NaCl溶液,但手边只有混有Na2SO4和NH4HCO3的NaCl,某学生设计了如图所示方案以提取得到纯净的NaCl溶液。(已知:NH4HCO3=NH3↑+CO2↑+H2O)。

a.150℃时,一定量的NH4HCO3完全分解后所得气体的摩尔质量为___________ (保留至小数点后一位)。
b.操作③所得的悬浊液与胶体的本质区别是___________ 。
c.进行操作②后,判断SO 是否已除尽操作是
是否已除尽操作是___________ 。
(2)高锰酸钾在酸性介质中的强氧化性广泛应用于分析化学中配平该反应方程式___________ 。
 KMnO4+
KMnO4+ H2C2O4+
H2C2O4+ H2SO4=
H2SO4= K2SO4+
K2SO4+ MnSO4+
MnSO4+ CO2↑+
CO2↑+ H2O(未配平)。
H2O(未配平)。
(3)用电弧法合成碳纳米管,常伴有大量杂质碳纳米颗粒,实验室中通常采用氧化气化法提纯,其化学反应方程式为:2K2Cr2O7+3C+8H2SO4=2Cr2(SO4)3+2K2SO4+8H2O+3CO2↑。
①用双线桥法表示出电子的转移情况___________ 。
2K2Cr2O7+3C+8H2SO4=2Cr2(SO4)3+2K2SO4+8H2O+3CO2↑
②此反应的氧化产物和还原产物的物质的量之比为___________ 。
③要使10mL1.0mol•L-1K2Cr2O7溶液全部被还原,则至少要加入___________ mL2.0mol•L-1的H2SO4溶液,消耗C的质量为___________ g。
④若产生6.72CO2(标准状况下)气体,该反应转移的电子的物质的量为___________ 。
⑤H2SO4在上述反应中表现出来的性质是___________ (填字母)。
A.酸性 B.氧化性 C.还原性 D.吸水性
(1)实验室里需要纯净的NaCl溶液,但手边只有混有Na2SO4和NH4HCO3的NaCl,某学生设计了如图所示方案以提取得到纯净的NaCl溶液。(已知:NH4HCO3=NH3↑+CO2↑+H2O)。

a.150℃时,一定量的NH4HCO3完全分解后所得气体的摩尔质量为
b.操作③所得的悬浊液与胶体的本质区别是
c.进行操作②后,判断SO
 是否已除尽操作是
是否已除尽操作是(2)高锰酸钾在酸性介质中的强氧化性广泛应用于分析化学中配平该反应方程式
 KMnO4+
KMnO4+ H2C2O4+
H2C2O4+ H2SO4=
H2SO4= K2SO4+
K2SO4+ MnSO4+
MnSO4+ CO2↑+
CO2↑+ H2O(未配平)。
H2O(未配平)。(3)用电弧法合成碳纳米管,常伴有大量杂质碳纳米颗粒,实验室中通常采用氧化气化法提纯,其化学反应方程式为:2K2Cr2O7+3C+8H2SO4=2Cr2(SO4)3+2K2SO4+8H2O+3CO2↑。
①用双线桥法表示出电子的转移情况
2K2Cr2O7+3C+8H2SO4=2Cr2(SO4)3+2K2SO4+8H2O+3CO2↑
②此反应的氧化产物和还原产物的物质的量之比为
③要使10mL1.0mol•L-1K2Cr2O7溶液全部被还原,则至少要加入
④若产生6.72CO2(标准状况下)气体,该反应转移的电子的物质的量为
⑤H2SO4在上述反应中表现出来的性质是
A.酸性 B.氧化性 C.还原性 D.吸水性
您最近一年使用:0次
解题方法
7 . 海水是巨大的资源宝库,从海水中提取食盐和溴的过程如图所示:

(1)写出工业上由食盐制备
 的离子方程式:
的离子方程式:(2)步骤Ⅰ中已获得
 ,步骤Ⅱ中又将
,步骤Ⅱ中又将 转化为
转化为 和
和 ,其目的是
,其目的是(3)步骤Ⅱ中通入热空气吹出
 ,利用了
,利用了 的___________(填标号)。
的___________(填标号)。| A.氧化性 | B.还原性 | C.挥发性 | D.腐蚀性 |
(4)步骤Ⅱ中用纯碱溶液吸收
 ,该反应的化学方程式为
,该反应的化学方程式为(5)从理论上考虑,下列物质也能吸收
 的是___________(填标号)。
的是___________(填标号)。A. | B.NaCl溶液 | C. 溶液 溶液 | D. 溶液 溶液 |
(6)查阅资料知,
 的沸点为58.8 ℃,微溶于水,有毒性和强腐蚀性。步骤Ⅲ中对蒸馏烧瓶采取的加热方式是
的沸点为58.8 ℃,微溶于水,有毒性和强腐蚀性。步骤Ⅲ中对蒸馏烧瓶采取的加热方式是
您最近一年使用:0次
名校
解题方法
8 . Ⅰ:实验室可用KMnO4和浓盐酸反应制取氯气。其变化可表述为:
2KMnO4+16HCl(浓) =2KCl+2MnCl2+5Cl2↑+8H2O
(1)请将上述化学方程式改写为离子方程式__________________________ ;
(2)浓盐酸在反应中显示出来的性质是____________ (填写编号);
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(3)此反应中氧化产物是___________ (填化学式),产生0.5 mol Cl2,则转移的电子的物质的量为___________ mol。
(4)用双线桥法表示该反应的电子转移的方向和数目_____________
2KMnO4+16HCl(浓) =2KCl+2MnCl2+5Cl2↑+8H2O
Ⅱ:某废液中含有大量的K+、Cl-、Br-,还有少量的Ca2+、Mg2+、SO42-。某研究性学习小组利用这种废液来制取较纯净的氯化钾晶体及液溴(Br2常温下是深红棕色液体),设计了如下流程图:

已知:可供选择的试剂 a、试剂b(试剂 b代表一组试剂)如下:饱和Na2CO3溶液、饱和K2CO3溶液、KOH溶液、BaCl2溶液、Ba(NO3)2溶液、H2O2溶液(H+)、KMnO4溶液(H+)、稀盐酸。请根据流程图,回答相关问题:
(5)若试剂a为H2O2溶液(H+),已知H2O2+2KBr+2HCl=Br2+2H2O+2KCl
①发生反应的离子方程式为:__________ ;
②每消耗0.2molH2O2,反应转移的电子数为______ mol;
③还原剂和还原产物的物质的量之比是_______ ;
(6)操作①②③④⑤对应的名称分别是:______ 、分液、_____ 、过滤、______ ;
(7)为了除去无色液体I中的Ca2+、Mg2+、SO42-,从可供选择的试剂中选出试剂b所代表的物质,按滴加顺序依次是____ 、____ 、____ (填化学式);
(8)调pH=7(中性)是为了除去杂质离子________ 和_________ ,以提高氯化钾晶体的纯度。
2KMnO4+16HCl(浓) =2KCl+2MnCl2+5Cl2↑+8H2O
(1)请将上述化学方程式改写为离子方程式
(2)浓盐酸在反应中显示出来的性质是
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(3)此反应中氧化产物是
(4)用双线桥法表示该反应的电子转移的方向和数目
2KMnO4+16HCl(浓) =2KCl+2MnCl2+5Cl2↑+8H2O
Ⅱ:某废液中含有大量的K+、Cl-、Br-,还有少量的Ca2+、Mg2+、SO42-。某研究性学习小组利用这种废液来制取较纯净的氯化钾晶体及液溴(Br2常温下是深红棕色液体),设计了如下流程图:

已知:可供选择的试剂 a、试剂b(试剂 b代表一组试剂)如下:饱和Na2CO3溶液、饱和K2CO3溶液、KOH溶液、BaCl2溶液、Ba(NO3)2溶液、H2O2溶液(H+)、KMnO4溶液(H+)、稀盐酸。请根据流程图,回答相关问题:
(5)若试剂a为H2O2溶液(H+),已知H2O2+2KBr+2HCl=Br2+2H2O+2KCl
①发生反应的离子方程式为:
②每消耗0.2molH2O2,反应转移的电子数为
③还原剂和还原产物的物质的量之比是
(6)操作①②③④⑤对应的名称分别是:
(7)为了除去无色液体I中的Ca2+、Mg2+、SO42-,从可供选择的试剂中选出试剂b所代表的物质,按滴加顺序依次是
(8)调pH=7(中性)是为了除去杂质离子
您最近一年使用:0次
名校
解题方法
9 . 生产芯片的半导体材料有硅、锗、砷化镓等,应用比较广泛的是硅。硅可由石英砂(主要成分是二氧化硅)制得,制备高纯硅的主要工艺流程如图所示:

资料:① 能与
能与 剧烈反应,在空气中易自燃;②粗
剧烈反应,在空气中易自燃;②粗 (沸点33.0℃)中含有少量
(沸点33.0℃)中含有少量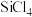 (沸点57.6℃)和
(沸点57.6℃)和 (沸点
(沸点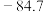 ℃)
℃)
(1)流程①焦炭体现了_______ (填“氧化性”或“还原性”)。
(2)流程③提纯 的方法是
的方法是_______ 。
(3)流程④的化学反应为置换反应,写出其化学方程式:_______ 。
流程④制备高纯硅的装置如图(热源及夹持装置略去):
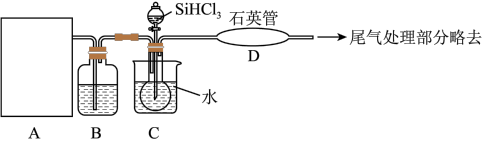
(4)若要从下列玻璃仪器中选择部分来组装A处的气体发生装置,需要的是_______ (填编号):
a.分液漏斗 b.烧瓶 c.酒精灯 d.大试管 e.漏斗 f.烧杯 g.导管
(5)装置C中的烧瓶需要加热,其目的是_______ 。
(6)为保证制备高纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及_______ ,该流程中能够循环利用的物质是_______ 。

资料:①
 能与
能与 剧烈反应,在空气中易自燃;②粗
剧烈反应,在空气中易自燃;②粗 (沸点33.0℃)中含有少量
(沸点33.0℃)中含有少量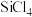 (沸点57.6℃)和
(沸点57.6℃)和 (沸点
(沸点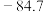 ℃)
℃)(1)流程①焦炭体现了
(2)流程③提纯
 的方法是
的方法是(3)流程④的化学反应为置换反应,写出其化学方程式:
流程④制备高纯硅的装置如图(热源及夹持装置略去):

(4)若要从下列玻璃仪器中选择部分来组装A处的气体发生装置,需要的是
a.分液漏斗 b.烧瓶 c.酒精灯 d.大试管 e.漏斗 f.烧杯 g.导管
(5)装置C中的烧瓶需要加热,其目的是
(6)为保证制备高纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及
您最近一年使用:0次
2023-04-20更新
|
185次组卷
|
2卷引用:辽宁省沈阳市第九中学2022-2023学年高一下学期第一次月考化学试题
10 . 在工业上可用含SiO2、CeO2和Fe2O3的废料作原料来获得硫酸铁铵晶体【Fe2(SO4)3·2(NH4)2 SO4·3H2O】,同时可回收CeO2,工艺流程设计如下

已知: ①SiO2、CeO2不溶于稀硫酸;②酸性条件下,CeO2可与H2O2反应;③“反应Ⅰ”所得溶液中含有Ce3+;④碱性条件下,NH4+与OH-结合生成NH3·H2O。
请回答下列问题
(1)“酸浸”时未发生的反应 物质是__________________ (填化学式)。
(2)“滤液”中含有的阳离子有___________________ (填离子符号)。
(3)写出“反应Ⅰ”的化学方程式:________________________________________ 。
(4)在酸性条件下,H2O2、CeO2两种物质中,氧化性较弱的是__________________ (填化学式)。
(5)若往硫酸铁铵溶液中加入过量的NaOH,写出该反应的离子方程式:_____________________ 。

已知: ①SiO2、CeO2不溶于稀硫酸;②酸性条件下,CeO2可与H2O2反应;③“反应Ⅰ”所得溶液中含有Ce3+;④碱性条件下,NH4+与OH-结合生成NH3·H2O。
请回答下列问题
(1)“酸浸”时未发生的反应 物质是
(2)“滤液”中含有的阳离子有
(3)写出“反应Ⅰ”的化学方程式:
(4)在酸性条件下,H2O2、CeO2两种物质中,氧化性较弱的是
(5)若往硫酸铁铵溶液中加入过量的NaOH,写出该反应的离子方程式:
您最近一年使用:0次
2020-01-01更新
|
135次组卷
|
2卷引用:河南省创新发展联盟2019-2020学年高一上学期第三次联考化学试题



