名校
1 . 为落实“五水共治”,某工厂拟综合处理含 废水和工业废气(主要含
废水和工业废气(主要含 、
、 、
、 、NO、CO,不考虑其他成分),设计如图流程:
、NO、CO,不考虑其他成分),设计如图流程:

已知: 的氧化性弱于
的氧化性弱于
回答下列问题:
(1)气体1中的有毒气体可通过催化剂直接转化为无污染气体,反应的化学方程式为_______ 。
(2)气体2中捕获剂所捕获的气体主要是_______ 。
(3)若X是 ,上述反应中NO和
,上述反应中NO和 的物质的量之比最好为
的物质的量之比最好为_______ ,才能恰好转化为 溶液;若通入
溶液;若通入 过量,导致的结果会是
过量,导致的结果会是_______ 。
(4)检验废水中含 的方法是
的方法是_______ ,流程中处理含废水时 反应的离子方程式为
反应的离子方程式为_______ 。
 废水和工业废气(主要含
废水和工业废气(主要含 、
、 、
、 、NO、CO,不考虑其他成分),设计如图流程:
、NO、CO,不考虑其他成分),设计如图流程:
已知:
 的氧化性弱于
的氧化性弱于
回答下列问题:
(1)气体1中的有毒气体可通过催化剂直接转化为无污染气体,反应的化学方程式为
(2)气体2中捕获剂所捕获的气体主要是
(3)若X是
 ,上述反应中NO和
,上述反应中NO和 的物质的量之比最好为
的物质的量之比最好为 溶液;若通入
溶液;若通入 过量,导致的结果会是
过量,导致的结果会是(4)检验废水中含
 的方法是
的方法是 反应的离子方程式为
反应的离子方程式为
您最近一年使用:0次
2 . 硅是无机非金属材料的主角,硅的氧化物和硅酸盐约占地壳质量的90%以上。
(1)埋在地下的光导纤维如果裸露在碱性土壤中,会导致断路,用离子方程式说明原因___________ ;工艺师常用___________ (填物质名称)来雕刻玻璃。
(2)工业上常利用反应 制备硅单质,该反应能否说明
制备硅单质,该反应能否说明 的氧化性强于
的氧化性强于 ?
?___________ (说明理由)。
(3)有一 、
、 的混合固体,欲从中分离出
的混合固体,欲从中分离出 ,应如何操作?
,应如何操作?___________
(1)埋在地下的光导纤维如果裸露在碱性土壤中,会导致断路,用离子方程式说明原因
(2)工业上常利用反应
 制备硅单质,该反应能否说明
制备硅单质,该反应能否说明 的氧化性强于
的氧化性强于 ?
?(3)有一
 、
、 的混合固体,欲从中分离出
的混合固体,欲从中分离出 ,应如何操作?
,应如何操作?
您最近一年使用:0次
名校
解题方法
3 . 海水是人类宝贵的自然资源,从海水中可以提取多种化工原料。部分流程如图:
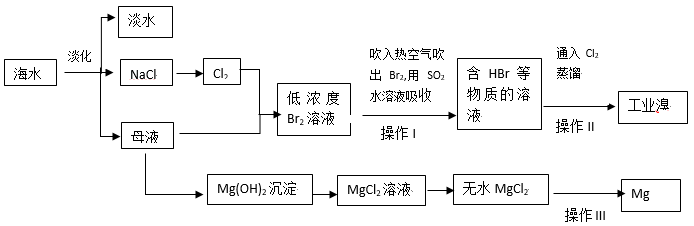
请回答下列问题:
(1)请写出海水淡化的两种方法:______ 、______ 。
(2)通入热空气吹出Br2,利用了Br2的______ (填序号)。
a.氧化性 b.还原性c.挥发性
(3)操作Ⅰ用SO2水溶液吸收Br2有关反应的离子方程式为______ 。
(4)写出操作Ⅱ通氯气后发生的离子方程式______ 。
(5)为使母液中的MgCl2转化为Mg(OH)2,从原料来源及经济效益角度考虑,试剂①最好选用______ 。
a.氨水 b.氢氧化钙c.氢氧化钠
(6)操作Ⅲ的化学方程式为______ 。

请回答下列问题:
(1)请写出海水淡化的两种方法:
(2)通入热空气吹出Br2,利用了Br2的
a.氧化性 b.还原性c.挥发性
(3)操作Ⅰ用SO2水溶液吸收Br2有关反应的离子方程式为
(4)写出操作Ⅱ通氯气后发生的离子方程式
(5)为使母液中的MgCl2转化为Mg(OH)2,从原料来源及经济效益角度考虑,试剂①最好选用
a.氨水 b.氢氧化钙c.氢氧化钠
(6)操作Ⅲ的化学方程式为
您最近一年使用:0次
2020-08-14更新
|
162次组卷
|
2卷引用:山东省济宁市2019-2020学年高一下学期期末考试化学试题
名校
4 . 为落实“五水共治”,某工厂拟综合处理含 废水和工业废气(主要含
废水和工业废气(主要含 、
、 、
、 、NO、CO,不考虑其他成分),设计如图流程:
、NO、CO,不考虑其他成分),设计如图流程: 的氧化性弱于
的氧化性弱于
回答下列问题:
(1)上述工业废气中可能造成环境污染的气体有___________ (至少写两种),固体1含有的物质是___________ 、 ;气体2中捕获剂所捕获的气体主要是
;气体2中捕获剂所捕获的气体主要是___________ 。
(2)若X是空气,则上述反应中NO和 的物质的量之比最好为
的物质的量之比最好为___________ ,才能恰好转化为 溶液;若通入空气过量,导致的结果会是
溶液;若通入空气过量,导致的结果会是___________ 。
(3)检验废水中含 的方法是
的方法是___________ ,流程中处理含 废水时反应的离子方程式为
废水时反应的离子方程式为___________ 。
(4)气体1中的有毒气体还可通过催化剂直接转化为无污染气体,反应的化学方程式为___________ 。
 废水和工业废气(主要含
废水和工业废气(主要含 、
、 、
、 、NO、CO,不考虑其他成分),设计如图流程:
、NO、CO,不考虑其他成分),设计如图流程: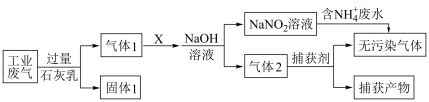
 的氧化性弱于
的氧化性弱于
回答下列问题:
(1)上述工业废气中可能造成环境污染的气体有
 ;气体2中捕获剂所捕获的气体主要是
;气体2中捕获剂所捕获的气体主要是(2)若X是空气,则上述反应中NO和
 的物质的量之比最好为
的物质的量之比最好为 溶液;若通入空气过量,导致的结果会是
溶液;若通入空气过量,导致的结果会是(3)检验废水中含
 的方法是
的方法是 废水时反应的离子方程式为
废水时反应的离子方程式为(4)气体1中的有毒气体还可通过催化剂直接转化为无污染气体,反应的化学方程式为
您最近一年使用:0次
2023-03-18更新
|
184次组卷
|
2卷引用:河南省开封市5县2022-2023学年高一下学期3月联考化学试题
名校
解题方法
5 . 已知海水中的溴含量约为 65 mg·L-1,从海水中提取溴的工业流程如下:
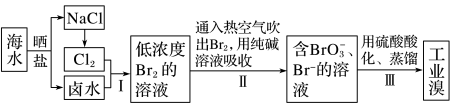
(1)步骤Ⅱ通入热空气吹出 Br2,利用了溴的_______ (填序号)。
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(2)步骤Ⅱ中涉及的离子反应如下,请在横线上填入正确的化学计量数:
___ Br2 +___  =
=___  +
+ ___ Br- +___ CO2↑
(3)上述流程中吹出的溴蒸气也可以先用二氧化硫的水溶液吸收,再用氯气氧化,然后 进行蒸馏,则溴与二氧化硫的水溶液反应的离子方程式为________________________ 。
(4)实验室分离溴还可以用萃取法,下列可以用作溴的萃取剂的有________________ (填字母)。
A.乙醇 B.四氯化碳 C.醋酸 D.苯

(1)步骤Ⅱ通入热空气吹出 Br2,利用了溴的
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(2)步骤Ⅱ中涉及的离子反应如下,请在横线上填入正确的化学计量数:
 =
= +
+ (3)上述流程中吹出的溴蒸气也可以先用二氧化硫的水溶液吸收,再用氯气氧化,然后 进行蒸馏,则溴与二氧化硫的水溶液反应的离子方程式为
(4)实验室分离溴还可以用萃取法,下列可以用作溴的萃取剂的有
A.乙醇 B.四氯化碳 C.醋酸 D.苯
您最近一年使用:0次
名校
解题方法
6 . 铁是人类较早使用的金属之一、运用铁及其化合物的知识,完成下列问题。
I.(1)取一定量氯化亚铁固体,配制成0.1 mol/L 的溶液。检验溶液是否被氧化的方法:_______ 。
II.工业上用赤铁矿(含Fe2O3、FeO,也含有Al2O3、MnO2、CuO等)制备绿矾FeSO4·7H2O的流程如下:
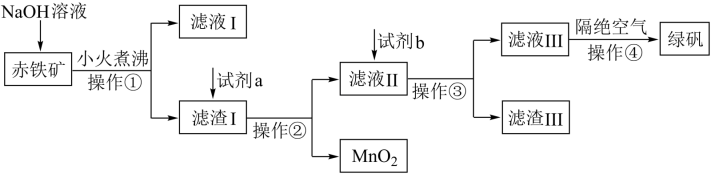
(2)氢氧化钠溶液加入赤铁矿中发生反应的离子方程式为_______ 。
(3)向滤渣I中加入过量的试剂a为_______ ,试剂b要加入过量,试剂b为_______ 。
(4)操作④隔绝空气的目的是_______ 。
Ⅲ.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(5)干法制备高铁酸钠的主要反应为:2FeSO4 + 6 Na2O2 = 2Na2FeO4 + 2Na2O + 2Na2SO4 + O2↑,该反应中Na2O2是_______ (填氧化剂、还原剂),与CO2反应的化学反应方程式_______ 。
(6)湿法制备高铁酸钾的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、 、Cl-、H2O。
、Cl-、H2O。
①碱性条件下,氧化剂和还原剂的物质的量的比为3:2发生反应,写出并配平湿法制高铁酸钾的离子反应方程式:_______ 。
②若反应过程中转移了0.3mol电子,则还原产物的物质的量为_______ mol。
I.(1)取一定量氯化亚铁固体,配制成0.1 mol/L 的溶液。检验溶液是否被氧化的方法:
II.工业上用赤铁矿(含Fe2O3、FeO,也含有Al2O3、MnO2、CuO等)制备绿矾FeSO4·7H2O的流程如下:

(2)氢氧化钠溶液加入赤铁矿中发生反应的离子方程式为
(3)向滤渣I中加入过量的试剂a为
(4)操作④隔绝空气的目的是
Ⅲ.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(5)干法制备高铁酸钠的主要反应为:2FeSO4 + 6 Na2O2 = 2Na2FeO4 + 2Na2O + 2Na2SO4 + O2↑,该反应中Na2O2是
(6)湿法制备高铁酸钾的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、
 、Cl-、H2O。
、Cl-、H2O。①碱性条件下,氧化剂和还原剂的物质的量的比为3:2发生反应,写出并配平湿法制高铁酸钾的离子反应方程式:
②若反应过程中转移了0.3mol电子,则还原产物的物质的量为
您最近一年使用:0次
2021-03-10更新
|
288次组卷
|
2卷引用:湖北武汉市蔡甸区汉阳一中2020-2021学年高一下学期起点考试化学试题
名校
7 . 海水中溴含量约为67mg•L-1,从海水中提取溴的一种工艺流程如图:

(1)步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将之转化为化合态的溴,其目的是___ 。
(2)步骤Ⅱ中通入热空气吹出Br2,利用了Br2的___ (填序号)。
A.氧化性 B.还原性
C.挥发性 D.腐蚀性
(3)步骤Ⅱ中涉及的离子反应如下,请在横线上填上适当的化学计量数:___ Br2+___ CO32-——___ BrO3-+___ Br-+___ CO2。
(4)上述流程中吹出的溴蒸汽也可先用二氧化硫的水溶液吸收,再用氯气氧化,最后蒸馏,写出Br2与SO2水溶液反应的化学方程式:___ 。

(1)步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将之转化为化合态的溴,其目的是
(2)步骤Ⅱ中通入热空气吹出Br2,利用了Br2的
A.氧化性 B.还原性
C.挥发性 D.腐蚀性
(3)步骤Ⅱ中涉及的离子反应如下,请在横线上填上适当的化学计量数:
(4)上述流程中吹出的溴蒸汽也可先用二氧化硫的水溶液吸收,再用氯气氧化,最后蒸馏,写出Br2与SO2水溶液反应的化学方程式:
您最近一年使用:0次
2020-04-19更新
|
320次组卷
|
2卷引用:鲁科版(2019)必修第二册第1章 本章自我评价
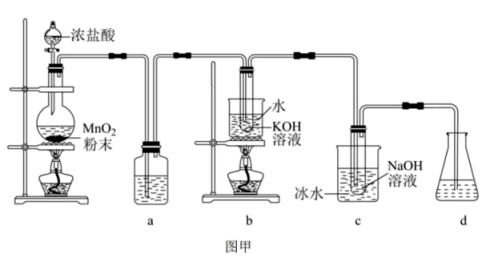
名校
8 . 氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用如图甲装置(部分装置省略)制备 和
和 ,探究其氧化还原性质。
,探究其氧化还原性质。
回答下列问题:
(1)盛放 粉末的仪器名称是
粉末的仪器名称是_______ ,a中的试剂为_______ 。
(2)写出 的电子式
的电子式_______ 。
(3)d的作用是_______ ,可选用试剂_______ (填标号)。
A. 溶液 B.
溶液 B. 溶液 C.
溶液 C. 溶液 D.稀
溶液 D.稀
(4)反应结束后,取出b中试管,经冷却结晶,_______ ,洗涤,干燥,得到 晶体。
晶体。
(5)一位同学设计了一套用浓盐酸和高锰酸钾固体制取少量氯气并能比较氯气与碘单质氧化性强弱的微型装置,如图乙所示。能说明氯气的氧化性强于碘单质的实验现象是_______ 。

 和
和 ,探究其氧化还原性质。
,探究其氧化还原性质。
回答下列问题:
(1)盛放
 粉末的仪器名称是
粉末的仪器名称是(2)写出
 的电子式
的电子式(3)d的作用是
A.
 溶液 B.
溶液 B. 溶液 C.
溶液 C. 溶液 D.稀
溶液 D.稀
(4)反应结束后,取出b中试管,经冷却结晶,
 晶体。
晶体。(5)一位同学设计了一套用浓盐酸和高锰酸钾固体制取少量氯气并能比较氯气与碘单质氧化性强弱的微型装置,如图乙所示。能说明氯气的氧化性强于碘单质的实验现象是

您最近一年使用:0次
2023-01-09更新
|
85次组卷
|
2卷引用:吉林省长春市农安县第十中学2022-2023学年高一上学期期末质量监测化学试题
名校
解题方法
9 . 研究光盘金属层含有的Ag(其它金属微量忽略不计)、丢弃电池中的Ag2O等废旧资源的回收利用意义重大。如图为从光盘中提取Ag的工业流程。请回答下列问题。

(1)NaClO溶液在受热或酸性条件下易分解,“氧化”阶段需在80℃条件下进行,适宜的加热方式为_____ (填“水浴”、“沙浴”或“油浴”)。
(2)NaClO溶液与Ag反应的产物为AgCl、NaOH和O2,该反应的化学方程式为:_____ 。
(3)操作I用到的玻璃仪器:_____ 。
(4)常温时N2H4•H2O在碱性条件下能还原溶解液中的 离子,N2H4•H2O(其中N为-2价)转化为无害气体N2,理论上消耗0.1mol的N2H4•H2O可提取到
离子,N2H4•H2O(其中N为-2价)转化为无害气体N2,理论上消耗0.1mol的N2H4•H2O可提取到_____ g金属银。
(5)科学家利用HCHO+2Ag2O=4Ag+CO2+H2O设计为原电池,回收废旧电池中Ag2O并有效去除毒气甲醛。请根据上述反应写出负极反应式_____ 。

(1)NaClO溶液在受热或酸性条件下易分解,“氧化”阶段需在80℃条件下进行,适宜的加热方式为
(2)NaClO溶液与Ag反应的产物为AgCl、NaOH和O2,该反应的化学方程式为:
(3)操作I用到的玻璃仪器:
(4)常温时N2H4•H2O在碱性条件下能还原溶解液中的
 离子,N2H4•H2O(其中N为-2价)转化为无害气体N2,理论上消耗0.1mol的N2H4•H2O可提取到
离子,N2H4•H2O(其中N为-2价)转化为无害气体N2,理论上消耗0.1mol的N2H4•H2O可提取到(5)科学家利用HCHO+2Ag2O=4Ag+CO2+H2O设计为原电池,回收废旧电池中Ag2O并有效去除毒气甲醛。请根据上述反应写出负极反应式
您最近一年使用:0次
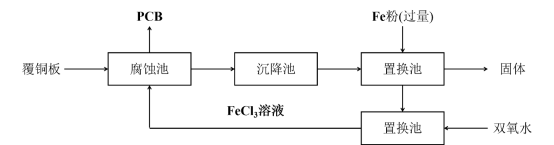
10 . 铁是人类较早使用的金属之一、运用铁及其化合物的知识,完成下列问题。
Ⅰ.印刷电路板(PCB)是用腐蚀液( 溶液)将覆铜板上的部分铜腐蚀掉而制得。一种制作PCB并将腐蚀后废液(其中金属阳离子主要含
溶液)将覆铜板上的部分铜腐蚀掉而制得。一种制作PCB并将腐蚀后废液(其中金属阳离子主要含 、
、 、
、 )回收再生的流程如下。
)回收再生的流程如下。
请回答:
(1)腐蚀池中发生反应的化学方程式是______ 。
(2)上述各池中,没有发生化学变化的是______ 池
(3)由置换池中得到固体的操作名称是______ 。
(4)向再生池中通入 也可以使废液再生,相比
也可以使废液再生,相比 ,用双氧水的优点是
,用双氧水的优点是______ 。
(5)若取少量循环使用的氯化铁溶液于烧杯中,同时加入铁粉和铜粉。反应结束后,下列结果不可能出现的是______ (填写编号)
A.有铜无铁 B.有铁无铜 C.铁、铜都有 D.铁、铜都无
Ⅱ.高铁酸钾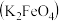 是一种新型、高效、多功能绿色水处理剂,比
是一种新型、高效、多功能绿色水处理剂,比 、
、 、
、 、
、 氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(6)干法制备高铁酸钠的主要反应为: , 该反应中
, 该反应中 是
是______ (填“氧化剂”、“还原剂”)。
(7)湿法制备高铁酸钾的反应体系中有六种微粒: 、
、 、
、 、
、 、
、 、
、 。
。
①碱性条件下,氧化剂和还原剂的物质的量的比为 发生反应,写出并配平湿法制高铁酸钾的离子反应方程式:
发生反应,写出并配平湿法制高铁酸钾的离子反应方程式:______ 。
②若反应过程中转移了0.3mol电子,则还原产物的物质的量为______ mol。
Ⅰ.印刷电路板(PCB)是用腐蚀液(
 溶液)将覆铜板上的部分铜腐蚀掉而制得。一种制作PCB并将腐蚀后废液(其中金属阳离子主要含
溶液)将覆铜板上的部分铜腐蚀掉而制得。一种制作PCB并将腐蚀后废液(其中金属阳离子主要含 、
、 、
、 )回收再生的流程如下。
)回收再生的流程如下。
请回答:
(1)腐蚀池中发生反应的化学方程式是
(2)上述各池中,没有发生化学变化的是
(3)由置换池中得到固体的操作名称是
(4)向再生池中通入
 也可以使废液再生,相比
也可以使废液再生,相比 ,用双氧水的优点是
,用双氧水的优点是(5)若取少量循环使用的氯化铁溶液于烧杯中,同时加入铁粉和铜粉。反应结束后,下列结果不可能出现的是
A.有铜无铁 B.有铁无铜 C.铁、铜都有 D.铁、铜都无
Ⅱ.高铁酸钾
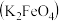 是一种新型、高效、多功能绿色水处理剂,比
是一种新型、高效、多功能绿色水处理剂,比 、
、 、
、 、
、 氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。(6)干法制备高铁酸钠的主要反应为:
 , 该反应中
, 该反应中 是
是(7)湿法制备高铁酸钾的反应体系中有六种微粒:
 、
、 、
、 、
、 、
、 、
、 。
。①碱性条件下,氧化剂和还原剂的物质的量的比为
 发生反应,写出并配平湿法制高铁酸钾的离子反应方程式:
发生反应,写出并配平湿法制高铁酸钾的离子反应方程式:②若反应过程中转移了0.3mol电子,则还原产物的物质的量为
您最近一年使用:0次



