名校
1 . 某化学兴趣小组利用废铁屑(含少量 )制备还原性铁粉,从而达到资源回收利用的目的,制备流程如图所示。
)制备还原性铁粉,从而达到资源回收利用的目的,制备流程如图所示。

请回答下列问题:
(1)“酸溶”时,搅拌的目的是_______ 。
(2)“操作Y”为_______ (填操作名称),经过“操作Y”得到了滤渣 ,则物质X可用于除去过量的稀硫酸和防止
,则物质X可用于除去过量的稀硫酸和防止 被氧化,可选择
被氧化,可选择_______ (填试剂名称),“转化2”发生反应的离子方程式为_______ 。
(3)“洗涤”时,能证明滤渣洗涤干净的操作及现象为_______ 。
(4)麦片中常添加微量还原性铁粉,用于补充入体所需的铁元素,这些铁粉在胃酸(主要成分为盐酸)的作用下发生反应变成人体容易吸收的铁元素,发生反应的化学方程式为_______ ;人体补铁时,同时服用维生素C能促进亚铁离子被吸收,说明维生素C具有_______ (填“氧化性”或“还原性”)。
 )制备还原性铁粉,从而达到资源回收利用的目的,制备流程如图所示。
)制备还原性铁粉,从而达到资源回收利用的目的,制备流程如图所示。
请回答下列问题:
(1)“酸溶”时,搅拌的目的是
(2)“操作Y”为
 ,则物质X可用于除去过量的稀硫酸和防止
,则物质X可用于除去过量的稀硫酸和防止 被氧化,可选择
被氧化,可选择(3)“洗涤”时,能证明滤渣洗涤干净的操作及现象为
(4)麦片中常添加微量还原性铁粉,用于补充入体所需的铁元素,这些铁粉在胃酸(主要成分为盐酸)的作用下发生反应变成人体容易吸收的铁元素,发生反应的化学方程式为
您最近一年使用:0次
2022-12-07更新
|
235次组卷
|
4卷引用:四川省成都市四校2022-2023学年高一上学期12月联考化学试题
四川省成都市四校2022-2023学年高一上学期12月联考化学试题四川省眉山市彭山区第一中学2022-2023学年高一上学期第二次模拟选科调考化学试题云南省楚雄彝族自治州2022-2023学年高一上学期期末教育学业质量监测化学试题(已下线)第13讲 铁和铁的氧化物-【暑假自学课】2023年新高一化学暑假精品课(人教版2019必修第一册)
名校
解题方法
2 . 铜和三氧化二铁在工农业生产中用途广泛,用黄铜矿(主要成分为CuFeS2,其中Cu为+2价、Fe为+2价)制取铜和三氧化二铁的工艺流程如图所示
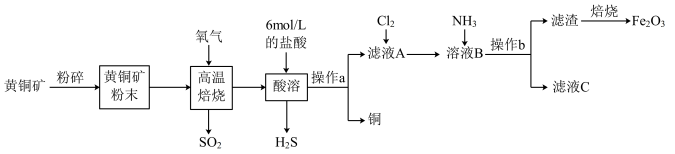
已知:FeS+2HCl=FeCl2+H2S↑、2Fe(OH)3 Fe2O3+3H2O
Fe2O3+3H2O
(1)高温焙烧时发生的反应是CuFeS2+O2 SO2+FeS+Cu,该反应中,氧化剂是
SO2+FeS+Cu,该反应中,氧化剂是_______ ;0.5molO2参加反应时,反应中转移电子_______ mol。
(2)Cl2具有较强的氧化性,Fe2+具有较强的还原性,写出向滤液A中通入氯气的离子方程式_______ 。
(3)向溶液B中通入NH3后发生反应的离子方程式为_______ 。
(4)操作b后检验滤渣已经洗涤干净的实验操作为_______ 。
(5)工业上用生物法处理H2S的原理为(硫杆菌作催化剂):
H2S+Fe2(SO4)3 = S↓ + 2FeSO4 + H2SO4
4FeSO4+ O2+ 2H2SO4=2Fe2(SO4)3+2H2O
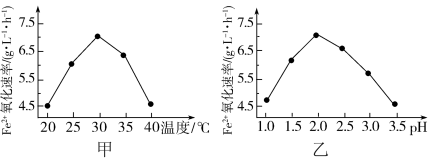
由图甲和图乙判断使用硫杆菌的最佳条件为_______ ,若反应温度过高,反应速率下降,其原因是_______ 。

已知:FeS+2HCl=FeCl2+H2S↑、2Fe(OH)3
 Fe2O3+3H2O
Fe2O3+3H2O(1)高温焙烧时发生的反应是CuFeS2+O2
 SO2+FeS+Cu,该反应中,氧化剂是
SO2+FeS+Cu,该反应中,氧化剂是(2)Cl2具有较强的氧化性,Fe2+具有较强的还原性,写出向滤液A中通入氯气的离子方程式
(3)向溶液B中通入NH3后发生反应的离子方程式为
(4)操作b后检验滤渣已经洗涤干净的实验操作为
(5)工业上用生物法处理H2S的原理为(硫杆菌作催化剂):
H2S+Fe2(SO4)3 = S↓ + 2FeSO4 + H2SO4
4FeSO4+ O2+ 2H2SO4=2Fe2(SO4)3+2H2O
由图甲和图乙判断使用硫杆菌的最佳条件为

您最近一年使用:0次
解题方法
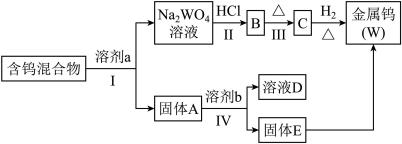
3 . 分离混合物在工业生产中应用广泛.某含有金属钨(W)、WO2、WO3、W2O5的混合物,欲从该混合物中分离出WO3和W2O5,并冶炼金属钨,其流程如图所示.
请阅读资料卡片并回答下列问题.
【资料卡片】
i.WO3易溶于NaOH、Na2CO3和Na2C2O4(草酸钠)溶液并形成钨酸盐(Na2WO4);W2O5易被氧化,也能溶解在上述溶液中;金属钨和WO2不溶于上述溶液.
ii.WO3几乎不与无机酸反应.
iii.钨化合物在不同溶剂中的浸取率见下表(浸取是用溶剂溶解固体混合物,以分离可溶性组分及残渣的过程.若浸取率为100%,则固体中的可溶组分全部溶解在溶剂中).
(1)步骤Ⅰ和Ⅳ均要进行的操作是_______________________________________ 。
(2)步骤Ⅱ、Ⅲ反应的化学方程式分别是_____________ 、_____________ 。
(3)WO3既属于金属氧化物,也属于____ (填“酸性”、“碱性”)氧化物,与NaOH溶液反应的离子方程式是___________________________ .
(4)步骤Ⅰ是将WO3分离出来,选用的试剂a是⑤,理由是______ .
(5)步骤Ⅳ可将W2O5分离出来,选用的试剂b是____ ,固体E中含有的物质是___ ,D中的溶质是____ .

请阅读资料卡片并回答下列问题.
【资料卡片】
i.WO3易溶于NaOH、Na2CO3和Na2C2O4(草酸钠)溶液并形成钨酸盐(Na2WO4);W2O5易被氧化,也能溶解在上述溶液中;金属钨和WO2不溶于上述溶液.
ii.WO3几乎不与无机酸反应.
iii.钨化合物在不同溶剂中的浸取率见下表(浸取是用溶剂溶解固体混合物,以分离可溶性组分及残渣的过程.若浸取率为100%,则固体中的可溶组分全部溶解在溶剂中).
| 溶剂 | 煮沸时间(min) | W2O5(%) | WO3(%) | WO2 | 金属钨 |
| ①100g/L NaOH ②300g/LNa2CO3 ③50g/L Na2CO3 ④饱和Na2C2O4 ⑤饱和Na2C2O4(在CO2气氛下浸取) | 25 7 30 60 120 | 72.3 76.4 100 4.2 <0.5 | 100 100 100 100 100 | 未检出 | 未检出 |
(2)步骤Ⅱ、Ⅲ反应的化学方程式分别是
(3)WO3既属于金属氧化物,也属于
(4)步骤Ⅰ是将WO3分离出来,选用的试剂a是⑤,理由是
(5)步骤Ⅳ可将W2O5分离出来,选用的试剂b是
您最近一年使用:0次
名校
4 . 溴及溴化物在医药、农药、染料和阻燃剂等的生产中有广泛应用。以海水为原料提取溴单质的流程如下:
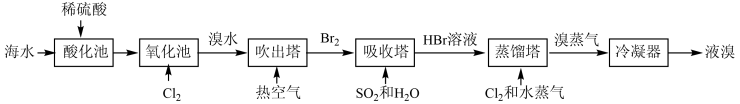
请回答下列问题:
(1)“吹出塔”中通入热空气吹出溴蒸气,说明溴单质最具有的性质可能是_______(填标号)。
(2)“吸收塔”中发生反应的离子方程式 为_______ 。反应后溶液的pH_______ (填“增大”、“减小”或“不变”)。
(3)粗液溴含少量Cl2,提纯溴单质的方法是加入X,蒸馏、冷凝。X可能是_______(填标号)。
(4)实验室保存液溴的试剂瓶中加一层水,其目的是_______ 。
(5)工业上也可用纯碱溶液吸收Br2,反应生成了NaBrO3、NaBr、CO2,则该反应的化学方程式 为_______ 。

请回答下列问题:
(1)“吹出塔”中通入热空气吹出溴蒸气,说明溴单质最具有的性质可能是_______(填标号)。
| A.氧化性 | B.还原性 | C.易挥发性 | D.活泼性 |
(3)粗液溴含少量Cl2,提纯溴单质的方法是加入X,蒸馏、冷凝。X可能是_______(填标号)。
| A.NaI | B.NaBr | C.NaOH | D.NaCl |
(5)工业上也可用纯碱溶液吸收Br2,反应生成了NaBrO3、NaBr、CO2,则该反应的
您最近一年使用:0次
2022-07-12更新
|
492次组卷
|
3卷引用:湖南省长沙市雅礼中学2021-2022学年高一下学期期末考试化学试题
5 . I.氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用图装置(部分装置省略)制备 和NaClO,探究其氧化还原性质。回答下列问题:
和NaClO,探究其氧化还原性质。回答下列问题:
已知: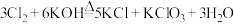
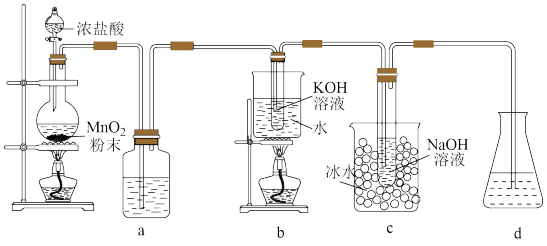
(1)制备氯气的离子方程式为____________ ,a中的试剂为___________
(2)b中氧化剂和还原剂的质量比为_______ 。c中采用冰水浴冷却的目的是__________ ,化学反应的离子方程式是______________ 。
(3)d的作用是吸收尾气 ,可选用试剂______(填字母)。
,可选用试剂______(填字母)。
II.用氯气和石灰乳反应可以制备漂粉精,漂粉精常用于游泳池的消毒,在空气中可以生成起消毒作用的HClO。池水的酸碱性对消毒效果影响明显。
(4)用化学方程式表示漂粉精产生HClO的主要途径为:________________
(5)池水碱性过强,杀毒作用会________ (填“增强”或“减弱”);池水酸性过强,会刺激眼睛和皮肤,通常加入 以降低酸性,起到降低酸性作用的离子是
以降低酸性,起到降低酸性作用的离子是_______ 。
(6)某届奥运会期间,室外游泳池水变绿成为当时的一大新闻。调查得知原因是泳池水 含量增大导致藻类生长,该游泳池每隔一段时间投放含氯消毒剂,某次误投了
含量增大导致藻类生长,该游泳池每隔一段时间投放含氯消毒剂,某次误投了 消毒剂,与HClO相互作用导致了上述情况发生。请用化学方程式解释
消毒剂,与HClO相互作用导致了上述情况发生。请用化学方程式解释___________ 。
 和NaClO,探究其氧化还原性质。回答下列问题:
和NaClO,探究其氧化还原性质。回答下列问题:已知:
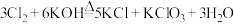

(1)制备氯气的离子方程式为
(2)b中氧化剂和还原剂的质量比为
(3)d的作用是吸收尾气
 ,可选用试剂______(填字母)。
,可选用试剂______(填字母)。| A.HCl | B.NaCl | C.NaOH | D. (有还原性) (有还原性) |
II.用氯气和石灰乳反应可以制备漂粉精,漂粉精常用于游泳池的消毒,在空气中可以生成起消毒作用的HClO。池水的酸碱性对消毒效果影响明显。
(4)用化学方程式表示漂粉精产生HClO的主要途径为:
(5)池水碱性过强,杀毒作用会
 以降低酸性,起到降低酸性作用的离子是
以降低酸性,起到降低酸性作用的离子是(6)某届奥运会期间,室外游泳池水变绿成为当时的一大新闻。调查得知原因是泳池水
 含量增大导致藻类生长,该游泳池每隔一段时间投放含氯消毒剂,某次误投了
含量增大导致藻类生长,该游泳池每隔一段时间投放含氯消毒剂,某次误投了 消毒剂,与HClO相互作用导致了上述情况发生。请用化学方程式解释
消毒剂,与HClO相互作用导致了上述情况发生。请用化学方程式解释
您最近一年使用:0次
名校
解题方法
6 . 中国有广阔的海岸线,建设发展海洋经济、海水的综合利用大有可为。空气吹出法工艺,是目前“海水提溴”的最主要方法之一,其工艺流程如下图所示,试回答下列问题:
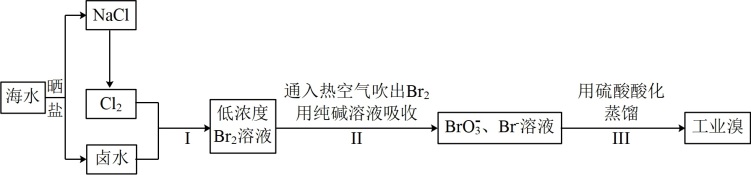
(1)海水日晒得到的盐因为含有较多杂质,称为粗盐。为了得到精制盐,可以用_______ 的办法除去其中的泥沙等不溶物。
(2)以上步骤I中已获得游离态的溴,写出涉及反应的离子方程式_______ ;步骤II又将之转变成化合态的溴,其目的是_______ 。
(3)步骤②通入热空气或水蒸气吹出Br2,利用了溴的_______。
(4)流程II中涉及的离子反应方程式如下,请在下面横线内填入适当的化学计量数:_______ 。
_______Br2+_______ CO =_______BrO
=_______BrO +_______ Br-+_______ CO2↑
+_______ Br-+_______ CO2↑
(5)上述流程中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏。写出溴与二氧化硫水溶液反应的化学方程式:_______ 。
(6)流程III蒸馏过程中,温度应控制在80~90℃。温度过高或过低都不利于生产,请解释原因:_______ 。

(1)海水日晒得到的盐因为含有较多杂质,称为粗盐。为了得到精制盐,可以用
(2)以上步骤I中已获得游离态的溴,写出涉及反应的离子方程式
(3)步骤②通入热空气或水蒸气吹出Br2,利用了溴的_______。
| A.氧化性 | B.还原性 | C.挥发性 | D.腐蚀性 |
_______Br2+_______ CO
 =_______BrO
=_______BrO +_______ Br-+_______ CO2↑
+_______ Br-+_______ CO2↑(5)上述流程中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏。写出溴与二氧化硫水溶液反应的化学方程式:
(6)流程III蒸馏过程中,温度应控制在80~90℃。温度过高或过低都不利于生产,请解释原因:
您最近一年使用:0次
名校
7 . 铝和铝合金是一类重要的金属材料。回答下列问题:
(1)除去镁粉中混有的少量铝粉,加入某试剂后反应的离子方程式为_______
(2)某同学在实验室用铝土矿(含有 和
和 ),不考虑其他杂质)制取金属铝的流程如下:
),不考虑其他杂质)制取金属铝的流程如下:
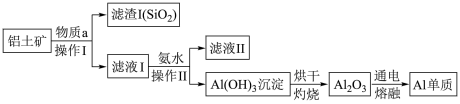
①操作I所加物质a为_______ (选填 或NaOH),
或NaOH), 与a反应的离子方程式为
与a反应的离子方程式为_______ 。
②滤液II中溶质的用途之一是_______ 。
③工业上冶炼铝的化学反应方程式_______
(3)铝与 在酸性或碱性条件下均可反应,为了降低饮用水中
在酸性或碱性条件下均可反应,为了降低饮用水中 的浓度,可以在碱性条件下用铝粉将
的浓度,可以在碱性条件下用铝粉将 还原为
还原为 ,完善并配平该反应:
,完善并配平该反应:_______ 。

(4)已知:CCl4与水不相溶且密度比水大,Cl2的CCl4溶液呈黄绿色,Br2的CCl4溶液呈橙红色,且Br2易从水溶液中溶入CCl4中。Cl2既能氧化 ,也能氧化
,也能氧化 。
。
①取 溶液,向其中滴加几滴新制的氯水,振荡后溶液呈黄色。取少量反应后的溶液加入KSCN溶液,溶液变为红色。另取少量反应后的溶液加入CCl4,振荡后,下层为无色液体。以上实验结论表明还原性:
溶液,向其中滴加几滴新制的氯水,振荡后溶液呈黄色。取少量反应后的溶液加入KSCN溶液,溶液变为红色。另取少量反应后的溶液加入CCl4,振荡后,下层为无色液体。以上实验结论表明还原性: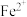
_______  (填“>”或“<”)。
(填“>”或“<”)。
②若在 溶液中通入标准状况下672mL的Cl2,取少量反应后的溶液加入CCl4,振荡后下层液体呈
溶液中通入标准状况下672mL的Cl2,取少量反应后的溶液加入CCl4,振荡后下层液体呈_______ 色,写出该反应的离子方程式_______ 。
(1)除去镁粉中混有的少量铝粉,加入某试剂后反应的离子方程式为
(2)某同学在实验室用铝土矿(含有
 和
和 ),不考虑其他杂质)制取金属铝的流程如下:
),不考虑其他杂质)制取金属铝的流程如下:
①操作I所加物质a为
 或NaOH),
或NaOH), 与a反应的离子方程式为
与a反应的离子方程式为②滤液II中溶质的用途之一是
③工业上冶炼铝的化学反应方程式
(3)铝与
 在酸性或碱性条件下均可反应,为了降低饮用水中
在酸性或碱性条件下均可反应,为了降低饮用水中 的浓度,可以在碱性条件下用铝粉将
的浓度,可以在碱性条件下用铝粉将 还原为
还原为 ,完善并配平该反应:
,完善并配平该反应:
(4)已知:CCl4与水不相溶且密度比水大,Cl2的CCl4溶液呈黄绿色,Br2的CCl4溶液呈橙红色,且Br2易从水溶液中溶入CCl4中。Cl2既能氧化
 ,也能氧化
,也能氧化 。
。①取
 溶液,向其中滴加几滴新制的氯水,振荡后溶液呈黄色。取少量反应后的溶液加入KSCN溶液,溶液变为红色。另取少量反应后的溶液加入CCl4,振荡后,下层为无色液体。以上实验结论表明还原性:
溶液,向其中滴加几滴新制的氯水,振荡后溶液呈黄色。取少量反应后的溶液加入KSCN溶液,溶液变为红色。另取少量反应后的溶液加入CCl4,振荡后,下层为无色液体。以上实验结论表明还原性: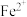
 (填“>”或“<”)。
(填“>”或“<”)。②若在
 溶液中通入标准状况下672mL的Cl2,取少量反应后的溶液加入CCl4,振荡后下层液体呈
溶液中通入标准状况下672mL的Cl2,取少量反应后的溶液加入CCl4,振荡后下层液体呈
您最近一年使用:0次
名校
8 . 从海水中可以提取很多有用的物质,例如从海水制盐所得到的卤水中可以提取碘。活性炭吸附法是工业提取碘的方法之一,其流程如下:

资料显示:
Ⅰ.pH=2 时, NaNO2溶液只能将 I-氧化为 I2,同时生成 NO;
Ⅱ.I2+5Cl2+6H2O=2HIO3+10HCl;
Ⅲ.I2在碱性溶液中反应生成 I-和 IO 。
。
(1)反应①的离子方程式___________ 。
(2)方案甲中,根据 I2的特性,分离操作 X 应为___________ 、___________ 。
(3)Cl2、酸性 KMnO4等都是常用的强氧化剂,但该工艺中氧化卤水中的 I-却选择了价格较高的NaNO2,原因是___________ 。
(4)写出反应②的离子反应方程式___________
(5)方案乙中,已知反应③过滤后,滤液中仍存在少量的 I2、I-。 请检验滤液中的 I-,将实验方案补充完整。实验中可供选择的试剂:稀 H2SO4、淀粉溶液、Fe2(SO4)3溶液。
A.将滤液___________ ,直到水层用淀粉溶液检验不出碘单质存在。
B.从水层取少量溶液于试管中,___________ 。

资料显示:
Ⅰ.pH=2 时, NaNO2溶液只能将 I-氧化为 I2,同时生成 NO;
Ⅱ.I2+5Cl2+6H2O=2HIO3+10HCl;
Ⅲ.I2在碱性溶液中反应生成 I-和 IO
 。
。 (1)反应①的离子方程式
(2)方案甲中,根据 I2的特性,分离操作 X 应为
(3)Cl2、酸性 KMnO4等都是常用的强氧化剂,但该工艺中氧化卤水中的 I-却选择了价格较高的NaNO2,原因是
(4)写出反应②的离子反应方程式
(5)方案乙中,已知反应③过滤后,滤液中仍存在少量的 I2、I-。 请检验滤液中的 I-,将实验方案补充完整。实验中可供选择的试剂:稀 H2SO4、淀粉溶液、Fe2(SO4)3溶液。
A.将滤液
B.从水层取少量溶液于试管中,
您最近一年使用:0次
名校
9 . 从海水中可以提取很多有用的物质,例如从海水制盐所得到的卤水中可以提取碘。活性炭吸附法是工业提取碘的方法之一,其流程如下:
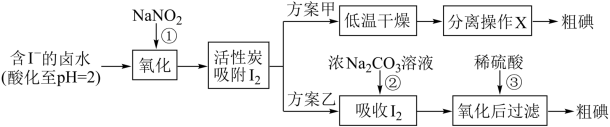
资料显示:
Ⅰ.pH=2时,NaNO2溶液只能将I-氧化为I2,同时生成NO;
Ⅱ. ;
;
Ⅲ.I2在碱性溶液中反应生成I-和IO 。
。
(1)写出反应①的离子方程式___________ 。
(2)方案甲中,根据I2的特性,分离操作X应为___________ 、___________ 。
(3)Cl2、酸性KMnO4等都是常用的强氧化剂,但该工艺中氧化卤水中的I-却选择了价格较高的NaNO2,原因是___________ 。
(4)写出反应②的离子反应方程式___________
(5)方案乙中,已知反应③过滤后,滤液中仍存在少量的I2、I-。请检验滤液中的I-,将实验方案补充完整。实验中可供选择的试剂:CCl4、稀H2SO4、淀粉溶液、Fe2(SO4)3溶液。
A.将滤液___________ ,直到水层用淀粉溶液检验不出碘单质存在。
B.从水层取少量溶液于试管中,___________ 。

资料显示:
Ⅰ.pH=2时,NaNO2溶液只能将I-氧化为I2,同时生成NO;
Ⅱ.
 ;
;Ⅲ.I2在碱性溶液中反应生成I-和IO
 。
。(1)写出反应①的离子方程式
(2)方案甲中,根据I2的特性,分离操作X应为
(3)Cl2、酸性KMnO4等都是常用的强氧化剂,但该工艺中氧化卤水中的I-却选择了价格较高的NaNO2,原因是
(4)写出反应②的离子反应方程式
(5)方案乙中,已知反应③过滤后,滤液中仍存在少量的I2、I-。请检验滤液中的I-,将实验方案补充完整。实验中可供选择的试剂:CCl4、稀H2SO4、淀粉溶液、Fe2(SO4)3溶液。
A.将滤液
B.从水层取少量溶液于试管中,
您最近一年使用:0次
2021-06-24更新
|
258次组卷
|
2卷引用:云南省玉溪市一中2020-2021学年高一下学期第二次月考化学试题
名校
10 . 海洋是生命的摇篮,海水不仅是宝贵的水资源,而且蕴藏着丰富的化学资源。从海水中提取淡水和一些重要的化工产品的工艺流程如图所示。
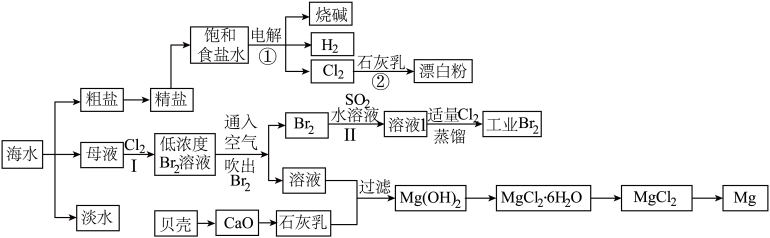
根据上述流程图回答下列问题:
(1)工业上完成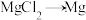 常用的冶炼方法
常用的冶炼方法_______ 。
(2)通入热空气或水蒸气吹出 ,利用了溴的_______(填序号)。
,利用了溴的_______(填序号)。
(3)写出反应②的化学反应方程式_______ 。
(4)写出步骤Ⅱ反应的离子方程式_______ 。
(5)从海水中获得淡水的主要方法有电渗析法、离子交换法和_______ (填一种)。
(6)实验室模拟海水蒸馏法制取淡水,蒸馏过程中不可能用到的仪器有_______(填序号)。
(7)离子交换法净化水的过程如图所示。下列说法正确的是_______(填序号)。


根据上述流程图回答下列问题:
(1)工业上完成
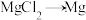 常用的冶炼方法
常用的冶炼方法(2)通入热空气或水蒸气吹出
 ,利用了溴的_______(填序号)。
,利用了溴的_______(填序号)。| A.氧化性 | B.还原性 | C.挥发性 | D.腐蚀性 |
(4)写出步骤Ⅱ反应的离子方程式
(5)从海水中获得淡水的主要方法有电渗析法、离子交换法和
(6)实验室模拟海水蒸馏法制取淡水,蒸馏过程中不可能用到的仪器有_______(填序号)。
| A.圆底烧瓶 | B.容量瓶 | C.直形冷凝管 | D.接收器 |

| A.经过阳离子交换树脂后,水中阳离子总数减少 |
B.通过阴离子交换树脂后,水中只有 被除去 被除去 |
| C.通过净化处理后的水,导电性增强 |
D.阴离子交换树脂填充段存在反应: |
您最近一年使用:0次



