解题方法
1 . 高铁酸钾 是一种新型净水剂,制备装置如图所示,夹持、加热等装置略。
是一种新型净水剂,制备装置如图所示,夹持、加热等装置略。
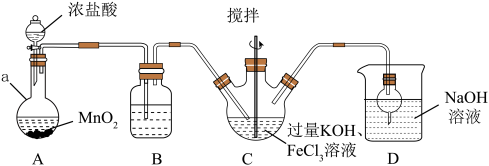
资料:I. 可溶于水,难溶于乙醇。KOH易溶于乙醇。
可溶于水,难溶于乙醇。KOH易溶于乙醇。
II. 在碱性溶液中稳定,中性和酸性溶液中不稳定。
在碱性溶液中稳定,中性和酸性溶液中不稳定。
(1) 具有强氧化性,其中铁元素的化合价为
具有强氧化性,其中铁元素的化合价为_______ 价。
(2)装置B中除杂质所用试剂是_______ ,装置D的作用是_______ 。
(3)装置C中反应的离子方程式_______ 。
(4)C中反应为放热反应,而反应温度须控制在0~5℃,采用的控温方法为_______ 。反应中KOH必须过量的原因是_______ 。
(5)C中混合物经过重结晶、洗涤、真空干燥,可以得到高铁酸钾晶体。洗涤时去除固体表面的KOH,可以用_______ 洗涤。
 是一种新型净水剂,制备装置如图所示,夹持、加热等装置略。
是一种新型净水剂,制备装置如图所示,夹持、加热等装置略。
资料:I.
 可溶于水,难溶于乙醇。KOH易溶于乙醇。
可溶于水,难溶于乙醇。KOH易溶于乙醇。II.
 在碱性溶液中稳定,中性和酸性溶液中不稳定。
在碱性溶液中稳定,中性和酸性溶液中不稳定。(1)
 具有强氧化性,其中铁元素的化合价为
具有强氧化性,其中铁元素的化合价为(2)装置B中除杂质所用试剂是
(3)装置C中反应的离子方程式
(4)C中反应为放热反应,而反应温度须控制在0~5℃,采用的控温方法为
(5)C中混合物经过重结晶、洗涤、真空干燥,可以得到高铁酸钾晶体。洗涤时去除固体表面的KOH,可以用
您最近一年使用:0次
名校
解题方法
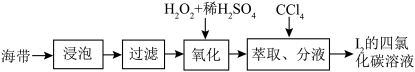
2 . 一氯化碘(ICl)是一种卤素互化物。卤素互化物具有强氧化性稀溶液,可与金属直接反应,也可用作有机合成中的碘化剂,一般可由卤素单质直接化合制得。有关一氯化碘制备及性质验证,请回答下列问题:
I.海藻提碘可得到I2的CCl4溶液,从其中回收I2的流程如下:
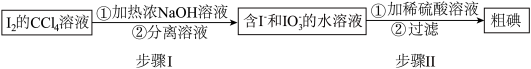
(1)步骤I的分离溶液操作中,主要用到的玻璃仪器有烧杯和_______ ,步骤Ⅱ的反应中氧化剂与还原剂的物质的量之比为_______ 。
(2)回收获得的粗碘可采用如图所示的简易装置分离提纯。将粉状物放入蒸发皿中并小火加热,碘晶体在扎有小孔的滤纸上凝结,该分离提纯方法的名称是_______ 。

Ⅱ.某学习小组在实验室中拟用下图装置制取纯净、干燥的氯气,并利用氯气与碘反应制备一氯化碘。
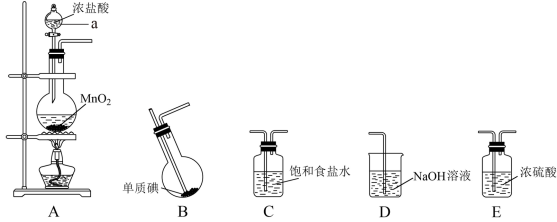
查阅资料了解到以下内容:
①碘与氯气的反应为放热反应
②ICl是一种红棕色液体,沸点97.4℃,不溶于水
③ICl能与KI反应生成I2
请回答下列问题:
(3)各装置连接顺序为A→_______→_______→_______→_______;_______
(4)B装置烧瓶需放在冷水中,其目的是:_______ ,B装置得到的液态产物进一步提纯可得到较纯净的ICl,采取的方法是_______ 。
(5)ICl与稀NaOH溶液可发生非氧化还原反应,请写出该反应的离子方程式_______ 。
(6)请设计简单的实验证明ICl的氧化性比I2强:_______ 。
I.海藻提碘可得到I2的CCl4溶液,从其中回收I2的流程如下:

(1)步骤I的分离溶液操作中,主要用到的玻璃仪器有烧杯和
(2)回收获得的粗碘可采用如图所示的简易装置分离提纯。将粉状物放入蒸发皿中并小火加热,碘晶体在扎有小孔的滤纸上凝结,该分离提纯方法的名称是

Ⅱ.某学习小组在实验室中拟用下图装置制取纯净、干燥的氯气,并利用氯气与碘反应制备一氯化碘。

查阅资料了解到以下内容:
①碘与氯气的反应为放热反应
②ICl是一种红棕色液体,沸点97.4℃,不溶于水
③ICl能与KI反应生成I2
请回答下列问题:
(3)各装置连接顺序为A→_______→_______→_______→_______;
(4)B装置烧瓶需放在冷水中,其目的是:
(5)ICl与稀NaOH溶液可发生非氧化还原反应,请写出该反应的离子方程式
(6)请设计简单的实验证明ICl的氧化性比I2强:
您最近一年使用:0次
2023-01-19更新
|
407次组卷
|
2卷引用:福建省厦门市同安第一中学2022-2023学年高一下学期第一次月考化学试题
名校
解题方法
3 . MnO2是重要的化工原料,由软锰矿制备MnO2的一种工艺流程如图:
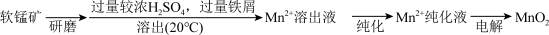
资料:①软锰矿的主要成分为MnO2,主要杂质有Al2O3和SiO2
②金属离子沉淀的pH
③该工艺条件下,MnO2与H2SO4不反应。
(1)溶出:
①溶出前,软锰矿需研磨。目的是_______ 。
②溶出时,Fe的氧化过程及得到Mn2+的主要途径如图所示:
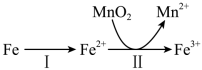
i.步骤II是从软锰矿中溶出Mn2+的主要反应,反应的离子方程式是_______ 。
ii.若Fe2+全部来自于反应Fe+2H+=Fe2++H2↑,完全溶出Mn2+所需Fe与MnO2的物质的量比值为2。而实际比值(0.9)小于2,原因是_______ 。
(2)纯化:已知MnO2的氧化性随溶液pH增大而减弱。纯化时先加入MnO2,后加入NH3·H2O,调节溶液pH为_______ ,说明试剂加入顺序的原因_______ 。
(3)电解:Mn2+纯化液酸化后经电解得MnO2.用MnO2通过铝热反应制Mn的化学方程式为_______ 。
(4)产品纯度测定:向ag产品中依次加入足量b gNa2C2O4和足量稀H2SO4,加热至充分反应。再用c mol·L-1 KMnO4溶液滴定剩余至终点,消耗KMnO4溶液的体积为d L(已知:MnO2及MnO 均被还原为Mn2+。Na2C2O4的氧化产物为CO2.相对分子质量:MnO2-86.94;Na2C2O4-134.0),求产品的纯度(用质量分数表示,写出计算过程)
均被还原为Mn2+。Na2C2O4的氧化产物为CO2.相对分子质量:MnO2-86.94;Na2C2O4-134.0),求产品的纯度(用质量分数表示,写出计算过程)_______
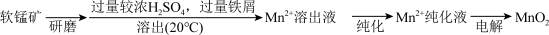
资料:①软锰矿的主要成分为MnO2,主要杂质有Al2O3和SiO2
②金属离子沉淀的pH
| Fe3+ | Al3+ | Mn2+ | Fe2+ | |
| 开始沉淀时 | 1.5 | 3.4 | 5.8 | 6.3 |
| 完全沉淀时 | 2.8 | 4.7 | 7.8 | 8.3 |
(1)溶出:
①溶出前,软锰矿需研磨。目的是
②溶出时,Fe的氧化过程及得到Mn2+的主要途径如图所示:

i.步骤II是从软锰矿中溶出Mn2+的主要反应,反应的离子方程式是
ii.若Fe2+全部来自于反应Fe+2H+=Fe2++H2↑,完全溶出Mn2+所需Fe与MnO2的物质的量比值为2。而实际比值(0.9)小于2,原因是
(2)纯化:已知MnO2的氧化性随溶液pH增大而减弱。纯化时先加入MnO2,后加入NH3·H2O,调节溶液pH为
(3)电解:Mn2+纯化液酸化后经电解得MnO2.用MnO2通过铝热反应制Mn的化学方程式为
(4)产品纯度测定:向ag产品中依次加入足量b gNa2C2O4和足量稀H2SO4,加热至充分反应。再用c mol·L-1 KMnO4溶液滴定剩余至终点,消耗KMnO4溶液的体积为d L(已知:MnO2及MnO
 均被还原为Mn2+。Na2C2O4的氧化产物为CO2.相对分子质量:MnO2-86.94;Na2C2O4-134.0),求产品的纯度(用质量分数表示,写出计算过程)
均被还原为Mn2+。Na2C2O4的氧化产物为CO2.相对分子质量:MnO2-86.94;Na2C2O4-134.0),求产品的纯度(用质量分数表示,写出计算过程)
您最近一年使用:0次
名校
4 . 锡、钨、锦和稀土并称为中国的四大战略资源,工业上主要以锡石(主要成分为 ,还含有
,还含有 、
、 、S、Cu、Pb、Fe等杂质)为原料制备金属锡,其主要工艺流程如下:
、S、Cu、Pb、Fe等杂质)为原料制备金属锡,其主要工艺流程如下:
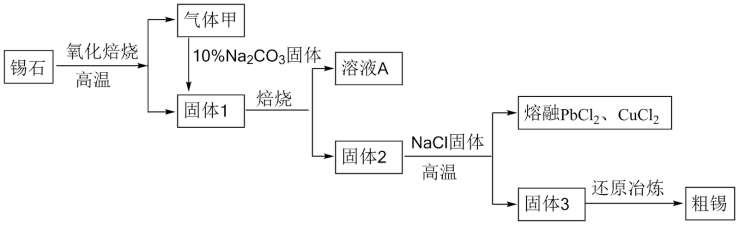
查阅资料可知:钨酸钙( )难溶于水,Sn、Pb在化合物中主要呈现+2、+4两种化合价。
)难溶于水,Sn、Pb在化合物中主要呈现+2、+4两种化合价。
回答下列问题:
(1)氧化焙烧时加快反应速率的方法有___________ (任填一种),气体甲的主要成分是___________ (填化学式)。
(2)在固体1中加入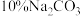 溶液并进行熔烧,其目的是将W元素转化为可溶性盐分离出来,已知该过程中不涉及氧化还原反应,则溶液A中含W元素的溶液的溶质是
溶液并进行熔烧,其目的是将W元素转化为可溶性盐分离出来,已知该过程中不涉及氧化还原反应,则溶液A中含W元素的溶液的溶质是___________ (填化学式);固体2中Pb元素的化合价为___________ 。
(3)固体3通过还原冶炼可得到粗锡,若使用焦炭在高温条件下进行,其反应原理与二氧化硅和碳反应相似,则还原制得锡的化学方程式为___________ 。
(4) 具有强还原性,在酸性条件易被空气中的
具有强还原性,在酸性条件易被空气中的 氧化,其反应的离子方程式为
氧化,其反应的离子方程式为___________ 。
(5)通过下列过程可以测定粗锡中锡的纯度:将粗锡样品溶于盐酸中得到 溶液,再加入过量的
溶液,再加入过量的 溶液转化为
溶液转化为 ,然后用已知浓度的
,然后用已知浓度的 溶液去滴定生成的
溶液去滴定生成的 。现有粗锡样品0.613g,经上述各步反应后,共用去
。现有粗锡样品0.613g,经上述各步反应后,共用去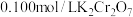 溶液16.0mL,则该粗锡样品中锡的质量分数为
溶液16.0mL,则该粗锡样品中锡的质量分数为___________ (假设杂质不参与反应)。
 ,还含有
,还含有 、
、 、S、Cu、Pb、Fe等杂质)为原料制备金属锡,其主要工艺流程如下:
、S、Cu、Pb、Fe等杂质)为原料制备金属锡,其主要工艺流程如下:
查阅资料可知:钨酸钙(
 )难溶于水,Sn、Pb在化合物中主要呈现+2、+4两种化合价。
)难溶于水,Sn、Pb在化合物中主要呈现+2、+4两种化合价。回答下列问题:
(1)氧化焙烧时加快反应速率的方法有
(2)在固体1中加入
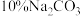 溶液并进行熔烧,其目的是将W元素转化为可溶性盐分离出来,已知该过程中不涉及氧化还原反应,则溶液A中含W元素的溶液的溶质是
溶液并进行熔烧,其目的是将W元素转化为可溶性盐分离出来,已知该过程中不涉及氧化还原反应,则溶液A中含W元素的溶液的溶质是(3)固体3通过还原冶炼可得到粗锡,若使用焦炭在高温条件下进行,其反应原理与二氧化硅和碳反应相似,则还原制得锡的化学方程式为
(4)
 具有强还原性,在酸性条件易被空气中的
具有强还原性,在酸性条件易被空气中的 氧化,其反应的离子方程式为
氧化,其反应的离子方程式为(5)通过下列过程可以测定粗锡中锡的纯度:将粗锡样品溶于盐酸中得到
 溶液,再加入过量的
溶液,再加入过量的 溶液转化为
溶液转化为 ,然后用已知浓度的
,然后用已知浓度的 溶液去滴定生成的
溶液去滴定生成的 。现有粗锡样品0.613g,经上述各步反应后,共用去
。现有粗锡样品0.613g,经上述各步反应后,共用去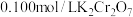 溶液16.0mL,则该粗锡样品中锡的质量分数为
溶液16.0mL,则该粗锡样品中锡的质量分数为
您最近一年使用:0次
2021-07-22更新
|
173次组卷
|
2卷引用:四川省成都市龙泉驿区2020-2021学年高一下学期末学业质量监测联考化学试题
名校
解题方法
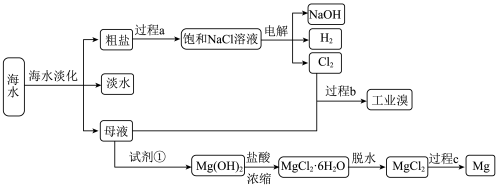
5 . 海水中化学元素的利用是指从海水中提取钠、镁、氯、溴等元素。_____________ 操作。
(2)过程c的化学反应方程式_____________________________________ 。
(3)过程b用于海水提溴.主要工业生产流程如下图所示。 ,利用了
,利用了 的氧化性,写出对应反应的离子方程式
的氧化性,写出对应反应的离子方程式_____________________________________________ 。
②吹出塔中通入热空气吹出 ,利用了
,利用了 的
的_____________ (填字母)。
A.氧化性 B.还原性 C.挥发性,沸点比水低 D.易溶于水
(4)实验室可以利用蒸馏的方法进行海水淡化,可选用如图装置完成。
①仪器B的名称是_____________ 。
②该装置中有一处明显的错误是________________________ 。
(2)过程c的化学反应方程式
(3)过程b用于海水提溴.主要工业生产流程如下图所示。

 ,利用了
,利用了 的氧化性,写出对应反应的离子方程式
的氧化性,写出对应反应的离子方程式②吹出塔中通入热空气吹出
 ,利用了
,利用了 的
的A.氧化性 B.还原性 C.挥发性,沸点比水低 D.易溶于水
(4)实验室可以利用蒸馏的方法进行海水淡化,可选用如图装置完成。
①仪器B的名称是
②该装置中有一处明显的错误是

您最近一年使用:0次
名校
解题方法
6 . 利用海水能够提取溴和镁,提取过程如下:
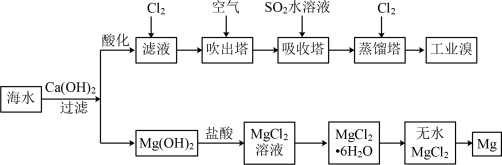
(1)提取溴的过程中,经过2次Br-→Br2转化的目的是_______ , 蒸馏塔中发生反应的离子方程式是_______ 。向溴水中加入CCl4,充分振荡、静置后Br2的CCl4溶液在_______ (上或下)层。
(2)吹出塔中通入热空气吹出Br2,利用了溴的_______ (填序号);
a.氧化性 b.还原性 c.挥发性
(3)从MgCl2溶液中得到MgCl2·6H2O晶体的主要操作_______ 、_______ 、过滤、洗涤、干燥(在HCl气流的保护下);由无水氯化镁得到镁的化学方程式是_______ 。
(4)工业上从卤水中获取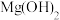 用石灰乳而不用
用石灰乳而不用 溶液的原因是
溶液的原因是_______ 。(写出两点原因)

(1)提取溴的过程中,经过2次Br-→Br2转化的目的是
(2)吹出塔中通入热空气吹出Br2,利用了溴的
a.氧化性 b.还原性 c.挥发性
(3)从MgCl2溶液中得到MgCl2·6H2O晶体的主要操作
(4)工业上从卤水中获取
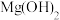 用石灰乳而不用
用石灰乳而不用 溶液的原因是
溶液的原因是
您最近一年使用:0次
2023-08-23更新
|
156次组卷
|
3卷引用:黑龙江省牡丹江市第三高级中学2022-2023学年高一下学期期末考试化学试题
名校
解题方法
7 . 已知海水中的溴含量约为65mg•L-1,从海水中提取溴的工业流程如图:

(1)请列举海水淡化的两种方法:_______ 、_______ 。
(2)上述步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将其转化成化合态的溴,目的是_______ 。
(3)步骤Ⅱ通入热空气吹出Br2,利用了溴的 _______。(填字母)
(4)步骤Ⅱ中涉及的离子反应如下,请在方框内填入正确的化学计量数:_______ 。
_______Br2+_______CO ═_______BrO
═_______BrO +_______Br-+_______CO2↑
+_______Br-+_______CO2↑
(5)上述流程中吹出的溴蒸气也可以先用二氧化硫的水溶液吸收,再用氯气氧化,然后进行蒸馏,则溴与二氧化硫的水溶液反应的离子方程式为_______ 。
(6)实验室分离溴还可以用萃取法,下列可以用作溴的萃取剂的有_______(填字母)。

(1)请列举海水淡化的两种方法:
(2)上述步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将其转化成化合态的溴,目的是
(3)步骤Ⅱ通入热空气吹出Br2,利用了溴的 _______。(填字母)
| A.氧化性 | B.还原性 | C.挥发性 | D.腐蚀性 |
_______Br2+_______CO
 ═_______BrO
═_______BrO +_______Br-+_______CO2↑
+_______Br-+_______CO2↑(5)上述流程中吹出的溴蒸气也可以先用二氧化硫的水溶液吸收,再用氯气氧化,然后进行蒸馏,则溴与二氧化硫的水溶液反应的离子方程式为
(6)实验室分离溴还可以用萃取法,下列可以用作溴的萃取剂的有_______(填字母)。
| A.乙醇 | B.四氯化碳 | C.裂化汽油 | D.苯 |
您最近一年使用:0次
名校
解题方法
8 .  是有毒气体,任意排放会造成环境污染。若加以利用,可以变废为宝。下图为
是有毒气体,任意排放会造成环境污染。若加以利用,可以变废为宝。下图为 的无害化处理流程图,回答下列问题:
的无害化处理流程图,回答下列问题:
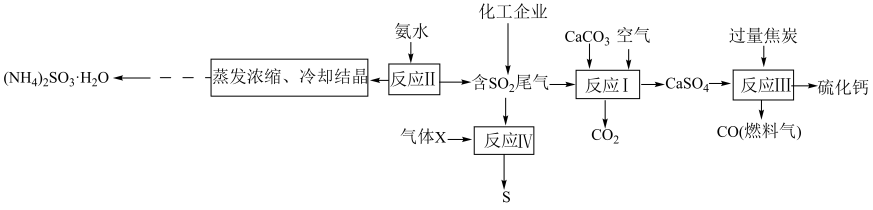
(1)“反应I”在高温条件下进行,写出该反应的化学方程式:_______ 。
(2)X可能为_______ (填化学式),电子式为_______ ,该反应说明 具有
具有_______ (填“氧化性”或“还原性”)。
(3)“反应Ⅲ”中参加反应的氧化剂与还原剂的物质的量之比为_______ 。
(4)“蒸发浓缩、冷却结晶”后获得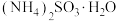 固体的操作是
固体的操作是_______ ,实验室进行此操作需要用到的玻璃仪器有漏斗、_______ 。不直接采用蒸发结晶的原因是_______ 。
(5)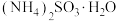 暴露在空气中易被氧化而变质,可以选用哪组试剂进行验证:
暴露在空气中易被氧化而变质,可以选用哪组试剂进行验证:_______ 。
A.稀硝酸, B.稀盐酸,
B.稀盐酸, C.稀盐酸,硝酸钡
C.稀盐酸,硝酸钡
 是有毒气体,任意排放会造成环境污染。若加以利用,可以变废为宝。下图为
是有毒气体,任意排放会造成环境污染。若加以利用,可以变废为宝。下图为 的无害化处理流程图,回答下列问题:
的无害化处理流程图,回答下列问题:
(1)“反应I”在高温条件下进行,写出该反应的化学方程式:
(2)X可能为
 具有
具有(3)“反应Ⅲ”中参加反应的氧化剂与还原剂的物质的量之比为
(4)“蒸发浓缩、冷却结晶”后获得
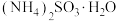 固体的操作是
固体的操作是(5)
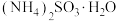 暴露在空气中易被氧化而变质,可以选用哪组试剂进行验证:
暴露在空气中易被氧化而变质,可以选用哪组试剂进行验证:A.稀硝酸,
 B.稀盐酸,
B.稀盐酸, C.稀盐酸,硝酸钡
C.稀盐酸,硝酸钡
您最近一年使用:0次
名校
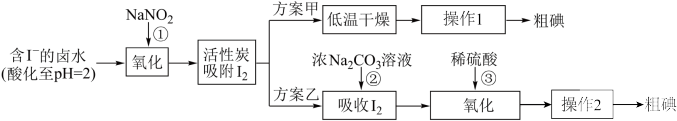
9 . 从海水中可以提取很多有用的物质,例如从海水制盐所得到的卤水中可以提取碘。活性炭吸附法是工业提碘的方法之一,其流程如下。下列说法错误的是 时,
时, 溶液只能将
溶液只能将 氧化为
氧化为 ,同时生成
,同时生成 。
。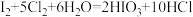 。
。
 时,
时, 溶液只能将
溶液只能将 氧化为
氧化为 ,同时生成
,同时生成 。
。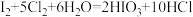 。
。| A.操作2中的萃取操作会用到的主要仪器为分液漏斗 |
B.方案甲中,根据 的特性,分离操作1的方法是升华 的特性,分离操作1的方法是升华 |
C.反应②中每吸收 转移 转移 电子,离子方程式是 电子,离子方程式是 |
D.可用 、酸性 、酸性 等便宜的强氧化剂代替 等便宜的强氧化剂代替 |
您最近一年使用:0次
2022-10-19更新
|
188次组卷
|
3卷引用:河南省新乡市第一中学2022-2023学年高一下学期3月月考化学试题
名校
解题方法
10 . 海水提溴的主要工业生产流程如下图所示。
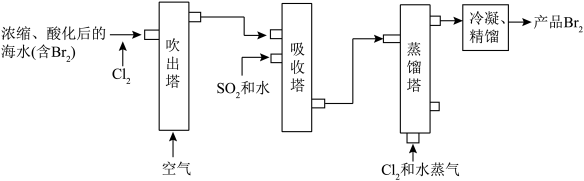
(1)吹出塔中通入热空气吹出 ,利用了
,利用了 的
的_______ ,吸收塔中吸收 ,利用了
,利用了 的
的_______ (填序号)。
A.氧化性 B.还原性 C.挥发性 D.易溶于水
(2)吸收塔中反应的离子方程式是_______ 。
(3)向酸化的滤液中加过氧化氢溶液,写出该反应的离子方程式_______ 。
(4)选择 作萃取剂的现象为
作萃取剂的现象为_______ 。

(1)吹出塔中通入热空气吹出
 ,利用了
,利用了 的
的 ,利用了
,利用了 的
的A.氧化性 B.还原性 C.挥发性 D.易溶于水
(2)吸收塔中反应的离子方程式是

(3)向酸化的滤液中加过氧化氢溶液,写出该反应的离子方程式
(4)选择
 作萃取剂的现象为
作萃取剂的现象为
您最近一年使用:0次



