名校
1 . 碳、硅及其化合物的开发由来已久,在现代生活中有广泛应用。
(1)SiO2是玻璃的主要成分之一,保存氢氟酸溶液不能使用玻璃瓶的原因是______________ (用化学方程式表示)。
(2)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如图:
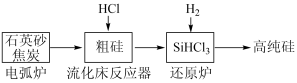
①用石英砂和焦炭在电弧炉中制粗硅,该反应的化学方程式为___________________________ 。
②在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,有关物质的沸点数据如表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和___________________ 。
(3)某同学为了验证碳和硅两种元素非金属性的相对强弱,用如图所示装置进行实验(夹持仪器已略去,气密性已检验),实验操作步骤:
Ⅰ.打开弹簧夹1,关闭弹簧夹2,并打开活塞a,滴加盐酸。
Ⅱ.A中看到白色沉淀时,关闭弹簧夹1,打开弹簧夹2,关闭活塞a。
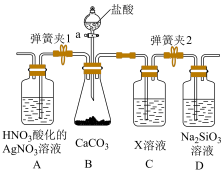
①通过步骤Ⅰ得知盐酸具有的性质是___________ (填字母)。
A.挥发性 B.还原性 C.氧化性 D.酸性
②C装置中的试剂X是______________ (写化学式)。
(1)SiO2是玻璃的主要成分之一,保存氢氟酸溶液不能使用玻璃瓶的原因是
(2)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如图:

①用石英砂和焦炭在电弧炉中制粗硅,该反应的化学方程式为
②在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,有关物质的沸点数据如表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和
物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
(3)某同学为了验证碳和硅两种元素非金属性的相对强弱,用如图所示装置进行实验(夹持仪器已略去,气密性已检验),实验操作步骤:
Ⅰ.打开弹簧夹1,关闭弹簧夹2,并打开活塞a,滴加盐酸。
Ⅱ.A中看到白色沉淀时,关闭弹簧夹1,打开弹簧夹2,关闭活塞a。

①通过步骤Ⅰ得知盐酸具有的性质是
A.挥发性 B.还原性 C.氧化性 D.酸性
②C装置中的试剂X是
您最近一年使用:0次
名校
解题方法
2 . 以银锰精矿(主要含Ag2S、MnS、FeS2)和氧化锰矿(主要含MnO2)为原料联合提取银和锰的一种流程示意图如下。
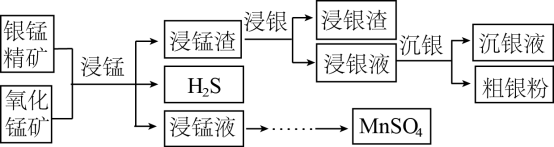
已知:酸性条件下,MnO2的氧化性强于Fe3+。
(1)“浸锰”过程是在H2SO4溶液中使矿石中的锰元素浸出,同时去除FeS2,有利于后续银的浸出:矿石中的银以Ag2S的形式残留于浸锰渣中。
①“浸锰”过程中,发生反应的离子方程式为______
②在H2SO4溶液中,银锰精矿中的FeS2和氧化锰矿中的MnO2发生反应,则浸锰液中主要的金属阳离子有______ 。
(2)“浸银”时,使用过量FeCl3、HCl和CaCl2的混合液作为浸出剂,将Ag2S中的银以[AgCl2] 形式浸出。将“浸银”反应的离子方程式补充完整:
形式浸出。将“浸银”反应的离子方程式补充完整:______ 。
Fe3++Ag2S+______≒______+2[AgCl2] +S
+S
(3)“沉银”过程中需要过量的铁粉作为还原剂。
①该步反应的离子方程式有______ 。
②Fe2+具有还原性,在酸性条件下可以被空气氧化为Fe3+写出该反应的离子方程式______ 。
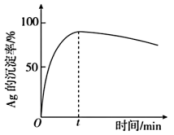
③已知在一定条件下Fe3+氧化性大于Ag+,一定温度下,Ag的沉淀率随反应时间的变化如图所示。解释t分钟后Ag的沉淀率逐渐减小的原因:______ 。
(4)结合“浸锰”过程,从两种矿石中各物质利用角度,分析联合提取银和锰的优势:______ 。

已知:酸性条件下,MnO2的氧化性强于Fe3+。
(1)“浸锰”过程是在H2SO4溶液中使矿石中的锰元素浸出,同时去除FeS2,有利于后续银的浸出:矿石中的银以Ag2S的形式残留于浸锰渣中。
①“浸锰”过程中,发生反应的离子方程式为
②在H2SO4溶液中,银锰精矿中的FeS2和氧化锰矿中的MnO2发生反应,则浸锰液中主要的金属阳离子有
(2)“浸银”时,使用过量FeCl3、HCl和CaCl2的混合液作为浸出剂,将Ag2S中的银以[AgCl2]
 形式浸出。将“浸银”反应的离子方程式补充完整:
形式浸出。将“浸银”反应的离子方程式补充完整:Fe3++Ag2S+______≒______+2[AgCl2]
 +S
+S(3)“沉银”过程中需要过量的铁粉作为还原剂。
①该步反应的离子方程式有
②Fe2+具有还原性,在酸性条件下可以被空气氧化为Fe3+写出该反应的离子方程式
③已知在一定条件下Fe3+氧化性大于Ag+,一定温度下,Ag的沉淀率随反应时间的变化如图所示。解释t分钟后Ag的沉淀率逐渐减小的原因:

(4)结合“浸锰”过程,从两种矿石中各物质利用角度,分析联合提取银和锰的优势:
您最近一年使用:0次
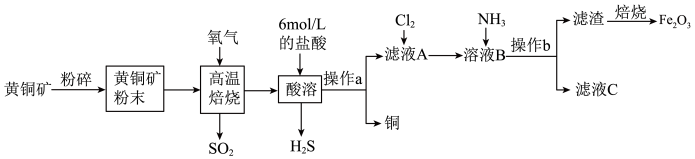
3 . 铜和三氧化二铁在工农业生产中用途广泛,用黄铜矿(主要成分为 ,其中Cu为+2价、Fe为+2价)制取铜和三氧化二铁的工艺流程如图所示。
,其中Cu为+2价、Fe为+2价)制取铜和三氧化二铁的工艺流程如图所示。
已知:i.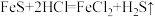
ii.
iii.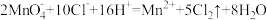
(1)高温焙烧时发生的反应是 ,该反应中,氧化产物是
,该反应中,氧化产物是___________ ;生成
 时,反应中转移电子
时,反应中转移电子___________ mol。
(2)操作b的名称是___________ 。
(3) 具有较强的氧化性,
具有较强的氧化性, 具有较强的还原性,当把
具有较强的还原性,当把 通入滤液A后,滴加几滴
通入滤液A后,滴加几滴 溶液,现象为:
溶液,现象为:___________ 。
(4)某同学想用酸性 溶液检验溶液B中是否还有
溶液检验溶液B中是否还有 ,根据题给已知信息,你认为是否合适
,根据题给已知信息,你认为是否合适___________ (填“是”或“否”)。请简述理由___________ 。
(5)经检验后溶液B中无 ,向溶液B中通入
,向溶液B中通入 后发生反应的离子方程式为
后发生反应的离子方程式为________ 。
 ,其中Cu为+2价、Fe为+2价)制取铜和三氧化二铁的工艺流程如图所示。
,其中Cu为+2价、Fe为+2价)制取铜和三氧化二铁的工艺流程如图所示。
已知:i.
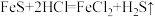
ii.

iii.
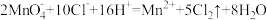
(1)高温焙烧时发生的反应是
 ,该反应中,氧化产物是
,该反应中,氧化产物是
 时,反应中转移电子
时,反应中转移电子(2)操作b的名称是
(3)
 具有较强的氧化性,
具有较强的氧化性, 具有较强的还原性,当把
具有较强的还原性,当把 通入滤液A后,滴加几滴
通入滤液A后,滴加几滴 溶液,现象为:
溶液,现象为:(4)某同学想用酸性
 溶液检验溶液B中是否还有
溶液检验溶液B中是否还有 ,根据题给已知信息,你认为是否合适
,根据题给已知信息,你认为是否合适(5)经检验后溶液B中无
 ,向溶液B中通入
,向溶液B中通入 后发生反应的离子方程式为
后发生反应的离子方程式为
您最近一年使用:0次
解题方法
4 . 高铁酸钾 是化工生产中重要的氧化剂和水处理制。
是化工生产中重要的氧化剂和水处理制。 微溶于
微溶于 溶液,在0℃至5℃碱性溶液中较稳定,在酸性或中性溶液中快速产生
溶液,在0℃至5℃碱性溶液中较稳定,在酸性或中性溶液中快速产生 。
。
(1) 在处理污水时,与水体中的
在处理污水时,与水体中的_______ 物质反应生成 。(选填“氧化性”或“还原性”)
。(选填“氧化性”或“还原性”)
(2) 再水解生成
再水解生成 胶体,起到吸附絮凝作用。这与胶体的
胶体,起到吸附絮凝作用。这与胶体的_______ 有关。
(3)干法制备高铁酸钾:
第一步:
第二步: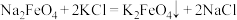 。
。
①第一步反应的氧化产物为_______ 、_______ ,氧化剂和还原剂的物质的量之比为_______ 。
②运用所学知识解释第二步反应能发生的原因_______ 。
(4)湿法制备: (该反应放热)。某小组采用如下装置(部分装置略)制备高铁酸钾
(该反应放热)。某小组采用如下装置(部分装置略)制备高铁酸钾 。
。
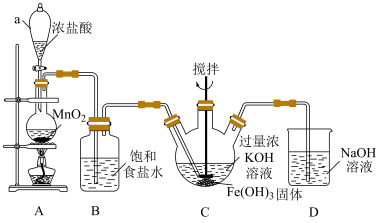
①仪器a若换为_______ (填写仪器名称),则能平衡压强,有利于液体顺利滴下。
②装置B中饱和食盐水的作用是_______ 。
③装置C中 溶液过量的目的是
溶液过量的目的是_______ 。有同学提出,装置C存在一定缺陷。改进的措施是_______ 。
④装置D的作用是_______ 。
⑤实验完毕后,对C装置中混合液进行_______ ,即可得到 。
。
A.蒸发结晶、趁热过滤、洗涤、低温干燥
B.蒸发结晶、趁热过滤、洗涤、高温干燥
C.蒸发浓缩、冷却结晶、过滤、洗涤、低温干燥
D.蒸发浓缩、冷却结晶、过滤、洗涤、高温干燥
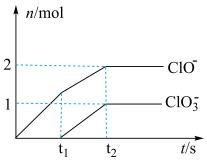
⑥若向装置D中通入一定量氯气,恰好完全反应。生成物中若含有三种含氧元素的离子,其中 、
、 ,两种离子的物质的量(n)与反应时间(t)的曲线如图所示。则参与反应的
,两种离子的物质的量(n)与反应时间(t)的曲线如图所示。则参与反应的 的物质的量为
的物质的量为_______ mol。
 是化工生产中重要的氧化剂和水处理制。
是化工生产中重要的氧化剂和水处理制。 微溶于
微溶于 溶液,在0℃至5℃碱性溶液中较稳定,在酸性或中性溶液中快速产生
溶液,在0℃至5℃碱性溶液中较稳定,在酸性或中性溶液中快速产生 。
。(1)
 在处理污水时,与水体中的
在处理污水时,与水体中的 。(选填“氧化性”或“还原性”)
。(选填“氧化性”或“还原性”)(2)
 再水解生成
再水解生成 胶体,起到吸附絮凝作用。这与胶体的
胶体,起到吸附絮凝作用。这与胶体的| A.丁达尔现象 | B.电泳 | C.聚沉 | D.布朗运动 |
(3)干法制备高铁酸钾:
第一步:

第二步:
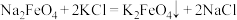 。
。①第一步反应的氧化产物为
②运用所学知识解释第二步反应能发生的原因
(4)湿法制备:
 (该反应放热)。某小组采用如下装置(部分装置略)制备高铁酸钾
(该反应放热)。某小组采用如下装置(部分装置略)制备高铁酸钾 。
。
①仪器a若换为
②装置B中饱和食盐水的作用是
③装置C中
 溶液过量的目的是
溶液过量的目的是④装置D的作用是
⑤实验完毕后,对C装置中混合液进行
 。
。A.蒸发结晶、趁热过滤、洗涤、低温干燥
B.蒸发结晶、趁热过滤、洗涤、高温干燥
C.蒸发浓缩、冷却结晶、过滤、洗涤、低温干燥
D.蒸发浓缩、冷却结晶、过滤、洗涤、高温干燥
⑥若向装置D中通入一定量氯气,恰好完全反应。生成物中若含有三种含氧元素的离子,其中
 、
、 ,两种离子的物质的量(n)与反应时间(t)的曲线如图所示。则参与反应的
,两种离子的物质的量(n)与反应时间(t)的曲线如图所示。则参与反应的 的物质的量为
的物质的量为
您最近一年使用:0次
名校
5 . 印刷电路板(PCB)是用腐蚀液( 溶液)将覆铜板上的部分铜腐蚀而制得。一种制作PCB并将腐蚀后废液(金属离子主要含
溶液)将覆铜板上的部分铜腐蚀而制得。一种制作PCB并将腐蚀后废液(金属离子主要含 、
、 、
、 )回收再生的流程如下。
)回收再生的流程如下。

(1)腐蚀池中发生反应的离子方程式是___________ 。
(2)上述各池中,没有发生化学变化的是___________ 池。
(3)置换池中发生反应的离子方程式有___________ 、___________ 。
(4)向再生池中通入 可以使废液再生,离子方程式是
可以使废液再生,离子方程式是___________ ;工业上通常用双氧水代替 ,这样做的优点是
,这样做的优点是___________ 。
(5)以 作为铁源制备
作为铁源制备 ,可用于去除水体中的As(Ⅲ)。已知:
,可用于去除水体中的As(Ⅲ)。已知: 微溶于水,在酸性或中性溶液中迅速氧化
微溶于水,在酸性或中性溶液中迅速氧化 产生
产生 ,在碱性溶液中较稳定,在
,在碱性溶液中较稳定,在 和
和 催化作用下发生分解。
催化作用下发生分解。 氧化性随溶液碱性增强而减弱。某水样中As元素主要以As(Ⅲ)存在,As(Ⅲ)可被
氧化性随溶液碱性增强而减弱。某水样中As元素主要以As(Ⅲ)存在,As(Ⅲ)可被 氧化为As(Ⅴ),更容易通过Fe(Ⅲ)吸附去除。
氧化为As(Ⅴ),更容易通过Fe(Ⅲ)吸附去除。
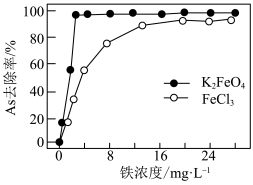
① 对水中As元素的去除率随pH变化如图所示,当pH大于7时,As去除率迅速下降的原因是
对水中As元素的去除率随pH变化如图所示,当pH大于7时,As去除率迅速下降的原因是___________ 。

② 也能去除水中As。pH=6.5时,加入
也能去除水中As。pH=6.5时,加入 或
或 后水中铁浓度对As去除率的影响如图所示,铁浓度相同,使用
后水中铁浓度对As去除率的影响如图所示,铁浓度相同,使用 时As去除率比使用
时As去除率比使用 时高的原因是
时高的原因是___________ 。
 溶液)将覆铜板上的部分铜腐蚀而制得。一种制作PCB并将腐蚀后废液(金属离子主要含
溶液)将覆铜板上的部分铜腐蚀而制得。一种制作PCB并将腐蚀后废液(金属离子主要含 、
、 、
、 )回收再生的流程如下。
)回收再生的流程如下。
(1)腐蚀池中发生反应的离子方程式是
(2)上述各池中,没有发生化学变化的是
(3)置换池中发生反应的离子方程式有
(4)向再生池中通入
 可以使废液再生,离子方程式是
可以使废液再生,离子方程式是 ,这样做的优点是
,这样做的优点是(5)以
 作为铁源制备
作为铁源制备 ,可用于去除水体中的As(Ⅲ)。已知:
,可用于去除水体中的As(Ⅲ)。已知: 微溶于水,在酸性或中性溶液中迅速氧化
微溶于水,在酸性或中性溶液中迅速氧化 产生
产生 ,在碱性溶液中较稳定,在
,在碱性溶液中较稳定,在 和
和 催化作用下发生分解。
催化作用下发生分解。 氧化性随溶液碱性增强而减弱。某水样中As元素主要以As(Ⅲ)存在,As(Ⅲ)可被
氧化性随溶液碱性增强而减弱。某水样中As元素主要以As(Ⅲ)存在,As(Ⅲ)可被 氧化为As(Ⅴ),更容易通过Fe(Ⅲ)吸附去除。
氧化为As(Ⅴ),更容易通过Fe(Ⅲ)吸附去除。①
 对水中As元素的去除率随pH变化如图所示,当pH大于7时,As去除率迅速下降的原因是
对水中As元素的去除率随pH变化如图所示,当pH大于7时,As去除率迅速下降的原因是
②
 也能去除水中As。pH=6.5时,加入
也能去除水中As。pH=6.5时,加入 或
或 后水中铁浓度对As去除率的影响如图所示,铁浓度相同,使用
后水中铁浓度对As去除率的影响如图所示,铁浓度相同,使用 时As去除率比使用
时As去除率比使用 时高的原因是
时高的原因是
您最近一年使用:0次
名校
6 . 铁和铬都位于周期表的第四周期,它们的单质及其化合物有多种用途。
(1)电子工业中,人们常用 溶液腐蚀附在绝缘板上的铜箔,制造印刷电路板。
溶液腐蚀附在绝缘板上的铜箔,制造印刷电路板。
①请用化学方程式表示制造印刷电路板的反应原理___________ 。
为了从腐蚀废液中回收铜并重新获得 溶液,可采用以下步骤:
溶液,可采用以下步骤:
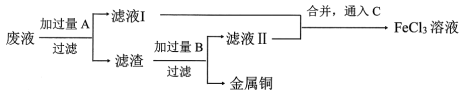
②写出回收铜并重新获得 溶液的过程中加入的有关物质的化学式:
溶液的过程中加入的有关物质的化学式:
A___________ ,B___________ ,C___________ 。
③滤液Ⅰ中的阳离子既有氧化性又有还原性,判断的依据是___________ 。为证明该阳离子的还原性,可选用___________ (填“锌片”、“酸性 溶液”或“NaOH溶液”)进行实验探究,发生反应的离子方程式为
溶液”或“NaOH溶液”)进行实验探究,发生反应的离子方程式为___________ 。
④上述步骤中,通入C发生反应的离子方程式为___________ 。
(2)可用绿矾 处理工业废水中有毒的
处理工业废水中有毒的 ,反应的离子方程式为:
,反应的离子方程式为: ,该反应中,还原剂是
,该反应中,还原剂是___________ (填离子符号,下同),被还原的是___________ 。
(3)醋酸亚铬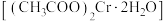 是一种氧气吸收剂,难溶于冷水,易溶于盐酸,它的一种制备原理可表示为:
是一种氧气吸收剂,难溶于冷水,易溶于盐酸,它的一种制备原理可表示为:
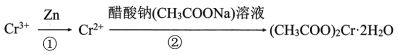
写出上述原理中两个反应的离子方程式①___________ ;②___________ 。
(1)电子工业中,人们常用
 溶液腐蚀附在绝缘板上的铜箔,制造印刷电路板。
溶液腐蚀附在绝缘板上的铜箔,制造印刷电路板。①请用化学方程式表示制造印刷电路板的反应原理
为了从腐蚀废液中回收铜并重新获得
 溶液,可采用以下步骤:
溶液,可采用以下步骤:
②写出回收铜并重新获得
 溶液的过程中加入的有关物质的化学式:
溶液的过程中加入的有关物质的化学式:A
③滤液Ⅰ中的阳离子既有氧化性又有还原性,判断的依据是
 溶液”或“NaOH溶液”)进行实验探究,发生反应的离子方程式为
溶液”或“NaOH溶液”)进行实验探究,发生反应的离子方程式为④上述步骤中,通入C发生反应的离子方程式为
(2)可用绿矾
 处理工业废水中有毒的
处理工业废水中有毒的 ,反应的离子方程式为:
,反应的离子方程式为: ,该反应中,还原剂是
,该反应中,还原剂是(3)醋酸亚铬
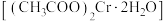 是一种氧气吸收剂,难溶于冷水,易溶于盐酸,它的一种制备原理可表示为:
是一种氧气吸收剂,难溶于冷水,易溶于盐酸,它的一种制备原理可表示为: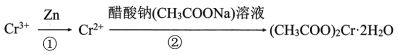
写出上述原理中两个反应的离子方程式①
您最近一年使用:0次
2023-03-16更新
|
554次组卷
|
2卷引用:广东省广州市六区2022-2023学年高一上学期期末教学质量监测化学试题
7 . 高铁酸钾(K2FeO4)是一种暗紫色固体,低温碱性条件下比较稳定。高铁酸钾微溶于浓KOH溶液,能溶于水,且能与水反应放出氧气,并生成Fe(OH)3胶体,常用作水处理剂。高铁酸钾有强氧化性,酸性条件下,其氧化性强于Cl2、KMnO4等。工业上湿法制备K2FeO4的流程如下:
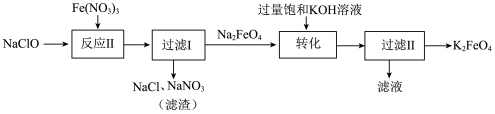
下列说法错误的是

下列说法错误的是
| A.过滤操作需要用到的玻璃仪器有普通漏斗、玻璃棒和烧杯 |
| B.K2FeO4与水反应,每生成1个O2转移4个电子 |
| C.将K2FeO4与盐酸混合使用,会降低其杀菌消毒的效果 |
| D.“反应Ⅰ”中,氧化剂和还原剂的个数之比为2:3 |
您最近一年使用:0次
解题方法
8 . 完成下列问题。
I.海带中含有丰富的碘,从海带中提取碘,某学习小组设计并进行以下实验:
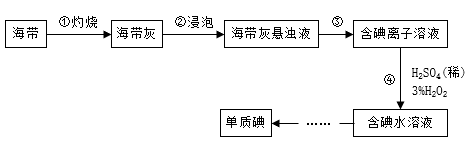
(1)步骤③的实验操作为______ (填实验名称),此过程使用玻璃棒,玻璃棒的作用是____________ 。
(2)步骤④的离子反应方程式为:H2O2+2H++2I-=I2+2H2O。该离子反应中的氧化剂是________ ,还原剂是_______ 。
(3)步骤④得到的含碘水溶液中滴加淀粉溶液,溶液呈现_______ 色,说明有碘单质产生。
II.碘称为“智力元素”。过去食盐中KI作为加碘剂,但由于空气中氧气的作用,容易引起碘的损失,I-被氧气氧化成碘单质(I2),同时得到强碱性物质。
(4)写出潮湿环境下KI与氧气反应的化学方程式:_______ 。
现在的食盐里改添加性质稳定的KIO3,以满足人们需要。几种粒子之间有如图所示关系:
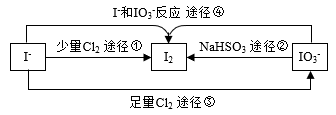
(5)四个途径中属于氧化还原反应的是______ (填序号)。
(6)在碱性条件下碘酸钾能被氯气氧化为高碘酸钾(KIO4),反应方程式为:Cl2+KIO3+2KOH=2KCl+KIO4+H2O,写出该反应的离子方程式:________ 。
(7)比较I2、 和Cl2的氧化性强弱:
和Cl2的氧化性强弱:_________ 。
I.海带中含有丰富的碘,从海带中提取碘,某学习小组设计并进行以下实验:

(1)步骤③的实验操作为
(2)步骤④的离子反应方程式为:H2O2+2H++2I-=I2+2H2O。该离子反应中的氧化剂是
(3)步骤④得到的含碘水溶液中滴加淀粉溶液,溶液呈现
II.碘称为“智力元素”。过去食盐中KI作为加碘剂,但由于空气中氧气的作用,容易引起碘的损失,I-被氧气氧化成碘单质(I2),同时得到强碱性物质。
(4)写出潮湿环境下KI与氧气反应的化学方程式:
现在的食盐里改添加性质稳定的KIO3,以满足人们需要。几种粒子之间有如图所示关系:

(5)四个途径中属于氧化还原反应的是
(6)在碱性条件下碘酸钾能被氯气氧化为高碘酸钾(KIO4),反应方程式为:Cl2+KIO3+2KOH=2KCl+KIO4+H2O,写出该反应的离子方程式:
(7)比较I2、
 和Cl2的氧化性强弱:
和Cl2的氧化性强弱:
您最近一年使用:0次
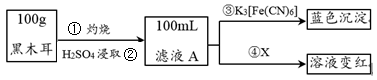
9 . 黑木耳富含蛋白质、铁、具有还原性的维生素C等,每100 g黑木耳含铁量高达185 mg。
I.为了确定黑木耳中含有铁元素,甲同学设计实验方案如下。____________ 。
(2)步骤④检验Fe3+所用试剂是_____________ (填化学式)溶液。
(3)已知:3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓,则滤液A中大量含有的阳离子 的离子符号为____________ 。
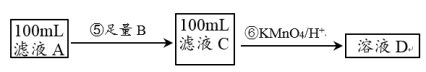
II.紫色的KMnO4溶液在酸性条件下具有强氧化性,其还原产物是无色的Mn2+。本实验用KMnO4酸性溶液来测定黑木耳中铁元素的含量,乙同学设计实验方案如下。_______ (填序号)。
a.Na b.Cu c.Fe
(5)步骤⑥的离子方程式为_______________ 。
(6)若乙同学实验操作规范,但测得含铁量远远偏高,其可能的原因是_______________ 。
I.为了确定黑木耳中含有铁元素,甲同学设计实验方案如下。
(2)步骤④检验Fe3+所用试剂是
(3)已知:3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓,则滤液A中大量含有的
II.紫色的KMnO4溶液在酸性条件下具有强氧化性,其还原产物是无色的Mn2+。本实验用KMnO4酸性溶液来测定黑木耳中铁元素的含量,乙同学设计实验方案如下。
a.Na b.Cu c.Fe
(5)步骤⑥的离子方程式为
(6)若乙同学实验操作规范,但测得含铁量远远偏高,其可能的原因是
您最近一年使用:0次
名校
10 . 用覆铜板制作印刷电路板的原理是:利用 FeCl3溶液作为“腐蚀液”,将覆铜板上不需要的铜腐蚀。为了减少污染并变废为宝,实现资源的合理利用,现对使用后的“腐蚀液”处理流程如图:

请回答下列问题:
(1)用氯化铁溶液刻蚀覆铜板制作印刷电路板体现了 Fe3+的_______ (填“还原性”或“氧化性”)发生反应的离子方程式为_______ 。
(2)“溶液 1”即为“使用后的腐蚀液”,其中含有的金属阳离子有_______ 。
(3)“操作 a”为_______ ,“固体”的成分为_______ (填化学式)。
(4)如何检验“溶液 2”中不含 Fe3+_______ 。
(5)若“试剂①”为氯水,则“溶液 2” 转化为“溶液 3”的离子方程式为_______ 。
(6)H2O2是一种常用的绿色氧化剂。将“试剂①”改为 H2O2,酸性条件下也能实现“溶液 2” 转化为“溶液 3”,则发生反应的离子方程式为_______

请回答下列问题:
(1)用氯化铁溶液刻蚀覆铜板制作印刷电路板体现了 Fe3+的
(2)“溶液 1”即为“使用后的腐蚀液”,其中含有的金属阳离子有
(3)“操作 a”为
(4)如何检验“溶液 2”中不含 Fe3+
(5)若“试剂①”为氯水,则“溶液 2” 转化为“溶液 3”的离子方程式为
(6)H2O2是一种常用的绿色氧化剂。将“试剂①”改为 H2O2,酸性条件下也能实现“溶液 2” 转化为“溶液 3”,则发生反应的离子方程式为
您最近一年使用:0次



