名校
解题方法
1 . 海水是一个巨大的化学资源宝库。实验室模拟从海水中提取溴,设计实验流程如下:

(1)海水中的溴元素存在形式是___________ (填“游离态”或“化合态”)。
(2)步骤(Ⅰ)中分离粗盐和母液的操作名称是___________ ,该操作使用的玻璃仪器有烧杯、玻璃棒和___________ 。
(3)①步骤(Ⅳ)中主要反应的离子方程式为:__________ (配平该离子方程式)
___________Br- +___________BrO +___________H+= ___________Br2+___________H2O
+___________H+= ___________Br2+___________H2O
②该反应的还原剂与氧化剂的物质的量之比是___________ ,可推断氧化性:BrO
______  (填“>”或“<”),若生成0.2molBr2,则转移的电子数目为
(填“>”或“<”),若生成0.2molBr2,则转移的电子数目为___________ 个。
(4)为了除去粗盐中Mg2+、Ca2+、SO 及泥沙,先将粗盐溶于水,过滤后根据除杂原理,在表中填写除杂时依次添加的试剂及其预期沉淀的离子。
及泥沙,先将粗盐溶于水,过滤后根据除杂原理,在表中填写除杂时依次添加的试剂及其预期沉淀的离子。

(1)海水中的溴元素存在形式是
(2)步骤(Ⅰ)中分离粗盐和母液的操作名称是
(3)①步骤(Ⅳ)中主要反应的离子方程式为:
___________Br- +___________BrO
 +___________H+= ___________Br2+___________H2O
+___________H+= ___________Br2+___________H2O②该反应的还原剂与氧化剂的物质的量之比是

 (填“>”或“<”),若生成0.2molBr2,则转移的电子数目为
(填“>”或“<”),若生成0.2molBr2,则转移的电子数目为(4)为了除去粗盐中Mg2+、Ca2+、SO
 及泥沙,先将粗盐溶于水,过滤后根据除杂原理,在表中填写除杂时依次添加的试剂及其预期沉淀的离子。
及泥沙,先将粗盐溶于水,过滤后根据除杂原理,在表中填写除杂时依次添加的试剂及其预期沉淀的离子。| 实验步骤 | 试剂 | 预期沉淀的离子 |
| 步骤1 | BaCl2溶液 | SO |
| 步骤2 | ||
| 步骤3 |
您最近一年使用:0次
解题方法
2 . 海水中的溴元素以Br-形式存在,工业上用“吹出法”从海水中提取溴的工艺流程如下图。

请回答下列问题:
(1)氯气与海水中的Br-发生反应的离子方程式是_______ 。
(2)吹出塔中用热空气吹出Br2,是利用了Br2的_______ (填序号)。
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(3)吸收塔中用SO2的水溶液吸收Br2,吸收率可达95%,有关反应的化学方程式是_______ ,其中的氧化剂是_______ 。
(4)蒸馏塔中再次通入氯气的目的是_______ 。
(5)在整个生产过程中应注意解决的问题是_______ 。

请回答下列问题:
(1)氯气与海水中的Br-发生反应的离子方程式是
(2)吹出塔中用热空气吹出Br2,是利用了Br2的
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(3)吸收塔中用SO2的水溶液吸收Br2,吸收率可达95%,有关反应的化学方程式是
(4)蒸馏塔中再次通入氯气的目的是
(5)在整个生产过程中应注意解决的问题是
您最近一年使用:0次
名校
解题方法
3 . 海洋是生命的摇篮,海水不仅是宝贵的水资源,而且蕴藏着丰富的化学资源。从海水中提取淡水和一些重要的化工产品的工艺流程如图所示。

根据上述流程图回答下列问题:
(1)写出反应①的化学反应方程式_______ 。
(2)工业上完成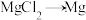 常用的冶炼方法
常用的冶炼方法_______ 。
(3)通入热空气或水蒸气吹出 ,利用了溴的
,利用了溴的_______ (填序号)。
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(4)写出步骤Ⅱ反应的离子方程式_______ 。
(5)从海水中获得淡水的主要方法有电渗析法、离子交换法和_______ (填一种)。
(6)实验室模拟海水蒸馏法制取淡水,蒸馏过程中不可能用到的仪器有_______ (填序号)。
A.圆底烧瓶 B.容量瓶 C.直形冷凝管 D.接收器
(7)离子交换法净化水的过程如图所示。下列说法正确的是_______ (填序号)。

A.经过阳离子交换树脂后,水中阳离子总数减少
B.通过阴离子交换树脂后,水中只有 被除去
被除去
C.通过净化处理后的水,导电性增强
D.阴离子交换树脂填充段存在反应:

根据上述流程图回答下列问题:
(1)写出反应①的化学反应方程式
(2)工业上完成
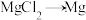 常用的冶炼方法
常用的冶炼方法(3)通入热空气或水蒸气吹出
 ,利用了溴的
,利用了溴的A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(4)写出步骤Ⅱ反应的离子方程式
(5)从海水中获得淡水的主要方法有电渗析法、离子交换法和
(6)实验室模拟海水蒸馏法制取淡水,蒸馏过程中不可能用到的仪器有
A.圆底烧瓶 B.容量瓶 C.直形冷凝管 D.接收器
(7)离子交换法净化水的过程如图所示。下列说法正确的是

A.经过阳离子交换树脂后,水中阳离子总数减少
B.通过阴离子交换树脂后,水中只有
 被除去
被除去C.通过净化处理后的水,导电性增强
D.阴离子交换树脂填充段存在反应:

您最近一年使用:0次
21-22高一上·江苏镇江·阶段练习
解题方法
4 . 茫茫大海是化学元素溴的“故乡”,海水中澳的含量约为67 mg/L。从海水中提取油的工业流程如下:

(1)步骤I中已获得了游离态的溴,步骤II中又将之转变成化合态的溴,其目的是___________ 。
(2)步骤II中通入热空气或水蒸气吹出Br2,利用了溴的___________ (填字母)。
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(3)上述流程中吹出的溴蒸气也可先用SO2水溶液吸收,反应生成HBr和H2SO4,该反应中的氧化剂是___________ , 还原剂是___________ ,然后用氯气氧化上述反应的产物后蒸馏,写出氯气氧化HBr的化学方程式:___________ 。

(1)步骤I中已获得了游离态的溴,步骤II中又将之转变成化合态的溴,其目的是
(2)步骤II中通入热空气或水蒸气吹出Br2,利用了溴的
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(3)上述流程中吹出的溴蒸气也可先用SO2水溶液吸收,反应生成HBr和H2SO4,该反应中的氧化剂是
您最近一年使用:0次
5 . 从烟气脱硝催化剂(SCR)中回收金属元素可实现资源的循环利用。一种从废弃SCR(主要含 、
、 、
、 、
、 、
、 )中回收金属钒和钨的流程如下:
)中回收金属钒和钨的流程如下:
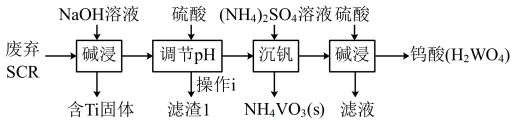
请回答下列问题:
(1)为了加快“碱浸”的速率,可采取的措施有_______ (任填一种)。“碱浸”时,滤液中的阴子除 、
、 、
、 外还有
外还有_______ 。
(2)操作ⅰ的名称为_______ ;滤渣1的主要成分为_______ (填化学式)。
(3)常温下,钨酸是一种难溶于水的弱酸。“沉钨”过程中发生反应的离子方程式为_______ 。
(4)已知:钒元素常见的化合价及其在水溶液中的存在形式如下:
 具有强氧化性,可与浓盐酸发生反应生成气体单质,该反应中氧化剂与还原剂的物质的量之比为1:2,则反应的离子方程式为
具有强氧化性,可与浓盐酸发生反应生成气体单质,该反应中氧化剂与还原剂的物质的量之比为1:2,则反应的离子方程式为_______ 。
(5)假设实验过程钨元素没有损失,以a g废弃SCR为原料制得b g钨酸,则废弃SCR中钨的含量为_______ (用含a、b的式子表示)
 、
、 、
、 、
、 、
、 )中回收金属钒和钨的流程如下:
)中回收金属钒和钨的流程如下:
请回答下列问题:
(1)为了加快“碱浸”的速率,可采取的措施有
 、
、 、
、 外还有
外还有(2)操作ⅰ的名称为
(3)常温下,钨酸是一种难溶于水的弱酸。“沉钨”过程中发生反应的离子方程式为
(4)已知:钒元素常见的化合价及其在水溶液中的存在形式如下:
| 价态 | +5 | +4 | +3 | +2 |
| 存在形式 |  (碱性) (碱性)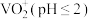 |  | 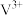 |  |
 具有强氧化性,可与浓盐酸发生反应生成气体单质,该反应中氧化剂与还原剂的物质的量之比为1:2,则反应的离子方程式为
具有强氧化性,可与浓盐酸发生反应生成气体单质,该反应中氧化剂与还原剂的物质的量之比为1:2,则反应的离子方程式为(5)假设实验过程钨元素没有损失,以a g废弃SCR为原料制得b g钨酸,则废弃SCR中钨的含量为
您最近一年使用:0次
解题方法
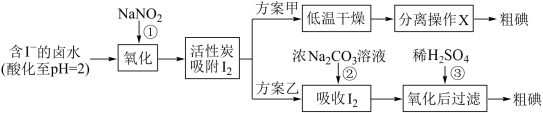
6 . 从海水中可以提取很多有用的物质,例如从海水制盐所得到的卤水中可以提取碘 。活性炭吸附法是工业提碘的方法之一,其流程如下:
资料显示:
I.pH=2时,NaNO2溶液只能将I-氧化为I2,同时生成 NO
II. I2+5Cl2+6H2O = 2HIO3+10HCl,5 +2
+2 +2H+ = I2+5
+2H+ = I2+5 +H2O
+H2O
(1)反应①的离子方程式_______________ 。
(2)方案甲中,根据I2的特性,分离操作 X 的方法是_______ 。
(3)已知:反应②中每吸收3molI2转移5mol电子,离子方程式是_________ 。
(4)Cl2、酸性 KMnO4等都是常用的强氧化剂,但该工艺中氧化卤水中的I-却选择了价格较高的NaNO2,原因是________ 。

资料显示:
I.pH=2时,NaNO2溶液只能将I-氧化为I2,同时生成 NO
II. I2+5Cl2+6H2O = 2HIO3+10HCl,5
 +2
+2 +2H+ = I2+5
+2H+ = I2+5 +H2O
+H2O(1)反应①的离子方程式
(2)方案甲中,根据I2的特性,分离操作 X 的方法是
(3)已知:反应②中每吸收3molI2转移5mol电子,离子方程式是
(4)Cl2、酸性 KMnO4等都是常用的强氧化剂,但该工艺中氧化卤水中的I-却选择了价格较高的NaNO2,原因是
您最近一年使用:0次
名校
解题方法
7 . 地下卤水含有丰富的化学资源,可用于生产粗盐、粗溴、粗碘等产品。
(1)粗盐一般含有NaCl、 、
、 和
和 等杂质。从粗盐制得精盐的过程如下:
等杂质。从粗盐制得精盐的过程如下:

请回答下列问题:
① 的电离方程式为
的电离方程式为___________ 。
②试剂I是___________ (填化学式)。
③加入试剂III产生气体的离子方程式为___________ 。
④操作c的名称为___________ ,操作b能否省略___________ (填“能”或“否”),其理由为___________ 。
⑤设计实验说明所得溶液B中是否含有 :
:___________ 。
(2)地下卤水经过处理得到“析钠母液”,进一步提纯的工艺流程如下:

已知:①“析钠母液”主要含有 、
、 、
、 、
、 等。
等。
②氧化性: ,
, 为易挥发的红棕色液体,
为易挥发的红棕色液体, 为紫黑色固体
为紫黑色固体
回答下列问题:
①往“析钠母液”中,通入少量氯气时,主要发生反应的离子方程式为___________ 。
②“碱液吸收”中,发生反应: (未配平)。配平上述反应,并用单线桥或双线桥法表示该反应电子转移的方向和数目,
(未配平)。配平上述反应,并用单线桥或双线桥法表示该反应电子转移的方向和数目,___________ 若生成4.8g溴单质时,转移电子数目为___________  。
。
③“氧化析碘”中,氧化产物和还原产物的物质的量之比为___________ 。
(1)粗盐一般含有NaCl、
 、
、 和
和 等杂质。从粗盐制得精盐的过程如下:
等杂质。从粗盐制得精盐的过程如下:
请回答下列问题:
①
 的电离方程式为
的电离方程式为②试剂I是
③加入试剂III产生气体的离子方程式为
④操作c的名称为
⑤设计实验说明所得溶液B中是否含有
 :
:(2)地下卤水经过处理得到“析钠母液”,进一步提纯的工艺流程如下:

已知:①“析钠母液”主要含有
 、
、 、
、 、
、 等。
等。②氧化性:
 ,
, 为易挥发的红棕色液体,
为易挥发的红棕色液体, 为紫黑色固体
为紫黑色固体回答下列问题:
①往“析钠母液”中,通入少量氯气时,主要发生反应的离子方程式为
②“碱液吸收”中,发生反应:
 (未配平)。配平上述反应,并用单线桥或双线桥法表示该反应电子转移的方向和数目,
(未配平)。配平上述反应,并用单线桥或双线桥法表示该反应电子转移的方向和数目, 。
。③“氧化析碘”中,氧化产物和还原产物的物质的量之比为
您最近一年使用:0次
名校
解题方法
8 . 某校探究性学习小组用已部分生锈的废铁屑制作印刷电路板的腐蚀剂,并回收铜。探究过程如下(其中步骤①是除去表面油污),请回答下列问题:

(1)操作甲的名称是_______________ 。
(2)步骤②中,除发生反应 Fe+2HCl=FeCl2+H2↑外,其他可能反应的离子方程式为___________ 。
(3)步骤③反应为 2Fe2++Cl2=2Fe3++2Cl-,请用单线桥法表示电子转移_______ ,氧化剂与还原剂的物质的量之比是_____ 。
(4)已知步骤④发生的反应为 2FeCl3+Cu=2FeCl2+CuCl2,该反应的离子方程式为______________ 。
(5)关于反应 2FeCl3+Cu=2FeCl2+CuCl2,下列说法正确的是_________ 。
A.氧化性强弱顺序 FeCl3强于 CuCl2
B.还原性强弱顺序 Cu 强于 FeCl2
C.FeCl3在反应中失去电子
D.CuCl2是氧化产物

(1)操作甲的名称是
(2)步骤②中,除发生反应 Fe+2HCl=FeCl2+H2↑外,其他可能反应的离子方程式为
(3)步骤③反应为 2Fe2++Cl2=2Fe3++2Cl-,请用单线桥法表示电子转移
(4)已知步骤④发生的反应为 2FeCl3+Cu=2FeCl2+CuCl2,该反应的离子方程式为
(5)关于反应 2FeCl3+Cu=2FeCl2+CuCl2,下列说法正确的是
A.氧化性强弱顺序 FeCl3强于 CuCl2
B.还原性强弱顺序 Cu 强于 FeCl2
C.FeCl3在反应中失去电子
D.CuCl2是氧化产物
您最近一年使用:0次
名校
解题方法
9 . 中国有广阔的海岸线,建设发展海洋经济、海水的综合利用大有可为。空气吹出法工艺,是目前“海水提溴”的最主要方法之一,其工艺流程如下图所示,试回答下列问题:
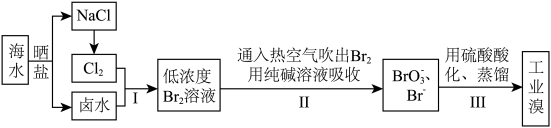
(1)海水日晒得到的盐因为含有较多杂质,称为粗盐。为了得到精制盐,可以用_______ 的办法除去其中的泥沙等不溶物。
(2)以上步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将之转变成化合态的溴,其目的是____________ 。
(3)步骤②通入热空气或水蒸气吹出Br2,利用了溴的________ 。
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(4)流程Ⅱ中涉及的离子反应方程式如下,请在下面横线内填入适当的化学计量数:___ Br2+___  =
= ___  +
+___ Br-+___ CO2↑
(5)上述流程中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏。写出溴与二氧化硫水溶液反应的离子方程式:___________________ 。
(6)流程Ⅲ蒸馏过程中,温度应控制在80~90℃。温度过高或过低都不利于生产,请解释原因:________________________ 。

(1)海水日晒得到的盐因为含有较多杂质,称为粗盐。为了得到精制盐,可以用
(2)以上步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将之转变成化合态的溴,其目的是
(3)步骤②通入热空气或水蒸气吹出Br2,利用了溴的
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(4)流程Ⅱ中涉及的离子反应方程式如下,请在下面横线内填入适当的化学计量数:
 =
=  +
+(5)上述流程中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏。写出溴与二氧化硫水溶液反应的离子方程式:
(6)流程Ⅲ蒸馏过程中,温度应控制在80~90℃。温度过高或过低都不利于生产,请解释原因:
您最近一年使用:0次
2020-10-09更新
|
272次组卷
|
3卷引用:广东省湛江市2018-2019学年高一下学期期末考试化学试题
解题方法
10 . 从海水中可以提取很多有用的物质,例如从海水制盐所得到的卤水中可以提取碘。活性炭吸附法是工业提取碘的方法之一,其流程如下:

资料显示:
Ⅰ.pH=2 时, NaNO2溶液只能将 I-氧化为 I2,同时生成 NO;
Ⅱ.I2+5Cl2+6H2O=2HIO3+10HCl;
Ⅲ.I2在碱性溶液中反应生成I-和IO3-。
(1)反应①的离子方程式_____ 。
(2)方案甲中,根据 I2的特性,分离操作 X 的名称是_____ 。
(3)Cl2、酸性 KMnO4等都是常用的强氧化剂,但该工艺中氧化卤水中的 I-却选择了价格较高的NaNO2,原因是_____ 。
(4)方案乙中,已知反应③过滤后,滤液中仍存在少量的 I2、I-、IO3-。 请检验滤液中的I-,将实验方案补充完整。实验中可供选择的试剂:稀 H2SO4、淀粉溶液、Fe2(SO4)3溶液。
A.滤液用CCl4多次萃取、分液,直到水层用淀粉溶液检验不出碘单质存在。
B._____ 。

资料显示:
Ⅰ.pH=2 时, NaNO2溶液只能将 I-氧化为 I2,同时生成 NO;
Ⅱ.I2+5Cl2+6H2O=2HIO3+10HCl;
Ⅲ.I2在碱性溶液中反应生成I-和IO3-。
(1)反应①的离子方程式
(2)方案甲中,根据 I2的特性,分离操作 X 的名称是
(3)Cl2、酸性 KMnO4等都是常用的强氧化剂,但该工艺中氧化卤水中的 I-却选择了价格较高的NaNO2,原因是
(4)方案乙中,已知反应③过滤后,滤液中仍存在少量的 I2、I-、IO3-。 请检验滤液中的I-,将实验方案补充完整。实验中可供选择的试剂:稀 H2SO4、淀粉溶液、Fe2(SO4)3溶液。
A.滤液用CCl4多次萃取、分液,直到水层用淀粉溶液检验不出碘单质存在。
B.
您最近一年使用:0次



