名校
1 . 海洋资源的开发与利用 海洋资源具有广阔的应用场景。请结合下图,回答以下问题:
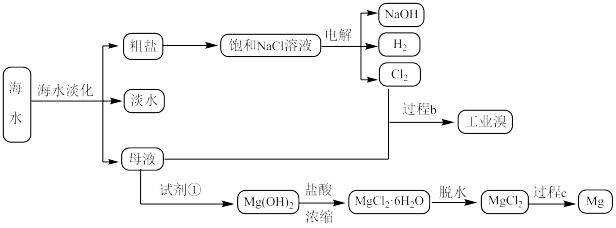
(1)海水晒盐使用的盐田法,相当于化学中的_______ 。
(2)粗盐中存在 Ca2+、Mg2+、SO 等可溶性杂质离子,要除去这些离子加入沉淀剂的顺序正确的是
等可溶性杂质离子,要除去这些离子加入沉淀剂的顺序正确的是_______ (填序号)。①过量的 Na2CO3溶液 ②过量的 BaCl2溶液 ③过量的NaOH 溶液
A.①②③ B. ②①③ C. ③②①
(3)某同学利用食盐进行化学实验,按照图 1 连接好线路发现灯泡不亮,按照图 2连接好线路发现灯泡亮,由此得出的结论正确的是_______。


(4)我国著名实业家吴蕴初建设的天原化工厂为我国第一个氯碱厂,其生产原理即为电解饱和食盐水,阴极产物为_______ 。
(5)过程b用于海水提溴。主要工业生产流程如下图所示。

①吹出塔中通入热空气吹出 Br2,利用了 Br2的_______ ,吸收塔中吸收Br2,利用了 Br2的_______ (填序号)。
A.氧化性 B.还原性 C.挥发性 D.易溶于水
②吸收塔中反应的离子方程式是_______ 。
③母液可用于海水提镁。试用电子式表示氯化镁的形成_______ 。
(6)海带中富含以I-形式存在的碘元素。实验室提取I2的途径如下所示:
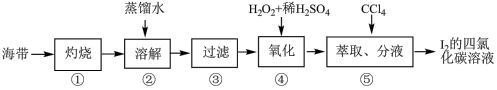
①向酸化的滤液中加过氧化氢溶液,写出该反应的离子方程式_______ 。
②选择 CCl4作萃取剂的原因是_______ ,现象为_______ 。

(1)海水晒盐使用的盐田法,相当于化学中的
(2)粗盐中存在 Ca2+、Mg2+、SO
 等可溶性杂质离子,要除去这些离子加入沉淀剂的顺序正确的是
等可溶性杂质离子,要除去这些离子加入沉淀剂的顺序正确的是A.①②③ B. ②①③ C. ③②①
(3)某同学利用食盐进行化学实验,按照图 1 连接好线路发现灯泡不亮,按照图 2连接好线路发现灯泡亮,由此得出的结论正确的是_______。


| A.NaCl 固体不导电,不是电解质 |
| B.图 2 中 NaCl 在电流作用下电离出了大量自由移动的离子 |
| C.图 2 中水是电解质,电离产生大量的H+和 OH- |
| D.电解质本身不一定能导电 |
(4)我国著名实业家吴蕴初建设的天原化工厂为我国第一个氯碱厂,其生产原理即为电解饱和食盐水,阴极产物为
(5)过程b用于海水提溴。主要工业生产流程如下图所示。

①吹出塔中通入热空气吹出 Br2,利用了 Br2的
A.氧化性 B.还原性 C.挥发性 D.易溶于水
②吸收塔中反应的离子方程式是
③母液可用于海水提镁。试用电子式表示氯化镁的形成
(6)海带中富含以I-形式存在的碘元素。实验室提取I2的途径如下所示:
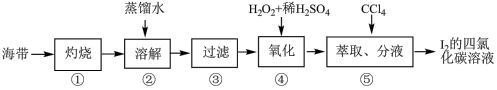
①向酸化的滤液中加过氧化氢溶液,写出该反应的离子方程式
②选择 CCl4作萃取剂的原因是
您最近一年使用:0次
2 . 碱式次氯酸镁 是一种强氧化性抗菌剂,难溶于水。用镁渣[主要含有
是一种强氧化性抗菌剂,难溶于水。用镁渣[主要含有 等]制备碱式次氯酸镁的流程如下。
等]制备碱式次氯酸镁的流程如下。

(1)“煅烧”在700℃高温下进行,煅烧得到 的同时,生成气体的化学式为
的同时,生成气体的化学式为___________ 。
(2)“溶解时需加热,反应会生成一种能使红色石蕊试纸变蓝的气体,该反应的化学方程式为___________ 。
(3)“沉淀”步骤制备 时需控制
时需控制 约为10,碱性太强会产生杂质使沉淀中镁元素含量增大,该杂质的化学式为
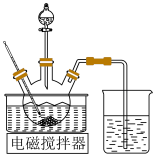
约为10,碱性太强会产生杂质使沉淀中镁元素含量增大,该杂质的化学式为________ 。用下图所示装置制备 。将
。将 晶体与
晶体与 溶液、
溶液、 溶液中的一种配成溶液,加入到三颈烧瓶中,80℃下通过滴液漏斗缓慢滴加另一种溶液,充分反应,过滤。滴液漏斗中盛放的是
溶液中的一种配成溶液,加入到三颈烧瓶中,80℃下通过滴液漏斗缓慢滴加另一种溶液,充分反应,过滤。滴液漏斗中盛放的是___________ 溶液(填化学式)。
(4)向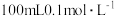 的
的 溶液中加入适量
溶液中加入适量 溶液、
溶液、 溶液,过滤,洗涤,干燥得到
溶液,过滤,洗涤,干燥得到 固体。为测定其组成,将所得固体溶于酸,再加入过量的
固体。为测定其组成,将所得固体溶于酸,再加入过量的 溶液,充分反应生成
溶液,充分反应生成 和
和 。测得生成的
。测得生成的 为
为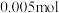 。计算
。计算 的化学式
的化学式_________ (写出计算过程)。
 是一种强氧化性抗菌剂,难溶于水。用镁渣[主要含有
是一种强氧化性抗菌剂,难溶于水。用镁渣[主要含有 等]制备碱式次氯酸镁的流程如下。
等]制备碱式次氯酸镁的流程如下。
(1)“煅烧”在700℃高温下进行,煅烧得到
 的同时,生成气体的化学式为
的同时,生成气体的化学式为(2)“溶解时需加热,反应会生成一种能使红色石蕊试纸变蓝的气体,该反应的化学方程式为
(3)“沉淀”步骤制备
 时需控制
时需控制 约为10,碱性太强会产生杂质使沉淀中镁元素含量增大,该杂质的化学式为
约为10,碱性太强会产生杂质使沉淀中镁元素含量增大,该杂质的化学式为 。将
。将 晶体与
晶体与 溶液、
溶液、 溶液中的一种配成溶液,加入到三颈烧瓶中,80℃下通过滴液漏斗缓慢滴加另一种溶液,充分反应,过滤。滴液漏斗中盛放的是
溶液中的一种配成溶液,加入到三颈烧瓶中,80℃下通过滴液漏斗缓慢滴加另一种溶液,充分反应,过滤。滴液漏斗中盛放的是
(4)向
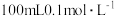 的
的 溶液中加入适量
溶液中加入适量 溶液、
溶液、 溶液,过滤,洗涤,干燥得到
溶液,过滤,洗涤,干燥得到 固体。为测定其组成,将所得固体溶于酸,再加入过量的
固体。为测定其组成,将所得固体溶于酸,再加入过量的 溶液,充分反应生成
溶液,充分反应生成 和
和 。测得生成的
。测得生成的 为
为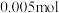 。计算
。计算 的化学式
的化学式
您最近一年使用:0次
解题方法
3 . 某工厂的工业废水中含有大量的 、较多的
、较多的 。某兴趣小组计划从该废水中回收硫酸亚铁和金属铜.请根据流程图,回答下列问题。
。某兴趣小组计划从该废水中回收硫酸亚铁和金属铜.请根据流程图,回答下列问题。
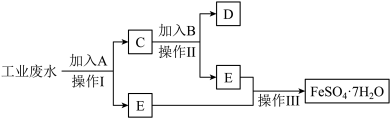
回答下列问题:
(1)A的化学式________________ C中所含物质是__________________ (填化学式)。
(2)操作I的名称是_______________ ,E是_______________________ (填化学式)。
(3)加入B后反应的离子方程式为____________________________ 。
(4)若用新制氯水和 溶液鉴定E中的金属阳离子,滴加试剂的顺序和对应现象是
溶液鉴定E中的金属阳离子,滴加试剂的顺序和对应现象是_______________ 。
(5) 古称绛矾,《新修本草》记载“绛矾本来绿色,新出窑未见风者。烧之赤色,故名绛矾矣”。下列说法错误的是________________(填标号)。
古称绛矾,《新修本草》记载“绛矾本来绿色,新出窑未见风者。烧之赤色,故名绛矾矣”。下列说法错误的是________________(填标号)。
 、较多的
、较多的 。某兴趣小组计划从该废水中回收硫酸亚铁和金属铜.请根据流程图,回答下列问题。
。某兴趣小组计划从该废水中回收硫酸亚铁和金属铜.请根据流程图,回答下列问题。
回答下列问题:
(1)A的化学式
(2)操作I的名称是
(3)加入B后反应的离子方程式为
(4)若用新制氯水和
 溶液鉴定E中的金属阳离子,滴加试剂的顺序和对应现象是
溶液鉴定E中的金属阳离子,滴加试剂的顺序和对应现象是(5)
 古称绛矾,《新修本草》记载“绛矾本来绿色,新出窑未见风者。烧之赤色,故名绛矾矣”。下列说法错误的是________________(填标号)。
古称绛矾,《新修本草》记载“绛矾本来绿色,新出窑未见风者。烧之赤色,故名绛矾矣”。下列说法错误的是________________(填标号)。| A.缺铁性贫血往往口服硫酸亚铁,当用硫酸亚铁制成药片时,外表包有一层特殊的糖衣,其作用是防止硫酸亚铁被氧化 |
B.利用焰色试验,透过蓝色钴玻璃观察到紫色火焰,说明绛矾样品中含 |
C. 既有氧化性又有还原性还有硫酸盐的性质 既有氧化性又有还原性还有硫酸盐的性质 |
D. 属于混合物 属于混合物 |
您最近一年使用:0次
名校
解题方法
4 . 以海水为原料,工业制溴的流程如下:

(1)以上步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将之转变成化合态的溴,其目的是_______ 。
(2)实验室保存液溴时,通常在盛液溴的试剂瓶中加少量的水,这与液溴的_______ 性质有关(填序号)。
A.氧化性 B.还原性 C.挥发性 D.腐蚀性 E.密度比水大
(3)流程Ⅱ中将吹出的溴蒸气用浓纯碱溶液吸收时除了生成 、
、 外,还有
外,还有 生成,试写出吸收时发生反应的离子方程式:
生成,试写出吸收时发生反应的离子方程式:_______ 。流程Ⅱ的吸收剂还可选用_______(填序号)代替浓纯碱溶液。
(4)实验室分离溴水中的溴还可以用溶剂萃取法,下列可以用作溴的萃取剂的是_______。(填序号)

(1)以上步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将之转变成化合态的溴,其目的是
(2)实验室保存液溴时,通常在盛液溴的试剂瓶中加少量的水,这与液溴的
A.氧化性 B.还原性 C.挥发性 D.腐蚀性 E.密度比水大
(3)流程Ⅱ中将吹出的溴蒸气用浓纯碱溶液吸收时除了生成
 、
、 外,还有
外,还有 生成,试写出吸收时发生反应的离子方程式:
生成,试写出吸收时发生反应的离子方程式:| A.水 | B.浓 溶液 溶液 | C.饱和 溶液 溶液 | D.饱和食盐水 |
| A.四氯化碳 | B.乙醇 | C.烧碱溶液 | D.苯 |
您最近一年使用:0次
5 .  是一种新型多功能绿色消毒剂。
是一种新型多功能绿色消毒剂。
I.某兴趣小组利用废铁屑(含少量 )制备高铁酸钠的工艺流程如图所示:
)制备高铁酸钠的工艺流程如图所示: ;
; ;
;_______ 。
(2)“操作”中通入空气的目的是_______ 。
(3)“氧化”时发生反应的化学方程式为_______ 。
(4)称取一定质量碘化钾于碘量瓶中,加入 溶液和一定质量氟化钠固体,待溶解完毕;准确称取
溶液和一定质量氟化钠固体,待溶解完毕;准确称取 样品于碘量瓶中,待样品充分溶解后,加硫酸酸化至反应完全;淀粉作指示剂,用
样品于碘量瓶中,待样品充分溶解后,加硫酸酸化至反应完全;淀粉作指示剂,用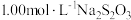 标准溶液进行滴定,消耗标准液体积为
标准溶液进行滴定,消耗标准液体积为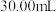 。已知
。已知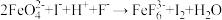 (未配平);
(未配平); 计算样品中
计算样品中 的质量分数
的质量分数_____ (写出计算过程)。
II. 主要用于废水处理。
主要用于废水处理。
(5) 净水原理如图所示。
净水原理如图所示。 是一种多功能水处理剂的原因为
是一种多功能水处理剂的原因为_______ 。 处理高氯废水中的有机物时,需在一定条件下使用。
处理高氯废水中的有机物时,需在一定条件下使用。
① 时,
时,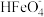 分解放出
分解放出 并产生
并产生 沉淀,该反应的离子方程式为
沉淀,该反应的离子方程式为_______ 。
②酸性溶液中 的氧化性大于
的氧化性大于 的氧化性。
的氧化性。 处理高氯废水中的有机物需在碱性条件下进行,其原因是
处理高氯废水中的有机物需在碱性条件下进行,其原因是_______ 。
 是一种新型多功能绿色消毒剂。
是一种新型多功能绿色消毒剂。I.某兴趣小组利用废铁屑(含少量
 )制备高铁酸钠的工艺流程如图所示:
)制备高铁酸钠的工艺流程如图所示:
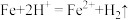 ;
; ;
;(2)“操作”中通入空气的目的是
(3)“氧化”时发生反应的化学方程式为
(4)称取一定质量碘化钾于碘量瓶中,加入
 溶液和一定质量氟化钠固体,待溶解完毕;准确称取
溶液和一定质量氟化钠固体,待溶解完毕;准确称取 样品于碘量瓶中,待样品充分溶解后,加硫酸酸化至反应完全;淀粉作指示剂,用
样品于碘量瓶中,待样品充分溶解后,加硫酸酸化至反应完全;淀粉作指示剂,用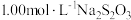 标准溶液进行滴定,消耗标准液体积为
标准溶液进行滴定,消耗标准液体积为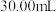 。已知
。已知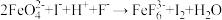 (未配平);
(未配平); 计算样品中
计算样品中 的质量分数
的质量分数II.
 主要用于废水处理。
主要用于废水处理。(5)
 净水原理如图所示。
净水原理如图所示。 是一种多功能水处理剂的原因为
是一种多功能水处理剂的原因为
 处理高氯废水中的有机物时,需在一定条件下使用。
处理高氯废水中的有机物时,需在一定条件下使用。①
 时,
时,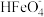 分解放出
分解放出 并产生
并产生 沉淀,该反应的离子方程式为
沉淀,该反应的离子方程式为②酸性溶液中
 的氧化性大于
的氧化性大于 的氧化性。
的氧化性。 处理高氯废水中的有机物需在碱性条件下进行,其原因是
处理高氯废水中的有机物需在碱性条件下进行,其原因是
您最近一年使用:0次
名校
解题方法
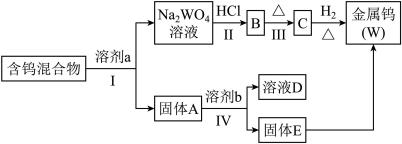
6 . 分离混合物在工业生产中应用广泛.某含有金属钨(W)、WO2、WO3、W2O5的混合物,欲从该混合物中分离出WO3和W2O5,并冶炼金属钨,其流程如图所示.

请阅读资料卡片并回答下列问题.
【资料卡片】
i.WO3易溶于NaOH、Na2CO3和Na2C2O4(草酸钠)溶液并形成钨酸盐(Na2WO4);W2O5易被氧化,也能溶解在上述溶液中;金属钨和WO2不溶于上述溶液.
ii.WO3几乎不与无机酸反应.
iii.钨化合物在不同溶剂中的浸取率见下表(浸取是用溶剂溶解固体混合物,以分离可溶性组分及残渣的过程.若浸取率为100%,则固体中的可溶组分全部溶解在溶剂中).
(1)步骤Ⅰ和Ⅳ均要进行的操作是____________________________________________ 。
(2)WO3既属于金属氧化物,也属于__________ (填“酸性”、“碱性”)氧化物,与NaOH溶液反应的离子方程式是__________________________________________________ 。
(3)步骤Ⅰ是将WO3分离出来,选用的试剂a是⑤,理由是___________________________ 。
(4)步骤Ⅳ可将W2O5分离出来,选用的试剂b是_______________ ,固体E中含有的物质是_______________ ,D中的溶质是_______________ 。

请阅读资料卡片并回答下列问题.
【资料卡片】
i.WO3易溶于NaOH、Na2CO3和Na2C2O4(草酸钠)溶液并形成钨酸盐(Na2WO4);W2O5易被氧化,也能溶解在上述溶液中;金属钨和WO2不溶于上述溶液.
ii.WO3几乎不与无机酸反应.
iii.钨化合物在不同溶剂中的浸取率见下表(浸取是用溶剂溶解固体混合物,以分离可溶性组分及残渣的过程.若浸取率为100%,则固体中的可溶组分全部溶解在溶剂中).
| 溶剂 | 煮沸时间(min) | W2O5(%) | WO3(%) | WO2 | 金属钨 |
| ①100g/L NaOH ②300g/LNa2CO3 ③50g/L Na2CO3 ④饱和Na2C2O4 ⑤饱和Na2C2O4(在CO2气氛下浸取) | 25 7 30 60 120 | 72.3 76.4 100 4.2 <0.5 | 100 100 100 100 100 | 未 检 出 | 未 检 出 |
(1)步骤Ⅰ和Ⅳ均要进行的操作是
(2)WO3既属于金属氧化物,也属于
(3)步骤Ⅰ是将WO3分离出来,选用的试剂a是⑤,理由是
(4)步骤Ⅳ可将W2O5分离出来,选用的试剂b是
您最近一年使用:0次
名校
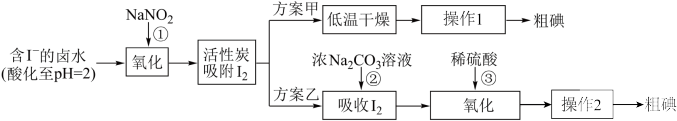
7 . 从海水中可以提取很多有用的物质,例如从海水制盐所得到的卤水中可以提取碘。活性炭吸附法是工业提碘的方法之一,其流程如下。下列说法错误的是 时,
时, 溶液只能将
溶液只能将 氧化为
氧化为 ,同时生成
,同时生成 。
。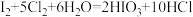 。
。
 时,
时, 溶液只能将
溶液只能将 氧化为
氧化为 ,同时生成
,同时生成 。
。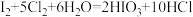 。
。| A.操作2中的萃取操作会用到的主要仪器为分液漏斗 |
B.方案甲中,根据 的特性,分离操作1的方法是升华 的特性,分离操作1的方法是升华 |
C.反应②中每吸收 转移 转移 电子,离子方程式是 电子,离子方程式是 |
D.可用 、酸性 、酸性 等便宜的强氧化剂代替 等便宜的强氧化剂代替 |
您最近一年使用:0次
2022-10-19更新
|
188次组卷
|
3卷引用:河南省新乡市第一中学2022-2023学年高一下学期3月月考化学试题
名校
解题方法
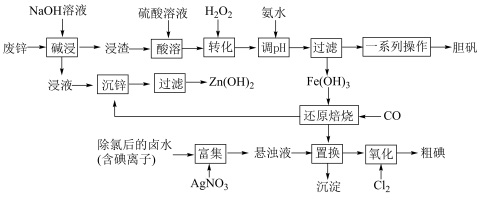
8 . 某“变废为宝”学生探究小组设计如下工艺流程,对废锌(含铁和铜的氧化物杂质)和除氯后的卤水(含碘离子)联合应用,最终制得胆矾、 、碘等。
、碘等。
已知:①锌元素与铝元素的性质类似,例如氧化锌也能溶于强碱{生成 }。
}。
②本工艺条件下,相关金属离子形成氢氧化物沉淀的pH范围如下:
③还原性: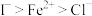
回答下列问题:
(1)“碱浸”中发生反应的化学方程式为___________ 。
(2)“转化”中,加入足量 的目的是
的目的是___________ 。
(3)“调pH”时需控制该溶液的pH范围为___________ 之间。“调pH”之后,需要加热煮沸10min,冷却后再“过滤”。煮沸10min的作用是___________ 。
(4)“还原焙烧”的气体产物可循环利用到“沉锌”中。若该气体不足,“沉锌”中发生反应的离子方程式为___________ 。
(5)“置换”反应的离子方程式为___________ 。
(6)“氧化”过程中若反应物用量比 时,氧化产物为
时,氧化产物为___________ (填化学式):当 时,单质碘的收率会降低,原因是
时,单质碘的收率会降低,原因是 会将碘氧化为
会将碘氧化为 ,写出该反应的化学方程式
,写出该反应的化学方程式___________ 。采用升华法可精制粗碘,该过程需选择下列仪器中的___________ (填序号,夹持装置略)。
(7)胆矾结晶水测定:
①称量干燥坩埚的质量为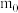 ,加入胆矾后总质量为
,加入胆矾后总质量为 ,将坩埚加热至胆矾全部变为白色,置于干燥器中冷至室温后称量,重复上述操作,最终总质量恒定为
,将坩埚加热至胆矾全部变为白色,置于干燥器中冷至室温后称量,重复上述操作,最终总质量恒定为 。根据实验数据,胆矾分子中结晶水的个数为
。根据实验数据,胆矾分子中结晶水的个数为___________ (写表达式)。
②下列操作中,会导致结晶水数目测定值偏低的是___________ (填标号)。
a.实验前胆矾未充分干燥
b.加热时有少量胆矾迸溅出来
c.加热时部分样品由白色变为黑色
d.加热后的 放在空气中冷却后称量
放在空气中冷却后称量
 、碘等。
、碘等。
已知:①锌元素与铝元素的性质类似,例如氧化锌也能溶于强碱{生成
 }。
}。②本工艺条件下,相关金属离子形成氢氧化物沉淀的pH范围如下:
| 金属离子 |  |  |  |  |
| 开始沉淀的pH | 6.2 | 6.3 | 1.5 | 4.7 |
| 沉淀完全的pH | 8.2 | 8.3 | 2.8 | 6.8 |
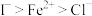
回答下列问题:
(1)“碱浸”中发生反应的化学方程式为
(2)“转化”中,加入足量
 的目的是
的目的是(3)“调pH”时需控制该溶液的pH范围为
(4)“还原焙烧”的气体产物可循环利用到“沉锌”中。若该气体不足,“沉锌”中发生反应的离子方程式为
(5)“置换”反应的离子方程式为
(6)“氧化”过程中若反应物用量比
 时,氧化产物为
时,氧化产物为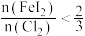 时,单质碘的收率会降低,原因是
时,单质碘的收率会降低,原因是 会将碘氧化为
会将碘氧化为 ,写出该反应的化学方程式
,写出该反应的化学方程式
(7)胆矾结晶水测定:
①称量干燥坩埚的质量为
 ,加入胆矾后总质量为
,加入胆矾后总质量为 ,将坩埚加热至胆矾全部变为白色,置于干燥器中冷至室温后称量,重复上述操作,最终总质量恒定为
,将坩埚加热至胆矾全部变为白色,置于干燥器中冷至室温后称量,重复上述操作,最终总质量恒定为 。根据实验数据,胆矾分子中结晶水的个数为
。根据实验数据,胆矾分子中结晶水的个数为②下列操作中,会导致结晶水数目测定值偏低的是
a.实验前胆矾未充分干燥
b.加热时有少量胆矾迸溅出来
c.加热时部分样品由白色变为黑色
d.加热后的
 放在空气中冷却后称量
放在空气中冷却后称量
您最近一年使用:0次
解题方法
9 . Ⅰ)下表是某儿童在饶河县医院临床检验结果报告单的部分数据:
根据上表的数据,回答下列问题。
(1)该儿童_______ 元素含量偏低(填元素名称)。
(2)报告单中“mol·L-1”是_______ (填“质量”、“体积”或“浓度”)的单位。
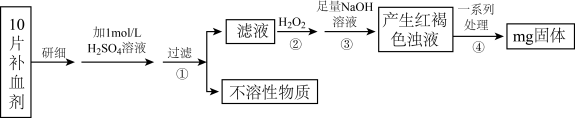
Ⅱ)硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下:
请回答下列问题:
(3)步骤①的滤液中滴加KSCN溶液后变为红色,则该滤液中含有_______ (填离子符号)。
(4)步骤②加入过量H2O2的目的是_______ 。步骤②反应的离子方程式为_______ 。
(5)服用维生素C可使食物中的Fe3+转化为Fe2+,在这个过程中体现维生素C的_______ 。(填“氧化性”或“还原性”)。
(6)由FeSO4·7H2O固体配制500mL0.10 mol/L FeSO4溶液,以下操作会导致所配溶液浓度偏低的是_______ 。(填序号)
A.容量瓶中原有少量蒸馏水 B.洗涤烧杯和玻璃棒的溶液未转入容量瓶中
C.定容时俯视刻度线 D.定容摇匀后发现溶液体积低于刻度线,再补加少量蒸馏水至刻度线
E.用天平(使用游码)称量时,被称量物与砝码的位置放颠倒了
(7)若向FeSO4溶液中加入足量Na2O2,观察到的现象是_______ 。
| 分析项目 | 检测结果 | 单位 | 参考范围 | |
| 1 | 锌(Zn) | 115.92 | mol·L-l | 66-120 |
| 2 | 铁(Fe) | 6.95 | mmol·L-1 | 7.52-11.82 |
| 3 | 钙(Ca) | 1.78 | mmol·L-1 | 1.55-2.10 |
(1)该儿童
(2)报告单中“mol·L-1”是
Ⅱ)硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下:

请回答下列问题:
(3)步骤①的滤液中滴加KSCN溶液后变为红色,则该滤液中含有
(4)步骤②加入过量H2O2的目的是
(5)服用维生素C可使食物中的Fe3+转化为Fe2+,在这个过程中体现维生素C的
(6)由FeSO4·7H2O固体配制500mL0.10 mol/L FeSO4溶液,以下操作会导致所配溶液浓度偏低的是
A.容量瓶中原有少量蒸馏水 B.洗涤烧杯和玻璃棒的溶液未转入容量瓶中
C.定容时俯视刻度线 D.定容摇匀后发现溶液体积低于刻度线,再补加少量蒸馏水至刻度线
E.用天平(使用游码)称量时,被称量物与砝码的位置放颠倒了
(7)若向FeSO4溶液中加入足量Na2O2,观察到的现象是
您最近一年使用:0次
解题方法
10 . 分离混合物在工业生产中应用广泛.某含有金属钨(W)、WO2、WO3、W2O5的混合物,欲从该混合物中分离出WO3和W2O5,并冶炼金属钨,其流程如图所示.
请阅读资料卡片并回答下列问题.
【资料卡片】
i.WO3易溶于NaOH、Na2CO3和Na2C2O4(草酸钠)溶液并形成钨酸盐(Na2WO4);W2O5易被氧化,也能溶解在上述溶液中;金属钨和WO2不溶于上述溶液.
ii.WO3几乎不与无机酸反应.
iii.钨化合物在不同溶剂中的浸取率见下表(浸取是用溶剂溶解固体混合物,以分离可溶性组分及残渣的过程.若浸取率为100%,则固体中的可溶组分全部溶解在溶剂中).
(1)步骤Ⅰ和Ⅳ均要进行的操作是_______________________________________ 。
(2)步骤Ⅱ、Ⅲ反应的化学方程式分别是_____________ 、_____________ 。
(3)WO3既属于金属氧化物,也属于____ (填“酸性”、“碱性”)氧化物,与NaOH溶液反应的离子方程式是___________________________ .
(4)步骤Ⅰ是将WO3分离出来,选用的试剂a是⑤,理由是______ .
(5)步骤Ⅳ可将W2O5分离出来,选用的试剂b是____ ,固体E中含有的物质是___ ,D中的溶质是____ .

请阅读资料卡片并回答下列问题.
【资料卡片】
i.WO3易溶于NaOH、Na2CO3和Na2C2O4(草酸钠)溶液并形成钨酸盐(Na2WO4);W2O5易被氧化,也能溶解在上述溶液中;金属钨和WO2不溶于上述溶液.
ii.WO3几乎不与无机酸反应.
iii.钨化合物在不同溶剂中的浸取率见下表(浸取是用溶剂溶解固体混合物,以分离可溶性组分及残渣的过程.若浸取率为100%,则固体中的可溶组分全部溶解在溶剂中).
| 溶剂 | 煮沸时间(min) | W2O5(%) | WO3(%) | WO2 | 金属钨 |
| ①100g/L NaOH ②300g/LNa2CO3 ③50g/L Na2CO3 ④饱和Na2C2O4 ⑤饱和Na2C2O4(在CO2气氛下浸取) | 25 7 30 60 120 | 72.3 76.4 100 4.2 <0.5 | 100 100 100 100 100 | 未检出 | 未检出 |
(2)步骤Ⅱ、Ⅲ反应的化学方程式分别是
(3)WO3既属于金属氧化物,也属于
(4)步骤Ⅰ是将WO3分离出来,选用的试剂a是⑤,理由是
(5)步骤Ⅳ可将W2O5分离出来,选用的试剂b是
您最近一年使用:0次



