解题方法
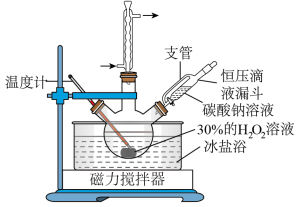
1 . 过碳酸钠(2Na2CO3・3H2O2)又名过氧碳酸钠,白色颗粒状粉末,其水溶液呈碱性,50℃可分解为碳酸钠和过氧化氢,具有Na2CO3和H2O2的双重性质,是很好的消毒剂、漂白剂、供氧剂。以工业碳酸钠和H2O2为原料制备过碳酸钠的实验装置及步骤:
I.称取10.0g碳酸钠,溶于40mL蒸馏水中,冷却至273K待用。
II.量取15mL30%的H2O2溶液加入到三颈烧瓶中,冷却至273K后,加入复合稳定剂,搅拌均匀。
III.在控温及搅拌条件下,将碳酸钠溶液滴入到步骤II的混合液中,待反应液冷却至268K左右,边搅拌边加入4.0gNaCl,静置结晶。
IV.过滤,用无水乙醇洗涤后,真空干燥。
请回答以下问题:
(1)球形冷凝管中回流的主要物质除H2O外还有__________________ (填化学式)。
(2)制备过程中涉及的反应及干燥等操作均需在较低温度下进行,原因是________________ 。
(3)步骤II中加入复合稳定剂的目的之一是与工业碳酸钠中含有的Fe3+生成稳定的配合物,以防Fe3+对制备反应产生不良影响。该不良影响是指__________________________ 。
(4)步骤IV中完成"过滤”操作所需玻璃仪器有烧杯、____________ 和____________ .
(5)产品中H2O2含量的测定
准确称取产品0.1000g于碘量瓶中,加入50mL蒸馏水,并立即加入6mL2mol·L-1H3PO4溶液,再加入lgKI固体(过量),摇匀后于暗处放置10min,加入适量指示剂,用0.1000rnol·L-1Na2S2O3标准液滴定至终点,消耗Na2S2O3标准溶液17.00mL。(已知:2Na2S2O3+I2=Na2S4O6+2NaI)
①所加指示剂的名称是____________ ;确定达到滴定终点的依据是_____________
②若加入KI固体摇匀后未将碘量瓶“在暗处放置10min”,就立即进行滴定操作,测定的结果将会____________ (选填“偏大"、“偏小”或“无影响”)。
③根据实验数据计算产品中H2O2的质量分数为____________ %。
I.称取10.0g碳酸钠,溶于40mL蒸馏水中,冷却至273K待用。
II.量取15mL30%的H2O2溶液加入到三颈烧瓶中,冷却至273K后,加入复合稳定剂,搅拌均匀。
III.在控温及搅拌条件下,将碳酸钠溶液滴入到步骤II的混合液中,待反应液冷却至268K左右,边搅拌边加入4.0gNaCl,静置结晶。
IV.过滤,用无水乙醇洗涤后,真空干燥。

请回答以下问题:
(1)球形冷凝管中回流的主要物质除H2O外还有
(2)制备过程中涉及的反应及干燥等操作均需在较低温度下进行,原因是
(3)步骤II中加入复合稳定剂的目的之一是与工业碳酸钠中含有的Fe3+生成稳定的配合物,以防Fe3+对制备反应产生不良影响。该不良影响是指
(4)步骤IV中完成"过滤”操作所需玻璃仪器有烧杯、
(5)产品中H2O2含量的测定
准确称取产品0.1000g于碘量瓶中,加入50mL蒸馏水,并立即加入6mL2mol·L-1H3PO4溶液,再加入lgKI固体(过量),摇匀后于暗处放置10min,加入适量指示剂,用0.1000rnol·L-1Na2S2O3标准液滴定至终点,消耗Na2S2O3标准溶液17.00mL。(已知:2Na2S2O3+I2=Na2S4O6+2NaI)
①所加指示剂的名称是
②若加入KI固体摇匀后未将碘量瓶“在暗处放置10min”,就立即进行滴定操作,测定的结果将会
③根据实验数据计算产品中H2O2的质量分数为
您最近一年使用:0次
2 . 用下列实验装置进行相应实验,设计正确且能达到实验目的的是


| A.用甲装置除去苯中的苯酚杂质 |
| B.用乙装置验证硫酸、碳酸、苯酚的酸性强弱 |
| C.用丙装置制备并检验乙炔的性质 |
| D.用丁装置分离乙醇和乙酸的混合物 |
您最近一年使用:0次
2021-07-22更新
|
246次组卷
|
3卷引用:2020年天津卷化学高考真题变式题1-12
名校
解题方法
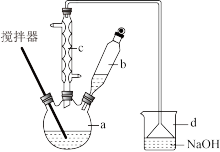
3 . 碘酸钙[Ca(IO3)2]广泛用于食品工业、口腔洗涤,防腐等领域,某化学兴趣小组在实验室利用碘在酸性条件下被氯酸钾氧化成碘酸氢钾(KIO3·HIO3),溶液经氢氧化钾中和后,与氯化钙发生复分解反应制备碘酸钙,其制备步骤及装置(水浴加热装置略去)如图:

物质的摩尔质量如下表:
请回答下列问题:
(1)加入b中盐酸后,碘在酸性条件下被氯酸钾氧化成碘酸氢钾(KIO3·HIO3),反应中有黄绿色的气体生成,该反应的化学方程式为___ 。
(2)步骤②与“直接加热”相比,“水浴加热”的优点为___ 。
(3)步骤④加入氯化钙后,得到白色悬浊液,说明KIO3的溶解度___ (填“大于”“小于”或“等于”)Ca(IO3)2。
(4)步骤⑤冰水浴冷却的目的为___ 。
(5)步骤⑥的操作名称为___ 。
(6)步骤⑦洗涤后检验沉淀是否洗涤干净的方法为___ 。
(7)最终得到2..60g碘酸钙产品,则产率为___ %(保留2小数)。


物质的摩尔质量如下表:
| 物质 | I2 | KClO3 | Ca(IO3)2 |
| 摩尔质量/g·mol-1 | 354 | 122.5 | 390 |
请回答下列问题:
(1)加入b中盐酸后,碘在酸性条件下被氯酸钾氧化成碘酸氢钾(KIO3·HIO3),反应中有黄绿色的气体生成,该反应的化学方程式为
(2)步骤②与“直接加热”相比,“水浴加热”的优点为
(3)步骤④加入氯化钙后,得到白色悬浊液,说明KIO3的溶解度
(4)步骤⑤冰水浴冷却的目的为
(5)步骤⑥的操作名称为
(6)步骤⑦洗涤后检验沉淀是否洗涤干净的方法为
(7)最终得到2..60g碘酸钙产品,则产率为
您最近一年使用:0次



