名校
解题方法
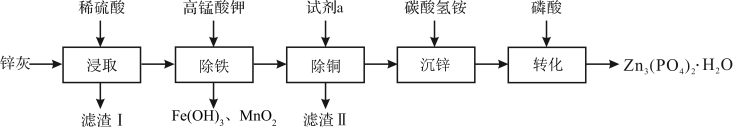
1 . 四水合磷酸锌 [Zn3(PO4)2·4H2O,摩尔质量为457 g·mol-1,难溶于水] 是一种性能优良的绿色环保防锈颜料。实验室以锌灰(含ZnO、PbO、CuO、FeO、Fe2O3、SiO2等)为原料制备Zn3(PO4)2·4H2O的流程如图,回答下列问题:
已知:①6NH4HCO3 + 3ZnSO4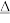 ZnCO3·2Zn(OH)2·H2O↓ + 3(NH4)2SO4 + 5CO2↑
ZnCO3·2Zn(OH)2·H2O↓ + 3(NH4)2SO4 + 5CO2↑
②ZnCO3·2Zn(OH)2·H2O + 2H3PO4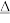 Zn3(PO4)2·4H2O + 2H2O + CO2↑
Zn3(PO4)2·4H2O + 2H2O + CO2↑
③常温下,Fe3+、Fe2+、Cu2+、Zn2+生成氢氧化物沉淀时的pH:
(1)滤渣Ⅰ的主要成分为_______ ;试剂a为_______ ;
(2)“除铁”操作时,需先将溶液调至接近中性,然后再滴加KMnO4溶液,使溶液中的铁元素转化为Fe(OH)3,该反应的离子方程式为_______ ;
(3)“转化”结束后,从混合液中分离得到Zn3(PO4)2·4H2O的操作包括_______ 和干燥。
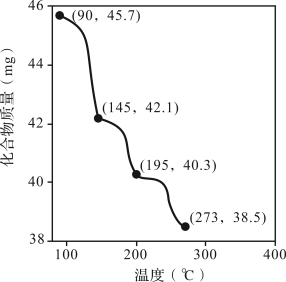
(4)称取45.7 mg Zn3(PO4)2·4H2O进行热重分析,化合物质量随温度的变化关系如图所示,为获得Zn3(PO4)2·2H2O和Zn3(PO4)2·H2O的混合产品,烘干时的温度范围为_______。
(5)为测定产品中Zn3(PO4)2·4H2O的含量,进行如下实验:(已知:Zn2+与H2Y2−按1:1反应;杂质不反应。)
步骤Ⅰ:准确称取0.4570g产品于烧杯中,加入适量盐酸使其溶解,将溶液转移至100 mL容量瓶,定容。
步骤Ⅱ:移取20.00 mL上述溶液于锥形瓶中,加入指示剂,在pH = 5~6的缓冲溶液中用0.02000mol·L-1 Na2H2Y标准溶液滴定至终点,测得Na2H2Y标准溶液的用量为27.60 mL。
步骤Ⅱ中移取溶液时所使用的玻璃仪器为_______ ;产品中Zn3(PO4)2·4H2O的质量分数为_______ 。下列操作中,导致产品中Zn3(PO4)2·4H2O含量测定值偏低的是_______ 。
a.步骤I中定容时俯视刻度线
b.步骤I中转移溶液时未洗涤烧杯
c.步骤II中滴定管未用Na2H2Y标准溶液润洗
d.步骤II中滴定前滴定管内无气泡,滴定结束后有气泡

已知:①6NH4HCO3 + 3ZnSO4
 ZnCO3·2Zn(OH)2·H2O↓ + 3(NH4)2SO4 + 5CO2↑
ZnCO3·2Zn(OH)2·H2O↓ + 3(NH4)2SO4 + 5CO2↑②ZnCO3·2Zn(OH)2·H2O + 2H3PO4
 Zn3(PO4)2·4H2O + 2H2O + CO2↑
Zn3(PO4)2·4H2O + 2H2O + CO2↑③常温下,Fe3+、Fe2+、Cu2+、Zn2+生成氢氧化物沉淀时的pH:
| Fe3+ | Fe2+ | Cu2+ | Zn2+ | |
| 开始沉淀时的pH | 1.9 | 7.0 | 4.7 | 5.7 |
| 完全沉淀时的pH | 3.7 | 9.0 | 6.7 | 8.1 |
(2)“除铁”操作时,需先将溶液调至接近中性,然后再滴加KMnO4溶液,使溶液中的铁元素转化为Fe(OH)3,该反应的离子方程式为
(3)“转化”结束后,从混合液中分离得到Zn3(PO4)2·4H2O的操作包括
(4)称取45.7 mg Zn3(PO4)2·4H2O进行热重分析,化合物质量随温度的变化关系如图所示,为获得Zn3(PO4)2·2H2O和Zn3(PO4)2·H2O的混合产品,烘干时的温度范围为_______。

| A.90~145℃ | B.145~195℃ | C.195~273℃ | D.>273℃ |
步骤Ⅰ:准确称取0.4570g产品于烧杯中,加入适量盐酸使其溶解,将溶液转移至100 mL容量瓶,定容。
步骤Ⅱ:移取20.00 mL上述溶液于锥形瓶中,加入指示剂,在pH = 5~6的缓冲溶液中用0.02000mol·L-1 Na2H2Y标准溶液滴定至终点,测得Na2H2Y标准溶液的用量为27.60 mL。
步骤Ⅱ中移取溶液时所使用的玻璃仪器为
a.步骤I中定容时俯视刻度线
b.步骤I中转移溶液时未洗涤烧杯
c.步骤II中滴定管未用Na2H2Y标准溶液润洗
d.步骤II中滴定前滴定管内无气泡,滴定结束后有气泡
您最近一年使用:0次
2021-09-16更新
|
668次组卷
|
3卷引用:2020年全国卷Ⅰ理综化学高考真题变式题
解题方法
2 . 过碳酸钠(2Na2CO3・3H2O2)又名过氧碳酸钠,白色颗粒状粉末,其水溶液呈碱性,50℃可分解为碳酸钠和过氧化氢,具有Na2CO3和H2O2的双重性质,是很好的消毒剂、漂白剂、供氧剂。以工业碳酸钠和H2O2为原料制备过碳酸钠的实验装置及步骤:
I.称取10.0g碳酸钠,溶于40mL蒸馏水中,冷却至273K待用。
II.量取15mL30%的H2O2溶液加入到三颈烧瓶中,冷却至273K后,加入复合稳定剂,搅拌均匀。
III.在控温及搅拌条件下,将碳酸钠溶液滴入到步骤II的混合液中,待反应液冷却至268K左右,边搅拌边加入4.0gNaCl,静置结晶。
IV.过滤,用无水乙醇洗涤后,真空干燥。
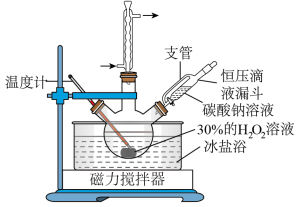
请回答以下问题:
(1)球形冷凝管中回流的主要物质除H2O外还有__________________ (填化学式)。
(2)制备过程中涉及的反应及干燥等操作均需在较低温度下进行,原因是________________ 。
(3)步骤II中加入复合稳定剂的目的之一是与工业碳酸钠中含有的Fe3+生成稳定的配合物,以防Fe3+对制备反应产生不良影响。该不良影响是指__________________________ 。
(4)步骤IV中完成"过滤”操作所需玻璃仪器有烧杯、____________ 和____________ .
(5)产品中H2O2含量的测定
准确称取产品0.1000g于碘量瓶中,加入50mL蒸馏水,并立即加入6mL2mol·L-1H3PO4溶液,再加入lgKI固体(过量),摇匀后于暗处放置10min,加入适量指示剂,用0.1000rnol·L-1Na2S2O3标准液滴定至终点,消耗Na2S2O3标准溶液17.00mL。(已知:2Na2S2O3+I2=Na2S4O6+2NaI)
①所加指示剂的名称是____________ ;确定达到滴定终点的依据是_____________
②若加入KI固体摇匀后未将碘量瓶“在暗处放置10min”,就立即进行滴定操作,测定的结果将会____________ (选填“偏大"、“偏小”或“无影响”)。
③根据实验数据计算产品中H2O2的质量分数为____________ %。
I.称取10.0g碳酸钠,溶于40mL蒸馏水中,冷却至273K待用。
II.量取15mL30%的H2O2溶液加入到三颈烧瓶中,冷却至273K后,加入复合稳定剂,搅拌均匀。
III.在控温及搅拌条件下,将碳酸钠溶液滴入到步骤II的混合液中,待反应液冷却至268K左右,边搅拌边加入4.0gNaCl,静置结晶。
IV.过滤,用无水乙醇洗涤后,真空干燥。

请回答以下问题:
(1)球形冷凝管中回流的主要物质除H2O外还有
(2)制备过程中涉及的反应及干燥等操作均需在较低温度下进行,原因是
(3)步骤II中加入复合稳定剂的目的之一是与工业碳酸钠中含有的Fe3+生成稳定的配合物,以防Fe3+对制备反应产生不良影响。该不良影响是指
(4)步骤IV中完成"过滤”操作所需玻璃仪器有烧杯、
(5)产品中H2O2含量的测定
准确称取产品0.1000g于碘量瓶中,加入50mL蒸馏水,并立即加入6mL2mol·L-1H3PO4溶液,再加入lgKI固体(过量),摇匀后于暗处放置10min,加入适量指示剂,用0.1000rnol·L-1Na2S2O3标准液滴定至终点,消耗Na2S2O3标准溶液17.00mL。(已知:2Na2S2O3+I2=Na2S4O6+2NaI)
①所加指示剂的名称是
②若加入KI固体摇匀后未将碘量瓶“在暗处放置10min”,就立即进行滴定操作,测定的结果将会
③根据实验数据计算产品中H2O2的质量分数为
您最近一年使用:0次
解题方法
3 . 三盐(3PbO·PbSO4·H2O)可用作聚氯乙烯的热稳定剂,200℃以上开始失去结晶水,不溶于水及有机溶剂。以200.0t铅泥(主要成分为PbO、Pb及PbSO4等)为原料制备三盐的工艺流程如图所示。
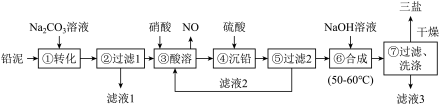
已知:PbSO4和PbCO3的溶解度和溶度积Ksp如下表。
(1)步骤①转化的目的是_______ ,滤液1中的溶质为Na2CO3和_______ (填化学式)。
(2)步骤③酸溶时,为提高酸溶速率,可采取的措施是_________ (任写一条)。其中铅与硝酸反应生成Pb(NO3)2和NO的离子方程式为__________________ 。
(3)滤液2中可循环利用的溶质的化学式为_______ 。若步骤④沉铅后的滤液中c(Pb2+)=1.82×10-5mol/L,则此时c(SO42-)=______ mol/L。
(4)步骤⑦洗涤操作时,检验沉淀是否洗涤完全的方法是________________ 。
(5)步骤⑥合成三盐的化学方程式为____________ ,若得到纯净干燥的三盐99.Ot,假设铅泥中的铅元素有80%转化为三盐,则铅泥中铅元素的质量分数为________ 。

已知:PbSO4和PbCO3的溶解度和溶度积Ksp如下表。
| 化合物 | PbSO4 | PbCO3 |
| 溶解度/g | 1.03×10-4 | 1.81×10-7 |
| Ksp | 1.82×10-8 | 1.46×10-13 |
(2)步骤③酸溶时,为提高酸溶速率,可采取的措施是
(3)滤液2中可循环利用的溶质的化学式为
(4)步骤⑦洗涤操作时,检验沉淀是否洗涤完全的方法是
(5)步骤⑥合成三盐的化学方程式为
您最近一年使用:0次
11-12高三上·江苏常州·期中
名校
4 . 某同学设计如下实验测量m g铜银合金样品中铜的质量分数:
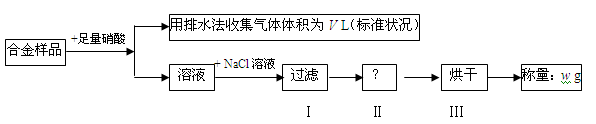
下列说法中不正确的是

下列说法中不正确的是
| A.收集到的V L气体全为 NO |
| B.过滤用到的玻璃仪器是:烧杯、漏斗、玻璃棒 |
| C.操作Ⅱ应是洗涤 |
D.铜的质量分数为: ×100% ×100% |
您最近一年使用:0次
2016-12-09更新
|
150次组卷
|
8卷引用:2012届四川省成都树德中学高考适应考试(一)理科综合化学试卷
(已下线)2012届四川省成都树德中学高考适应考试(一)理科综合化学试卷(已下线)2012届四川省成都树德中学高考适应考试(一)理科化学试卷 (已下线)2011届江苏省常州市横山桥高级中学高三上学期期中考试化学(已下线)2011届浙江省学军中学高三上学期期中考试化学试题(已下线)2012届浙江省海盐元济高级中学高三上学期10月份月考化学试卷(已下线)2015届福建省八县一中高三上学期半期联考化学试卷高一必修第一册(鲁科2019)第3章 第3节 氮的循环陕西省西安市第一中学2022-2023学年高一下学期5月月考化学试题



