名校
解题方法
1 . 菠菜富含膳食纤维、胡萝卜素、维生素c、维生素e、钙、磷、铁、等矿物质。14~18岁青少年每日合理摄入铁量为20~25mg,某化学小组针对菠菜中含铁量进行如下实验。
(一)实验目的:菠菜含铁量是否满足青少年日常所需
(二)实验方案:取适量新鲜菠菜平均分成三份,实验操作和现象记录如下:
(1)灼烧菠菜时,除了酒精灯还需要下列仪器中的_______ (填选项)。
A.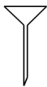 B.
B.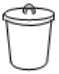 C.
C.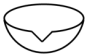 D.
D.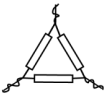 E.
E.
(2)写出实验三中 参与的最主要反应的离子方程式
参与的最主要反应的离子方程式_______ 。
(3)检验试剂KSCN溶液中的 采用
采用_______ 的方法。
(4)由三组实验做出如下推断,其中合理的是:_______(填选项)。
(三)实验数据:菠菜中含铁量的测定,实验步骤如下:
①取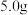 新鲜菠菜,充分灼烧,将灰分转移至干燥器中冷却。
新鲜菠菜,充分灼烧,将灰分转移至干燥器中冷却。
②向灰分中加入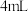 盐酸和
盐酸和 ,浸泡
,浸泡 ,过滤并用少量盐酸洗涤烧杯和沉淀,滤液和洗涤液合并;
,过滤并用少量盐酸洗涤烧杯和沉淀,滤液和洗涤液合并;
③将合并液定容成 待测液,利用分光光度法测得铁的浓度为
待测液,利用分光光度法测得铁的浓度为 。
。
根据上述实验,回答下列问题:
(5)步骤②洗涤烧杯和沉淀的目的是_______ 。
(6)步骤③定容操作若仰视容量瓶刻度线,会造成菠菜样品含铁量测定结果_______ 。(填“偏高”、“偏低”或“无影响”)。
(7)根据实验数据计算菠菜含铁量为_______ 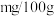 。
。
(四)实验结论:由于菠菜中含有大量草酸( )与铁元素形成沉淀影响铁元素吸收,所以不是理想的补铁剂。(附:猪肝每
)与铁元素形成沉淀影响铁元素吸收,所以不是理想的补铁剂。(附:猪肝每 中含铁量达到
中含铁量达到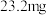 ,且容易被人体吸收。)
,且容易被人体吸收。)
(一)实验目的:菠菜含铁量是否满足青少年日常所需
(二)实验方案:取适量新鲜菠菜平均分成三份,实验操作和现象记录如下:
| 实验 | 操作步骤 | 检验试剂 | 现象 |
| 实验一 | 适量蒸馏水浸泡,过滤,取滤液,加检验试剂后加入适量 ,再次加入检验试剂 ,再次加入检验试剂 | KSCN溶液 | 均无明显现象 |
| 实验二 | 充分灼烧,加适量盐酸浸泡,取滤液,加检验试剂 | KSCN溶液 | 极浅的红色 |
| 实验三 | 充分灼烧,加适量盐酸、 浸泡,取滤液,加检验试剂 浸泡,取滤液,加检验试剂 | KSCN溶液 | 较深的红色 |
A.
 B.
B. C.
C. D.
D. E.
E.
(2)写出实验三中
 参与的最主要反应的离子方程式
参与的最主要反应的离子方程式(3)检验试剂KSCN溶液中的
 采用
采用(4)由三组实验做出如下推断,其中合理的是:_______(填选项)。
| A.菠菜样品中含铁量极低 | B.菠菜中的铁元素很难用蒸馏水直接溶出 |
| C.仅用盐酸无法溶出菠菜灰分中的铁元素 | D.灼烧的目的是将菠菜中的铁元素氧化 |
(三)实验数据:菠菜中含铁量的测定,实验步骤如下:
①取
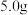 新鲜菠菜,充分灼烧,将灰分转移至干燥器中冷却。
新鲜菠菜,充分灼烧,将灰分转移至干燥器中冷却。②向灰分中加入
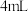 盐酸和
盐酸和 ,浸泡
,浸泡 ,过滤并用少量盐酸洗涤烧杯和沉淀,滤液和洗涤液合并;
,过滤并用少量盐酸洗涤烧杯和沉淀,滤液和洗涤液合并;③将合并液定容成
 待测液,利用分光光度法测得铁的浓度为
待测液,利用分光光度法测得铁的浓度为 。
。根据上述实验,回答下列问题:
(5)步骤②洗涤烧杯和沉淀的目的是
(6)步骤③定容操作若仰视容量瓶刻度线,会造成菠菜样品含铁量测定结果
(7)根据实验数据计算菠菜含铁量为
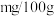 。
。(四)实验结论:由于菠菜中含有大量草酸(
 )与铁元素形成沉淀影响铁元素吸收,所以不是理想的补铁剂。(附:猪肝每
)与铁元素形成沉淀影响铁元素吸收,所以不是理想的补铁剂。(附:猪肝每 中含铁量达到
中含铁量达到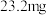 ,且容易被人体吸收。)
,且容易被人体吸收。)
您最近一年使用:0次
2023-03-02更新
|
604次组卷
|
4卷引用:贵州省遵义市南白中学2022-2023学年高一下学期第一次联考化学试题
2 . 应用下列装置测定氨气的组成。实验利用了氨气能还原氧化铜生成氮气、铜和水的原理。实验后测得装置D增重ag,用排水法测量得 的体积为bL(已折算成标准状况)。下列有关实验描述正确的是
的体积为bL(已折算成标准状况)。下列有关实验描述正确的是

 的体积为bL(已折算成标准状况)。下列有关实验描述正确的是
的体积为bL(已折算成标准状况)。下列有关实验描述正确的是
| A.装置A用于制备氨气,可用加热氯化铵固体的装置代替 |
| B.装置E的作用是防止水蒸气进入装置D中,若撤去装置E,则测得氮氢比偏小 |
| C.装置B的作用是干燥氨气,可替换成无水氯化钙 |
D.由实验数据可以计算得到氨气分子中的氮氢个数比为 |
您最近一年使用:0次
3 . 已知SO2+I2+2H2O=H2SO4+2HI,某化学兴趣小组选用下列实验装置,测定工业原料气(含SO2、N2、O2)中SO2的含量。
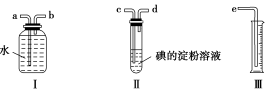
(1)若原料气从左流向右时,上述装置组装连接的顺序:原料气→__________________ (填“a”“b”“c”“d”“e”)。
(2)装置Ⅱ中发生反应的离子方程式为_____________ ;当装置Ⅱ中出现________ 现象时,立即停止通气。
(3)若碘溶液的浓度为0.05 mol/L、体积为20 mL,收集到的N2与O2的体积为297.6 mL(已折算为标准状况下的体积),SO2的体积分数为________ 。

(1)若原料气从左流向右时,上述装置组装连接的顺序:原料气→
(2)装置Ⅱ中发生反应的离子方程式为
(3)若碘溶液的浓度为0.05 mol/L、体积为20 mL,收集到的N2与O2的体积为297.6 mL(已折算为标准状况下的体积),SO2的体积分数为
您最近一年使用:0次
2018-09-06更新
|
466次组卷
|
6卷引用:贵州省毕节市实验高级中学2017-2018学年高一下学期期中考试化学试题
名校
4 . 我国近代化学工业英基人侯德榜先生设计出“侯氏制碱法”,提高了食盐的转化率,缩短了生产流程,减少了对环境的污染。钢仁一中化学实验社团模拟“侯氏制碱法”开展如下项目式学习:
项目一:粗盐的提纯
粗盐中除了含有泥沙之外,还含有少量 等杂质离子,粗盐提纯的流程如图所示:
等杂质离子,粗盐提纯的流程如图所示: 分别为足量的
分别为足量的_____________ 、_____________ 。
(2)操作2的名称是_____________________ 。
(3)“滤液”中加入足量的试剂 生成气泡的离子方程式为
生成气泡的离子方程式为_____________________________ 。
项目二:模拟“侯氏制碱法“利用上述实验制得的 全部用于制备纯碱,工艺流程如图所示:
全部用于制备纯碱,工艺流程如图所示:

(4)氮化和碳酸化过程在如图所示装置中进行, 导管应通入的气体是
导管应通入的气体是_____________ (填化学式),仪器 的作用是
的作用是_____________________________________________ 。
(5)写出煅烧固体时发生的化学方程式:_________________________________________________ 。
(6)称取了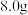 粗盐进行实验,最终制得
粗盐进行实验,最终制得 纯碱,假设完全转化,则粗盐的纯度是
纯碱,假设完全转化,则粗盐的纯度是_________  。(保留2位有效数字)
。(保留2位有效数字)
项目一:粗盐的提纯
粗盐中除了含有泥沙之外,还含有少量
 等杂质离子,粗盐提纯的流程如图所示:
等杂质离子,粗盐提纯的流程如图所示:
 分别为足量的
分别为足量的(2)操作2的名称是
(3)“滤液”中加入足量的试剂
 生成气泡的离子方程式为
生成气泡的离子方程式为项目二:模拟“侯氏制碱法“利用上述实验制得的
 全部用于制备纯碱,工艺流程如图所示:
全部用于制备纯碱,工艺流程如图所示:
(4)氮化和碳酸化过程在如图所示装置中进行,
 导管应通入的气体是
导管应通入的气体是 的作用是
的作用是(5)写出煅烧固体时发生的化学方程式:
(6)称取了
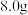 粗盐进行实验,最终制得
粗盐进行实验,最终制得 纯碱,假设完全转化,则粗盐的纯度是
纯碱,假设完全转化,则粗盐的纯度是 。(保留2位有效数字)
。(保留2位有效数字)
您最近一年使用:0次
名校
解题方法
5 . “化学——我们的生活,我们的未来”,学习化学应该明白“从生活中来,到生活中去”的道理。
(1)小苏打常用于糕点制作,还可治疗胃酸过多等,有多种用途。请写出小苏打溶液与氢氧化钠溶液反应的离子方程式:_________ 。
(2)过氧化钠常用作呼吸面具或潜水艇中的供氧剂,请你写出过氧化钠与二氧化碳反应的化学方程式:_________ 。
(3)有小组同学称取10 g所制备Na2O2的样品(设样品中杂质不参与下列反应),利用下列装置测定Na2O2样品的纯度(夹持仪器省略),已知Na2O2的摩尔质量为78 g/mol。

有同学提出该实验装置存在缺陷,应该在A、B装置之间增加一个盛有饱和 溶液的洗气瓶,该同学想法是否有必要?理由是
溶液的洗气瓶,该同学想法是否有必要?理由是_________ 。倒出量筒内水的体积后,折算成标准状况下O2的体积为1120 mL,计算样品中Na2O2的质量分数约为_________ 。
(4)向30 mL NaOH溶液中逐渐通入一定量的CO2,再向该溶液中逐滴加入2 mol/L盐酸,所加入盐酸的体积(单位为mL)与产生二氧化碳的体积(标准状况下)关系如图所示。
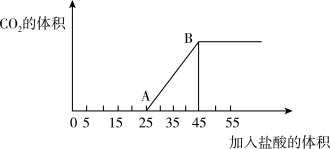
A点溶液中溶质为:_________ ,计算原NaOH溶液的物质的量浓度是_________ mol/L。
(1)小苏打常用于糕点制作,还可治疗胃酸过多等,有多种用途。请写出小苏打溶液与氢氧化钠溶液反应的离子方程式:
(2)过氧化钠常用作呼吸面具或潜水艇中的供氧剂,请你写出过氧化钠与二氧化碳反应的化学方程式:
(3)有小组同学称取10 g所制备Na2O2的样品(设样品中杂质不参与下列反应),利用下列装置测定Na2O2样品的纯度(夹持仪器省略),已知Na2O2的摩尔质量为78 g/mol。

有同学提出该实验装置存在缺陷,应该在A、B装置之间增加一个盛有饱和
 溶液的洗气瓶,该同学想法是否有必要?理由是
溶液的洗气瓶,该同学想法是否有必要?理由是(4)向30 mL NaOH溶液中逐渐通入一定量的CO2,再向该溶液中逐滴加入2 mol/L盐酸,所加入盐酸的体积(单位为mL)与产生二氧化碳的体积(标准状况下)关系如图所示。

A点溶液中溶质为:
您最近一年使用:0次
名校
6 . 溴化亚铜可用于彩色照相,是一种白色结晶状粉末,见光分解,在空气中会慢慢氧化成绿色,溶于氢溴酸、盐酸、硝酸和氨水,在热水中也会发生分解。实验室制备CuBr的装置示意图和步骤如下:
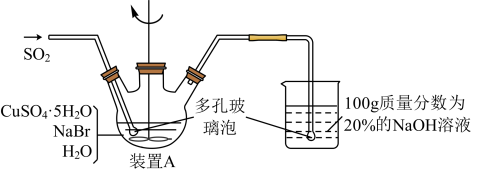
实验步骤:
①在装置A中加入50.0gCuSO4·5H2O、30.9gNaBr、150 mL蒸馏水,60℃时不断搅拌,以适当流速通入SO2;
②溶液冷却后倾去上层清液,在避光的条件下过滤;
③依次用溶有少量SO2的水、溶有少量SO2的乙醇、纯乙醚洗涤;
④在双层干燥器(分别装有浓硫酸和氢氧化钠)中干燥3~4 h,再经氢气流干燥,最后进行真空干燥,得到产品21.6g。
回答下列问题:
(1)步骤②中过滤需要避光的原因是___________ 。
(2)步骤①中实验所用蒸馏水事先要进行的处理操作是___________ ,控制反应在60℃条件下进行,实验中可采取的措施是___________ 。
(3)步骤③中洗涤剂需“溶有SO2”的原因是___________ ;最后洗涤剂改用乙醚的目的是___________ 。
(4)装置A中反应生成CuBr的离子方程式为___________ ;说明反应已完成的现象是___________ 。
(5)本实验产品的产率是___________ 。

实验步骤:
①在装置A中加入50.0gCuSO4·5H2O、30.9gNaBr、150 mL蒸馏水,60℃时不断搅拌,以适当流速通入SO2;
②溶液冷却后倾去上层清液,在避光的条件下过滤;
③依次用溶有少量SO2的水、溶有少量SO2的乙醇、纯乙醚洗涤;
④在双层干燥器(分别装有浓硫酸和氢氧化钠)中干燥3~4 h,再经氢气流干燥,最后进行真空干燥,得到产品21.6g。
回答下列问题:
(1)步骤②中过滤需要避光的原因是
(2)步骤①中实验所用蒸馏水事先要进行的处理操作是
(3)步骤③中洗涤剂需“溶有SO2”的原因是
(4)装置A中反应生成CuBr的离子方程式为
(5)本实验产品的产率是
您最近一年使用:0次
2017-05-15更新
|
501次组卷
|
3卷引用:贵州省遵义市南白中学2023-2024学年高一上学期期末化学模拟试卷



