解题方法
1 . 氧化亚铜和溴化亚铜均是常见的一价铜化合物,氧化亚铜在强酸性溶液中易发生歧化反应,溴化亚铜常用作有机合成原料和反应催化剂。
(1)可利用葡萄糖还原CuSO4溶液制备氧化亚铜。
①配制490mL0.1mol·L-1CuSO4溶液,需要称取胆矾晶体的质量为_______ 。
②某同学为检验CuO样品中是否含有Cu2O,可向样品中加入足量稀硫酸,若观察到_______ ,则说明样品中含有Cu2O杂质。
(2)向CuSO4和NaBr的混合溶液中通入足量的二氧化硫可得到溴化亚铜沉淀。完成该反应的离子方程式:□Cu2++□Br-+□SO2+□H2O=□CuBr↓+□ +□_____。
+□_____。_______ ,该反应完毕的现象标志是_______ ,洗涤CuBr沉淀时采用二氧化硫的水溶液而不采用蒸馏水的目的是_______ 。
(3)某小组同学取含有少量CuO杂质的Cu2O样品进行如下实验,以测定氧化亚铜的纯度。
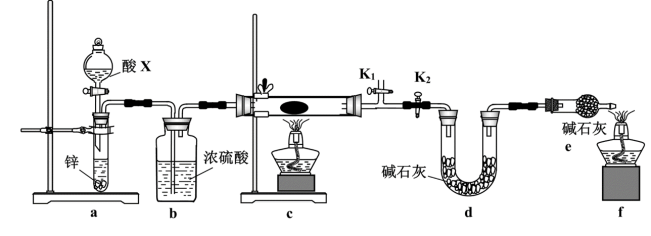
①装置a中所加的酸X是_______ (填化学式)。
②通过测定下列物理量,能达到实验目的的是_______ (填字母)。
A.反应前后装置a的质量 B.充分反应后装置c所得固体的质量
C.反应前后装置d的质量 D.反应前后装置e的质量
③熄灭酒精灯之后,仍需通一段时间H2至试管冷却,原因是_______ 。
(1)可利用葡萄糖还原CuSO4溶液制备氧化亚铜。
①配制490mL0.1mol·L-1CuSO4溶液,需要称取胆矾晶体的质量为
②某同学为检验CuO样品中是否含有Cu2O,可向样品中加入足量稀硫酸,若观察到
(2)向CuSO4和NaBr的混合溶液中通入足量的二氧化硫可得到溴化亚铜沉淀。完成该反应的离子方程式:□Cu2++□Br-+□SO2+□H2O=□CuBr↓+□
 +□_____。
+□_____。(3)某小组同学取含有少量CuO杂质的Cu2O样品进行如下实验,以测定氧化亚铜的纯度。

①装置a中所加的酸X是
②通过测定下列物理量,能达到实验目的的是
A.反应前后装置a的质量 B.充分反应后装置c所得固体的质量
C.反应前后装置d的质量 D.反应前后装置e的质量
③熄灭酒精灯之后,仍需通一段时间H2至试管冷却,原因是
您最近一年使用:0次
名校
解题方法
2 . 现用如图装置制取氯气,并用氯气制备 。回答下列问题:
。回答下列问题:
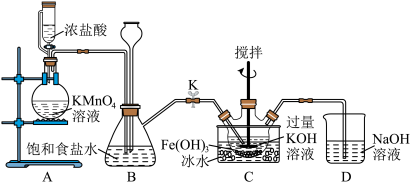
(1)盛浓盐酸的仪器名称为___________ ; 中铁元素的化合价为
中铁元素的化合价为___________ 。
(2)装置B有安全瓶作用,同时也可收集少量氯气,若关闭弹簧夹K,则B中的现象为___________ 。
(3)装置A中可产生 ,相应的离子方程式为
,相应的离子方程式为___________ 。
(4)装置C中制备 的化学反应方程式为
的化学反应方程式为___________ 。
(5)实验室可用间接碘量法测定所得 样品的纯度:称取
样品的纯度:称取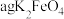 样品溶于淀粉
样品溶于淀粉 溶液中,调节
溶液中,调节 使混合液充分反应。用
使混合液充分反应。用 的
的 标准溶液进行滴定,消耗
标准溶液进行滴定,消耗 标准溶液
标准溶液 (已知:
(已知: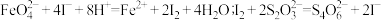 )。
)。
①滴定终点的现象为___________ 。
② 样品的纯度为
样品的纯度为___________ %(保留三位有效数字)。
 。回答下列问题:
。回答下列问题:
(1)盛浓盐酸的仪器名称为
 中铁元素的化合价为
中铁元素的化合价为(2)装置B有安全瓶作用,同时也可收集少量氯气,若关闭弹簧夹K,则B中的现象为
(3)装置A中可产生
 ,相应的离子方程式为
,相应的离子方程式为(4)装置C中制备
 的化学反应方程式为
的化学反应方程式为(5)实验室可用间接碘量法测定所得
 样品的纯度:称取
样品的纯度:称取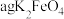 样品溶于淀粉
样品溶于淀粉 溶液中,调节
溶液中,调节 使混合液充分反应。用
使混合液充分反应。用 的
的 标准溶液进行滴定,消耗
标准溶液进行滴定,消耗 标准溶液
标准溶液 (已知:
(已知: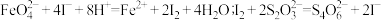 )。
)。①滴定终点的现象为
②
 样品的纯度为
样品的纯度为
您最近一年使用:0次
解题方法
3 . 硫酸四氨合铜晶体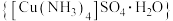 常作杀虫剂、媒染剂。某小组设计实验制备硫酸四氨合铜晶体并测定其纯度。
常作杀虫剂、媒染剂。某小组设计实验制备硫酸四氨合铜晶体并测定其纯度。
实验(一)制备 ,装置如图所示。
,装置如图所示。___________ 。该反应中浓硫酸表现出的性质有___________ 。
(2)持续反应一段时间后C装置中的现象为___________ 。
(3)将A装置中混合物缓慢倒人装有水的烧杯中,再加入过量的 ,充分反应后,过滤。将滤液蒸发浓缩、降温结晶、过滤,得到
,充分反应后,过滤。将滤液蒸发浓缩、降温结晶、过滤,得到 晶体。
晶体。
①不能向A装置的混合物中加入水,其原因是___________ 。
② 的作用是
的作用是___________ 。
实验(二)制备硫酸四氨合铜晶体。
 中蓝色沉淀溶解得到深蓝色的透明溶液,其原因是
中蓝色沉淀溶解得到深蓝色的透明溶液,其原因是___________ (写出离子方程式)。
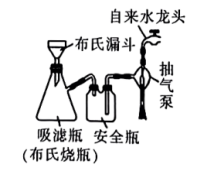
(5)相对普通过滤,利用图2装置分离晶体,其突出优点有___________ (答一条即可)。
实验(三)测定硫酸四氨合铜晶体纯度。
取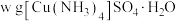 样品溶于蒸馏水配制成
样品溶于蒸馏水配制成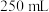 溶液,准确量取
溶液,准确量取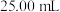 配制溶液,滴加适量的稀硫酸,充分反应。加入过量
配制溶液,滴加适量的稀硫酸,充分反应。加入过量 溶液,滴加3滴淀粉溶液,用
溶液,滴加3滴淀粉溶液,用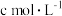
 溶液滴定,边滴边摇动锥形瓶至滴定终点,消耗
溶液滴定,边滴边摇动锥形瓶至滴定终点,消耗 溶液
溶液 。相关反应:
。相关反应: ,
, ,
,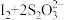
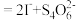 。
。
(6) 产品的纯度为
产品的纯度为___________ 。若①摇动锥形瓶时间过长,空气进入较多;②滴加稀硫酸过多,则上述两种情况可能会导致测得结果___________ (填字母)。(已知: 在酸性条件下不稳定,会发生歧化反应)
在酸性条件下不稳定,会发生歧化反应)
A.①偏高 ②偏低 B.①偏低 ②偏高 C.①偏高 ②偏高 D.①偏低 ②偏低
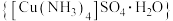 常作杀虫剂、媒染剂。某小组设计实验制备硫酸四氨合铜晶体并测定其纯度。
常作杀虫剂、媒染剂。某小组设计实验制备硫酸四氨合铜晶体并测定其纯度。实验(一)制备
 ,装置如图所示。
,装置如图所示。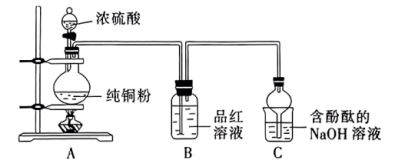
(2)持续反应一段时间后C装置中的现象为
(3)将A装置中混合物缓慢倒人装有水的烧杯中,再加入过量的
 ,充分反应后,过滤。将滤液蒸发浓缩、降温结晶、过滤,得到
,充分反应后,过滤。将滤液蒸发浓缩、降温结晶、过滤,得到 晶体。
晶体。①不能向A装置的混合物中加入水,其原因是
②
 的作用是
的作用是实验(二)制备硫酸四氨合铜晶体。
| 步骤 | 实验操作及主要现象 |
 | 取一定量 晶体溶于蒸馏水得到 晶体溶于蒸馏水得到 溶液 溶液 |
 | 向步骤 溶液中滴加一定量的氨水,产生蓝色沉淀;继续滴加氨水,蓝色沉淀逐渐溶解,最终得到深蓝色的透明溶液 溶液中滴加一定量的氨水,产生蓝色沉淀;继续滴加氨水,蓝色沉淀逐渐溶解,最终得到深蓝色的透明溶液 |
 | 向步骤 所得溶液中滴加 所得溶液中滴加 的乙醇,静置析出深蓝色晶体,用下图装置过滤 的乙醇,静置析出深蓝色晶体,用下图装置过滤 |
 | 取步骤 中晶体,用乙醇与浓氨水的混合液洗涤,再用乙醇与乙醚的混合液淋洗,然后将其在 中晶体,用乙醇与浓氨水的混合液洗涤,再用乙醇与乙醚的混合液淋洗,然后将其在 左右小心烘干,得到 左右小心烘干,得到 |
 中蓝色沉淀溶解得到深蓝色的透明溶液,其原因是
中蓝色沉淀溶解得到深蓝色的透明溶液,其原因是(5)相对普通过滤,利用图2装置分离晶体,其突出优点有
实验(三)测定硫酸四氨合铜晶体纯度。
取
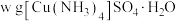 样品溶于蒸馏水配制成
样品溶于蒸馏水配制成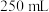 溶液,准确量取
溶液,准确量取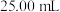 配制溶液,滴加适量的稀硫酸,充分反应。加入过量
配制溶液,滴加适量的稀硫酸,充分反应。加入过量 溶液,滴加3滴淀粉溶液,用
溶液,滴加3滴淀粉溶液,用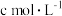
 溶液滴定,边滴边摇动锥形瓶至滴定终点,消耗
溶液滴定,边滴边摇动锥形瓶至滴定终点,消耗 溶液
溶液 。相关反应:
。相关反应: ,
, ,
,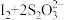
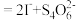 。
。(6)
 产品的纯度为
产品的纯度为 在酸性条件下不稳定,会发生歧化反应)
在酸性条件下不稳定,会发生歧化反应)A.①偏高 ②偏低 B.①偏低 ②偏高 C.①偏高 ②偏高 D.①偏低 ②偏低
您最近一年使用:0次
解题方法
4 . 硫代硫酸钠在纺织业等领域有广泛应用。某兴趣小组用如图所示装置制备 。
。 易溶于水,难溶于乙醇,
易溶于水,难溶于乙醇,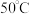 以上会逐渐失去结晶水。
以上会逐渐失去结晶水。
(ⅱ)合成反应: ;
; ;
; 。
。
实验步骤:
Ⅰ. 制备:装置
制备:装置 制备的
制备的 经过单向阀通入装置
经过单向阀通入装置 中的混合溶液中,加热、搅拌,至溶液
中的混合溶液中,加热、搅拌,至溶液 约为7时,停止通入
约为7时,停止通入 气体,得产品混合溶液。
气体,得产品混合溶液。
Ⅱ.产品分离提纯:产品混合溶液经蒸发浓缩、冷却结晶、过滤、洗涤、干燥,即可得 粗产品。
粗产品。
Ⅲ.产品纯度测定:取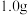 粗产品配制成
粗产品配制成 溶液,用移液管取
溶液,用移液管取 于锥形瓶中、以淀粉溶液作指示剂,用浓度为0.0250mol/L的碘标准溶液滴定至终点,重复实验3次,平均消耗碘标准溶液
于锥形瓶中、以淀粉溶液作指示剂,用浓度为0.0250mol/L的碘标准溶液滴定至终点,重复实验3次,平均消耗碘标准溶液 ,计算
,计算 的含量(滴定反应:
的含量(滴定反应: )。请回答:
)。请回答:
(1)盛装浓硫酸的仪器名称为_______ ,步骤Ⅰ中单向阀的作用是_______ 。
(2)步骤Ⅰ中 不宜低于7的原因是
不宜低于7的原因是_______ ;装置C中生成 的总反应的化学方程式是
的总反应的化学方程式是_______ 。
(3)步骤Ⅱ中使用乙醇洗涤晶体的优点有_______ 。
(4)①步骤Ⅲ中滴定终点的现象为_______ ,该粗品中 的质量分数为
的质量分数为_______ 。
②下列操作会使测定结果偏高的是_______ (填字母)
A.滴定前滴定管尖端有气泡,终点则气泡消失
B.当滴定至溶液突然变蓝时,立即俯视读数
C.实验中用末润洗的移液管移取 溶液
溶液
 。
。
 易溶于水,难溶于乙醇,
易溶于水,难溶于乙醇,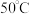 以上会逐渐失去结晶水。
以上会逐渐失去结晶水。(ⅱ)合成反应:
 ;
; ;
; 。
。实验步骤:
Ⅰ.
 制备:装置
制备:装置 制备的
制备的 经过单向阀通入装置
经过单向阀通入装置 中的混合溶液中,加热、搅拌,至溶液
中的混合溶液中,加热、搅拌,至溶液 约为7时,停止通入
约为7时,停止通入 气体,得产品混合溶液。
气体,得产品混合溶液。Ⅱ.产品分离提纯:产品混合溶液经蒸发浓缩、冷却结晶、过滤、洗涤、干燥,即可得
 粗产品。
粗产品。Ⅲ.产品纯度测定:取
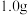 粗产品配制成
粗产品配制成 溶液,用移液管取
溶液,用移液管取 于锥形瓶中、以淀粉溶液作指示剂,用浓度为0.0250mol/L的碘标准溶液滴定至终点,重复实验3次,平均消耗碘标准溶液
于锥形瓶中、以淀粉溶液作指示剂,用浓度为0.0250mol/L的碘标准溶液滴定至终点,重复实验3次,平均消耗碘标准溶液 ,计算
,计算 的含量(滴定反应:
的含量(滴定反应: )。请回答:
)。请回答:(1)盛装浓硫酸的仪器名称为
(2)步骤Ⅰ中
 不宜低于7的原因是
不宜低于7的原因是 的总反应的化学方程式是
的总反应的化学方程式是(3)步骤Ⅱ中使用乙醇洗涤晶体的优点有
(4)①步骤Ⅲ中滴定终点的现象为
 的质量分数为
的质量分数为②下列操作会使测定结果偏高的是
A.滴定前滴定管尖端有气泡,终点则气泡消失
B.当滴定至溶液突然变蓝时,立即俯视读数
C.实验中用末润洗的移液管移取
 溶液
溶液
您最近一年使用:0次
解题方法
5 .  (三氯化六氨合钴)属于经典配合物,实验室以
(三氯化六氨合钴)属于经典配合物,实验室以 为原料制备
为原料制备 的方法和过程如下:
的方法和过程如下:
Ⅰ.制备 。
。
已知:钴单质与氯气在加热条件下反应可制得纯净 ,钴单质在300℃以上易被氧气氧化;
,钴单质在300℃以上易被氧气氧化; 的熔点为86℃,易潮解。
的熔点为86℃,易潮解。
制备装置如图:
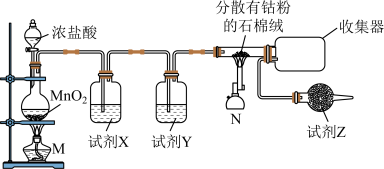
(1)试剂X是___________ ;试剂Z的作用为___________ 。
(2)上述装置制取氯气的化学方程式为___________ 。
Ⅱ.制备 ——配合、氧化。
——配合、氧化。
步骤ⅰ:在锥形瓶中,将4g 固体溶于8.4mL水中,再加入6g研细的
固体溶于8.4mL水中,再加入6g研细的 晶体,溶解得到混合溶液。
晶体,溶解得到混合溶液。
步骤ⅱ:将上述混合溶液转移至三颈烧瓶中,加入研细的活性炭和浓氨水,再逐滴加入 溶液,水浴加热至50~60℃,保持20min。然后用冰水浴冷却至0℃左右,抽滤,得粗产品。
溶液,水浴加热至50~60℃,保持20min。然后用冰水浴冷却至0℃左右,抽滤,得粗产品。
(3)滴加 时若速度过快,产物中会含有
时若速度过快,产物中会含有 杂质,原因为
杂质,原因为___________ 。
(4)水浴加热温度控制在50~60℃,温度不宜过高的原因是___________ 。
Ⅲ.测定 产品纯度。
产品纯度。
(5)用如图装置测定产品中 的含量(部分装置已省略):
的含量(部分装置已省略):

①蒸氨:取 样品(杂质不参与反应)加入过量试剂后,加热三颈烧瓶,蒸出的
样品(杂质不参与反应)加入过量试剂后,加热三颈烧瓶,蒸出的 通入盛有
通入盛有
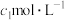
 标准溶液的锥形瓶中。液封装置2的作用是
标准溶液的锥形瓶中。液封装置2的作用是___________ 。
②滴定:将液封装置2中的水倒入锥形瓶后,使用甲基橙作指示剂,用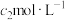
 溶液滴定剩余的
溶液滴定剩余的 ,到达滴定终点时消耗
,到达滴定终点时消耗
 溶液。滴定终点的现象为
溶液。滴定终点的现象为___________ 。
 (三氯化六氨合钴)属于经典配合物,实验室以
(三氯化六氨合钴)属于经典配合物,实验室以 为原料制备
为原料制备 的方法和过程如下:
的方法和过程如下:Ⅰ.制备
 。
。已知:钴单质与氯气在加热条件下反应可制得纯净
 ,钴单质在300℃以上易被氧气氧化;
,钴单质在300℃以上易被氧气氧化; 的熔点为86℃,易潮解。
的熔点为86℃,易潮解。制备装置如图:

(1)试剂X是
(2)上述装置制取氯气的化学方程式为
Ⅱ.制备
 ——配合、氧化。
——配合、氧化。步骤ⅰ:在锥形瓶中,将4g
 固体溶于8.4mL水中,再加入6g研细的
固体溶于8.4mL水中,再加入6g研细的 晶体,溶解得到混合溶液。
晶体,溶解得到混合溶液。步骤ⅱ:将上述混合溶液转移至三颈烧瓶中,加入研细的活性炭和浓氨水,再逐滴加入
 溶液,水浴加热至50~60℃,保持20min。然后用冰水浴冷却至0℃左右,抽滤,得粗产品。
溶液,水浴加热至50~60℃,保持20min。然后用冰水浴冷却至0℃左右,抽滤,得粗产品。(3)滴加
 时若速度过快,产物中会含有
时若速度过快,产物中会含有 杂质,原因为
杂质,原因为(4)水浴加热温度控制在50~60℃,温度不宜过高的原因是
Ⅲ.测定
 产品纯度。
产品纯度。(5)用如图装置测定产品中
 的含量(部分装置已省略):
的含量(部分装置已省略):
①蒸氨:取
 样品(杂质不参与反应)加入过量试剂后,加热三颈烧瓶,蒸出的
样品(杂质不参与反应)加入过量试剂后,加热三颈烧瓶,蒸出的 通入盛有
通入盛有
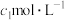
 标准溶液的锥形瓶中。液封装置2的作用是
标准溶液的锥形瓶中。液封装置2的作用是②滴定:将液封装置2中的水倒入锥形瓶后,使用甲基橙作指示剂,用
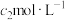
 溶液滴定剩余的
溶液滴定剩余的 ,到达滴定终点时消耗
,到达滴定终点时消耗
 溶液。滴定终点的现象为
溶液。滴定终点的现象为
您最近一年使用:0次
名校
6 . 科学家舍勒和戴维对氯气的制取和研究做出了重大贡献。某兴趣小组利用所给仪器在实验室制备纯净干燥的氯气,并模拟工业制漂白粉。请回答下列问题:
I.氯气的制备(装置如图所示)

(1)装置G的名称为_______ ,装置F的作用为_______ 。
(2)从图中选择合适装置制备并收集纯净干燥的氯气(仪器不重复使用),仪器连接顺序为_______ (填写仪器下方字母)。
II.漂白粉的制备( 装置如图所示)
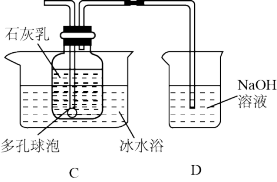
查阅资料可知:①氯气与碱反应放出热量;
②6Cl2+6Ca(OH)2 CaCl2+Ca(ClO3)2+6H2O。
CaCl2+Ca(ClO3)2+6H2O。
(3)装置C中发生反应的化学方程式为_______ 。
(4)多孔球泡的作用是_______ ,使用冰水浴的目的是_______ 。
(5)测定装置C中Ca(ClO)2物质的量浓度的方法如下:取C中溶液10.0mL于锥形瓶中,加入硫酸酸化,加入过量KI溶液,盖紧瓶塞并在暗处充分发生反应ClO-+2I-+2H+=I2+Cl- +H2O。用0.1000 mol·L-1Na2S2O3标准溶液滴定该锥形瓶中的溶液,滴入2~3滴淀粉指示剂,当加入最后一滴 Na2S2O3标准溶液时,其现象为_______ 达到滴定终点,此时消耗Na2S2O3溶液的体积为20.00mL。 (已知: I2+2S2O =2I- +S4O
=2I- +S4O 。该漂白粉溶液中Ca(ClO)2的物质的量浓度为
。该漂白粉溶液中Ca(ClO)2的物质的量浓度为_______ mol/L。(保留4位有效数字)
I.氯气的制备(装置如图所示)

(1)装置G的名称为
(2)从图中选择合适装置制备并收集纯净干燥的氯气(仪器不重复使用),仪器连接顺序为
II.漂白粉的制备( 装置如图所示)

查阅资料可知:①氯气与碱反应放出热量;
②6Cl2+6Ca(OH)2
 CaCl2+Ca(ClO3)2+6H2O。
CaCl2+Ca(ClO3)2+6H2O。(3)装置C中发生反应的化学方程式为
(4)多孔球泡的作用是
(5)测定装置C中Ca(ClO)2物质的量浓度的方法如下:取C中溶液10.0mL于锥形瓶中,加入硫酸酸化,加入过量KI溶液,盖紧瓶塞并在暗处充分发生反应ClO-+2I-+2H+=I2+Cl- +H2O。用0.1000 mol·L-1Na2S2O3标准溶液滴定该锥形瓶中的溶液,滴入2~3滴淀粉指示剂,当加入最后一滴 Na2S2O3标准溶液时,其现象为
 =2I- +S4O
=2I- +S4O 。该漂白粉溶液中Ca(ClO)2的物质的量浓度为
。该漂白粉溶液中Ca(ClO)2的物质的量浓度为
您最近一年使用:0次
2022-09-30更新
|
871次组卷
|
4卷引用:贵州省六校联盟2022-2023学年高三上学期高考实用性联考(一)理科综合化学试题
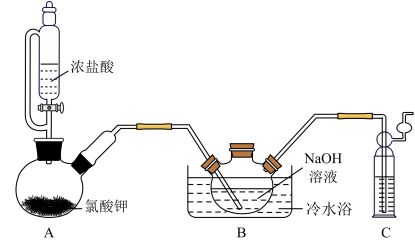
解题方法
7 . 二氯异氰尿酸钠[(CNO)3Cl2Na]是常用的杀菌消毒剂,常温下为白色固体,难溶于冷水。某同学利用高浓度的NaClO溶液和(CNO)3H3固体,在10℃时反应制备二氯异氰尿酸钠,实验装置如图所示(部分夹持装置略)。
已知:2NaClO+(CNO)3H3=(CNO)3Cl2Na+NaOH+H2O,
回答下列问题:
(1)装置A中制备Cl2的化学方程式为_______ 。
(2)待装置B_______ (填实验现象)时,再由三颈烧瓶上口加入(CNO)3H3固体;反应过程中仍需不断通入Cl2的理由是_______ 。
(3)通过下列实验测定二氯异氰尿酸钠样品中有效氯的含量。
反应原理:
[(CNO)3Cl2]-+H++2H2O=(CNO)3H3+2HClO
HClO+2I-+H+=I2+Cl-+H2O
I2+2S2O =S4O
=S4O +2I-
+2I-
实验步骤:准确称取mg样品,用容量瓶配成250mL溶液;取25.00mL上述溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,充分反应后,用cmol/LNa2S2O3标准溶液滴定至溶液呈微黄色。加入淀粉指示剂继续滴定至终点,消耗Na2S2O3溶液平均为VmL。
①滴定终点现象为_______ 。
②该样品的有效氯含量表达式为_______ 。 (该样品的有效氯=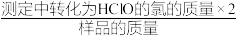 ×100%)
×100%)

已知:2NaClO+(CNO)3H3=(CNO)3Cl2Na+NaOH+H2O,
回答下列问题:
(1)装置A中制备Cl2的化学方程式为
(2)待装置B
(3)通过下列实验测定二氯异氰尿酸钠样品中有效氯的含量。
反应原理:
[(CNO)3Cl2]-+H++2H2O=(CNO)3H3+2HClO
HClO+2I-+H+=I2+Cl-+H2O
I2+2S2O
 =S4O
=S4O +2I-
+2I-实验步骤:准确称取mg样品,用容量瓶配成250mL溶液;取25.00mL上述溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,充分反应后,用cmol/LNa2S2O3标准溶液滴定至溶液呈微黄色。加入淀粉指示剂继续滴定至终点,消耗Na2S2O3溶液平均为VmL。
①滴定终点现象为
②该样品的有效氯含量表达式为
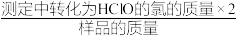 ×100%)
×100%)
您最近一年使用:0次
8 . 硫代硫酸钠晶体(Na2S2O3·5H2O,M=248g·mol−1)易溶于水,难溶于乙醇,50℃开始失结晶水。某实验室模拟工业上制取硫代硫酸钠晶体并对其纯度进行测定,反应装置和试剂如下图,回答下列问题:
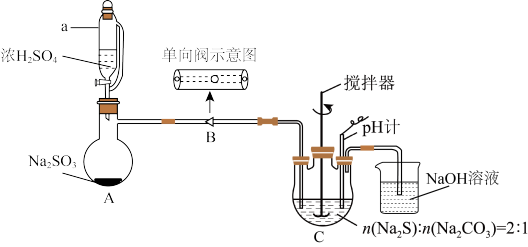
Ⅰ、 制备:
制备:
①装置A制备的 经过单向阀通入装置C中的混合溶液,水浴加热,搅拌,至溶液
经过单向阀通入装置C中的混合溶液,水浴加热,搅拌,至溶液 约为7时,停止通入
约为7时,停止通入 气体,得产品混合溶液。
气体,得产品混合溶液。
②产品分离提纯:产品混合溶液经蒸发浓缩、冷却结晶、抽滤(减压过滤)、洗涤、干燥,得到 产品。
产品。
(1)仪器a的名称___________ 。
(2)步骤①中单向阀的作用是___________ ;三颈烧瓶C中制取Na2S2O3反应的总化学方程式为___________ 。
(3)步骤②中采用抽滤的目的是___________ 。
(4)市售硫代硫酸钠中常含有硫酸根杂质,选用下列试剂设计实验方案进行检验,已知:BaSO4与BaS2O3均为白色沉淀。
试剂:稀盐酸、稀H2SO4、BaCl2溶液、Na2CO3溶液、H2O2溶液
①取少量样品,加入除氧蒸馏水,固体完全溶解得无色澄清溶液;
②向①的溶液中加入过量___________ ,出现乳黄色浑浊,有刺激性气体产生,反应的离子方程式为___________ ;
③静置,取上层清液,滴入BaCl2溶液,产生白色沉淀。
Ⅱ、产品纯度测定:取6.00g产品,配制成100mL溶液。取10.00mL溶液,以淀粉溶液为指示剂(2S2O +I2=S4O
+I2=S4O +2I−),用浓度为0.0500mol·L−1的I2标准溶液进行滴定,平均消耗标准液体积20.00mL。
+2I−),用浓度为0.0500mol·L−1的I2标准溶液进行滴定,平均消耗标准液体积20.00mL。
(5)产品纯度测定中,滴定终点现象为___________ ,Na2S2O3·5H2O的纯度为___________ %(保留1位小数)。

Ⅰ、
 制备:
制备:①装置A制备的
 经过单向阀通入装置C中的混合溶液,水浴加热,搅拌,至溶液
经过单向阀通入装置C中的混合溶液,水浴加热,搅拌,至溶液 约为7时,停止通入
约为7时,停止通入 气体,得产品混合溶液。
气体,得产品混合溶液。②产品分离提纯:产品混合溶液经蒸发浓缩、冷却结晶、抽滤(减压过滤)、洗涤、干燥,得到
 产品。
产品。(1)仪器a的名称
(2)步骤①中单向阀的作用是
(3)步骤②中采用抽滤的目的是
(4)市售硫代硫酸钠中常含有硫酸根杂质,选用下列试剂设计实验方案进行检验,已知:BaSO4与BaS2O3均为白色沉淀。
试剂:稀盐酸、稀H2SO4、BaCl2溶液、Na2CO3溶液、H2O2溶液
①取少量样品,加入除氧蒸馏水,固体完全溶解得无色澄清溶液;
②向①的溶液中加入过量
③静置,取上层清液,滴入BaCl2溶液,产生白色沉淀。
Ⅱ、产品纯度测定:取6.00g产品,配制成100mL溶液。取10.00mL溶液,以淀粉溶液为指示剂(2S2O
 +I2=S4O
+I2=S4O +2I−),用浓度为0.0500mol·L−1的I2标准溶液进行滴定,平均消耗标准液体积20.00mL。
+2I−),用浓度为0.0500mol·L−1的I2标准溶液进行滴定,平均消耗标准液体积20.00mL。(5)产品纯度测定中,滴定终点现象为
您最近一年使用:0次
9 . 实验室用Cl2氧化K2MnO4来制备KMnO4,装置如图1所示:
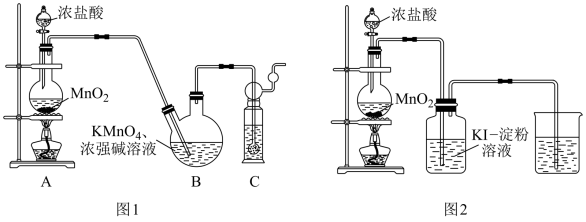
已知:K2MnO4在浓强碱溶液中可稳定存在,碱性减弱时易发生反应3MnO + 2H2O=2
+ 2H2O=2 +MnO2↓+4OH-。
+MnO2↓+4OH-。
请回答下列问题:。
(1)K2 MnO4中锰元素的化合价为___________ 价。
(2)装置B中生成KMnO4的离子方程式为___________
(3)进入装置B的Cl2中含有杂质HCl,HCl___________ (填“ 需要”或“不需要”)除去,理由是___________ 。
(4)甲同学设计如图2所示的实验来研究二氧化锰与盐酸的反应情况,各组实验参数如表所示:
根据第一组、第二组的实验可得出的结论是___________ ,根据第 三组实验可得出的结论是___________ 。
(5)为测定某NaHSO3固体的纯度,现用0. 1000 mol·L-1的酸性KMnO4溶液进行滴定。(已知: 2 +5
+5 +H+=2Mn2+ +5
+H+=2Mn2+ +5 +3H2O)
+3H2O)
①称取W g NaHSO3固体溶于水配成100 mL溶液,下列仪器在该过程中肯定不需要用到的是___________ (填仪器名称)。
a. b.
b. c.
c. d.
d.
②取25.00mLNaHSO3溶液置于锥形瓶中,用酸性KMnO4溶液滴定至终点,消耗KMnO4溶液VmL。滴定终点的现象为。___________ ,NaHSO3固体的纯度为___________ (用含V 和W的代数式表示)。

已知:K2MnO4在浓强碱溶液中可稳定存在,碱性减弱时易发生反应3MnO
 + 2H2O=2
+ 2H2O=2 +MnO2↓+4OH-。
+MnO2↓+4OH-。请回答下列问题:。
(1)K2 MnO4中锰元素的化合价为
(2)装置B中生成KMnO4的离子方程式为
(3)进入装置B的Cl2中含有杂质HCl,HCl
(4)甲同学设计如图2所示的实验来研究二氧化锰与盐酸的反应情况,各组实验参数如表所示:
| 组别 | 反应条件 | 盐酸浓度 | 淀粉—KI溶液的颜色变化 |
| 第一组 | 微热 | 10mol/L | 变蓝色 |
| 第二组 | 常温 | 10mol/L | 不变色 |
| 第三组 | 微热 | 5mol/L | 不变色 |
(5)为测定某NaHSO3固体的纯度,现用0. 1000 mol·L-1的酸性KMnO4溶液进行滴定。(已知: 2
 +5
+5 +H+=2Mn2+ +5
+H+=2Mn2+ +5 +3H2O)
+3H2O)①称取W g NaHSO3固体溶于水配成100 mL溶液,下列仪器在该过程中肯定不需要用到的是
a.
 b.
b. c.
c. d.
d.
②取25.00mLNaHSO3溶液置于锥形瓶中,用酸性KMnO4溶液滴定至终点,消耗KMnO4溶液VmL。滴定终点的现象为。
您最近一年使用:0次
解题方法
10 . 某化学兴趣小组在实验室探究SO2的相关性质
Ⅰ.制备并收集SO2仪器
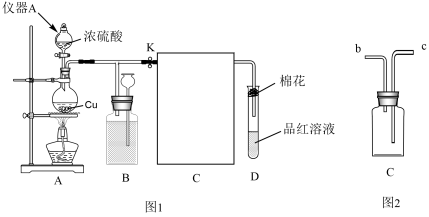
(1)仪器a名称为___ ,装置A中发生反应的化学方程式为___ 。
(2)把图2装置C接回图1装置中,按照从左往右的顺序应该先连接____ (填b或c),当D中出现____ 现象时,证明气体已集满,停止加热。装置D中试管口的棉花应提前在___ 溶液(填化学式)中浸湿。
(3)当D处有明显的现象时,关闭旋塞K,移去酒精灯。但由于余热的作用,A处仍有气体产生,B中盛放的液体是____ (填字母)。
a.水 b.酸性高锰酸钾溶液 c.饱和NaHSO3溶液 d.浓硫酸
Ⅱ.探究SO2和Na2O2的反应

(4)将实验Ⅰ中收集的SO2直接通入E中,将带火星的木条靠近F的试管口,发现木条复燃,据此现象甲同学认为SO2和CO2性质相似,其产物应为Na2SO3和O2,但是乙同学不赞同,他认为木条复燃可能另有原因,请用化学方程式来解释乙的观点____ 。
(5)丙同学认为两种盐都有,取 中完全反应后所得的固体进行如下操作:
中完全反应后所得的固体进行如下操作:
充分反应之后,将沉淀过滤、洗涤、干燥、称量最后剩余固体质量为bg,则Na2SO3在原固体中所占质量分数为____ (用含a和b的计算式表达。已知BaSO4的摩尔质量为223g/mol;Na2SO4的摩尔质量为142g/mol)。
Ⅰ.制备并收集SO2仪器

(1)仪器a名称为
(2)把图2装置C接回图1装置中,按照从左往右的顺序应该先连接
(3)当D处有明显的现象时,关闭旋塞K,移去酒精灯。但由于余热的作用,A处仍有气体产生,B中盛放的液体是
a.水 b.酸性高锰酸钾溶液 c.饱和NaHSO3溶液 d.浓硫酸
Ⅱ.探究SO2和Na2O2的反应

(4)将实验Ⅰ中收集的SO2直接通入E中,将带火星的木条靠近F的试管口,发现木条复燃,据此现象甲同学认为SO2和CO2性质相似,其产物应为Na2SO3和O2,但是乙同学不赞同,他认为木条复燃可能另有原因,请用化学方程式来解释乙的观点
(5)丙同学认为两种盐都有,取
 中完全反应后所得的固体进行如下操作:
中完全反应后所得的固体进行如下操作:| 操作 | 现象 | 结论 | |
| ⅰ | 取agE中固体溶于水,加入足量BaCl2溶液 | 有白色沉淀产生 | |
| ⅱ | 将浊液过滤,然后向沉淀中加入过量盐酸 | 丙同学假设成立 |
您最近一年使用:0次



