1 . 应用下列装置测定氨气的组成。实验利用了氨气能还原氧化铜生成氮气、铜和水的原理。实验后测得装置D增重ag,用排水法测量得 的体积为bL(已折算成标准状况)。下列有关实验描述正确的是
的体积为bL(已折算成标准状况)。下列有关实验描述正确的是

 的体积为bL(已折算成标准状况)。下列有关实验描述正确的是
的体积为bL(已折算成标准状况)。下列有关实验描述正确的是
| A.装置A用于制备氨气,可用加热氯化铵固体的装置代替 |
| B.装置E的作用是防止水蒸气进入装置D中,若撤去装置E,则测得氮氢比偏小 |
| C.装置B的作用是干燥氨气,可替换成无水氯化钙 |
D.由实验数据可以计算得到氨气分子中的氮氢个数比为 |
您最近一年使用:0次
名校
2 . 高纯碳酸锰广泛应用于电子工业,是制备高性能磁性材料的原料。某化学小组在实验室模拟用软锰矿粉(主要成分为 )制备
)制备 。回答下列问题:
。回答下列问题:
(1)制备 溶液:将mg软锰矿粉经除杂后制得
溶液:将mg软锰矿粉经除杂后制得 浊液,向
浊液,向 浊液中通入
浊液中通入 ,制得
,制得 溶液,实验装置如图所示(夹持和加热装置略)。
溶液,实验装置如图所示(夹持和加热装置略)。
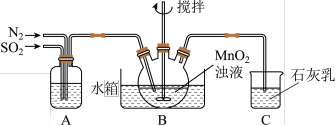
①通过装置A可观察通入: 与
与 的快慢,则A中加入的最佳试剂是
的快慢,则A中加入的最佳试剂是____________ ;
②装置C的作用是______ ;
③ 转化为
转化为 的离子方程式为
的离子方程式为____________ ;
④实验中若将 换成空气,将导致
换成空气,将导致 浓度明显大于
浓度明显大于 ,浓度,原因是
,浓度,原因是____________ 。
(2)制备 固体:在搅拌下向
固体:在搅拌下向 溶液中缓慢滴加
溶液中缓慢滴加 溶液,有浅红色的沉淀生成,过滤、洗涤、干燥,得到高纯碳酸锰。生成
溶液,有浅红色的沉淀生成,过滤、洗涤、干燥,得到高纯碳酸锰。生成 的离子方程式为
的离子方程式为______ 。检验沉淀是否洗涤干净的方法是______ 。
(3)测定碳酸锰产品的纯度:称取0.2500g碳酸锰产品于锥形瓶中,加12.50mL磷酸,加热后,立即加入1g硝酸铵,充分反应后,碳酸锰全部转化为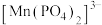 ,多余的硝酸铵全部分解,除去氮氧化物后,冷却至室温。将上述所得溶液加水稀释至50mL,滴加2~3滴指示剂,然后用0.1000 mol⋅L
,多余的硝酸铵全部分解,除去氮氧化物后,冷却至室温。将上述所得溶液加水稀释至50mL,滴加2~3滴指示剂,然后用0.1000 mol⋅L 的硫酸亚铁铵
的硫酸亚铁铵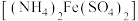 标准溶液滴定[反应为
标准溶液滴定[反应为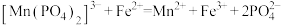 ],重复操作3次,记录数据如表:(已知:
],重复操作3次,记录数据如表:(已知: 的摩尔质量为115g/mol)
的摩尔质量为115g/mol)
则产品的纯度为______ 。若滴定终点时仰视读数,则测得的碳酸锰产品的纯度______ (填“偏高”“偏低”或“无影响”)。
 )制备
)制备 。回答下列问题:
。回答下列问题:(1)制备
 溶液:将mg软锰矿粉经除杂后制得
溶液:将mg软锰矿粉经除杂后制得 浊液,向
浊液,向 浊液中通入
浊液中通入 ,制得
,制得 溶液,实验装置如图所示(夹持和加热装置略)。
溶液,实验装置如图所示(夹持和加热装置略)。
①通过装置A可观察通入:
 与
与 的快慢,则A中加入的最佳试剂是
的快慢,则A中加入的最佳试剂是②装置C的作用是
③
 转化为
转化为 的离子方程式为
的离子方程式为④实验中若将
 换成空气,将导致
换成空气,将导致 浓度明显大于
浓度明显大于 ,浓度,原因是
,浓度,原因是(2)制备
 固体:在搅拌下向
固体:在搅拌下向 溶液中缓慢滴加
溶液中缓慢滴加 溶液,有浅红色的沉淀生成,过滤、洗涤、干燥,得到高纯碳酸锰。生成
溶液,有浅红色的沉淀生成,过滤、洗涤、干燥,得到高纯碳酸锰。生成 的离子方程式为
的离子方程式为(3)测定碳酸锰产品的纯度:称取0.2500g碳酸锰产品于锥形瓶中,加12.50mL磷酸,加热后,立即加入1g硝酸铵,充分反应后,碳酸锰全部转化为
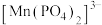 ,多余的硝酸铵全部分解,除去氮氧化物后,冷却至室温。将上述所得溶液加水稀释至50mL,滴加2~3滴指示剂,然后用0.1000 mol⋅L
,多余的硝酸铵全部分解,除去氮氧化物后,冷却至室温。将上述所得溶液加水稀释至50mL,滴加2~3滴指示剂,然后用0.1000 mol⋅L 的硫酸亚铁铵
的硫酸亚铁铵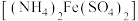 标准溶液滴定[反应为
标准溶液滴定[反应为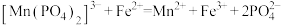 ],重复操作3次,记录数据如表:(已知:
],重复操作3次,记录数据如表:(已知: 的摩尔质量为115g/mol)
的摩尔质量为115g/mol)滴定次数 | 0.1000 mol⋅L | |
滴定前 | 滴定后 | |
1 | 1.15 | 11.05 |
2 | 0.12 | 11.42 |
3 | 0.30 | 10.40 |
您最近一年使用:0次
名校
3 . 苯乙酸铜是合成优良催化剂、传感材料—纳米氧化铜的重要前驱体之一、下面是它的一种实验室合成路线:
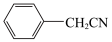
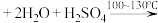
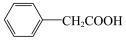

2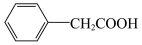
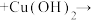 (
(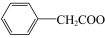 )
)
制备苯乙酸的装置示意图如图所示(加热和夹持装置等略)。
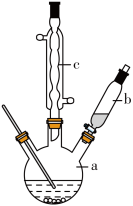
已知:苯乙酸的熔点为76.5℃,微溶于冷水,溶于乙醇。
回答下列问题:
(1)将a中的溶液加热至100℃,缓缓滴加40g苯乙腈到硫酸溶液中,然后升温至130℃继续反应。在装置中,仪器c的名称是___________ ,其作用是___________ 。
(2)反应结束后加适量冷水,再分离出苯乙酸粗品。加入冷水的目的是___________ 。
(3)分离苯乙酸粗品的方法是___________ ,提纯粗苯乙酸的方法是___________ 。最终得到44g纯品,则苯乙酸的产率是___________ (保留两位有效数字)。
(4)用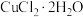 和NaOH溶液制备适量
和NaOH溶液制备适量 沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是
沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是___________ 。
(5)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后,加入 搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是
搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是___________ 。

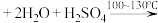
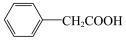

2
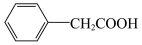
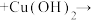 (
( )
)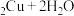
制备苯乙酸的装置示意图如图所示(加热和夹持装置等略)。

已知:苯乙酸的熔点为76.5℃,微溶于冷水,溶于乙醇。
回答下列问题:
(1)将a中的溶液加热至100℃,缓缓滴加40g苯乙腈到硫酸溶液中,然后升温至130℃继续反应。在装置中,仪器c的名称是
(2)反应结束后加适量冷水,再分离出苯乙酸粗品。加入冷水的目的是
(3)分离苯乙酸粗品的方法是
(4)用
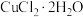 和NaOH溶液制备适量
和NaOH溶液制备适量 沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是
沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是(5)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后,加入
 搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是
搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是
您最近一年使用:0次
2023-04-30更新
|
206次组卷
|
4卷引用:T15-实验综合题
名校
解题方法
4 . 尿素[CO(NH2)2]是目前使用量较大的一种化学氮肥。某化学实验小组以尿素为原料制备 (水合肼)并验证水合肼还原性的实验流程如图1所示:
(水合肼)并验证水合肼还原性的实验流程如图1所示:

已知① 沸点用196.6℃;
沸点用196.6℃;
② 沸点为118℃,且能与NaClO剧烈反应生成
沸点为118℃,且能与NaClO剧烈反应生成 。
。
I. 的制备
的制备
(1)从图2的A~E中选择合适的装置制备并收集较纯净的 ,各装置合理的连接顺序为a→_______→_______→_______→_______→_______→_______→d。
,各装置合理的连接顺序为a→_______→_______→_______→_______→_______→_______→d。__________

(2)“步骤一”在高温条件下会有副反应发生,为确保该步骤在低温环境下进行,常采取的措施为_______ ,该步骤发生反应的离子方程式为_______ 。
(3)“步骤二”在图3所示装置中完成。为了避免生成 ,将滴液漏斗b中的NaClO与NaOH混合液缓慢滴入盛有mg尿素的三颈烧瓶a中,边滴加边搅拌,温度迅速升高到120℃。
,将滴液漏斗b中的NaClO与NaOH混合液缓慢滴入盛有mg尿素的三颈烧瓶a中,边滴加边搅拌,温度迅速升高到120℃。

①仪器c的名称为_______
②生成水合肼的化学方程式为_______ 。
Ⅱ.验证 的还原性
的还原性
(4)将“步骤二”制得的水合肼配成1000mL溶液,移出25mL于锥形瓶中,滴加2滴淀粉溶液,用0.05mol/L的 溶液滴定,当滴定完全时,消耗
溶液滴定,当滴定完全时,消耗 溶液VmL。
溶液VmL。
①滴定过程中水合肼被氧化为 ,反应的化学方程式为
,反应的化学方程式为_______ 。
②配成的水合肼的浓度
_______ mol/L(用含V的代数式表示)。
③ 的产率为
的产率为_______ (用含m、V的代数式表示)。
 (水合肼)并验证水合肼还原性的实验流程如图1所示:
(水合肼)并验证水合肼还原性的实验流程如图1所示:
已知①
 沸点用196.6℃;
沸点用196.6℃;②
 沸点为118℃,且能与NaClO剧烈反应生成
沸点为118℃,且能与NaClO剧烈反应生成 。
。I.
 的制备
的制备(1)从图2的A~E中选择合适的装置制备并收集较纯净的
 ,各装置合理的连接顺序为a→_______→_______→_______→_______→_______→_______→d。
,各装置合理的连接顺序为a→_______→_______→_______→_______→_______→_______→d。
(2)“步骤一”在高温条件下会有副反应发生,为确保该步骤在低温环境下进行,常采取的措施为
(3)“步骤二”在图3所示装置中完成。为了避免生成
 ,将滴液漏斗b中的NaClO与NaOH混合液缓慢滴入盛有mg尿素的三颈烧瓶a中,边滴加边搅拌,温度迅速升高到120℃。
,将滴液漏斗b中的NaClO与NaOH混合液缓慢滴入盛有mg尿素的三颈烧瓶a中,边滴加边搅拌,温度迅速升高到120℃。
①仪器c的名称为
②生成水合肼的化学方程式为
Ⅱ.验证
 的还原性
的还原性(4)将“步骤二”制得的水合肼配成1000mL溶液,移出25mL于锥形瓶中,滴加2滴淀粉溶液,用0.05mol/L的
 溶液滴定,当滴定完全时,消耗
溶液滴定,当滴定完全时,消耗 溶液VmL。
溶液VmL。①滴定过程中水合肼被氧化为
 ,反应的化学方程式为
,反应的化学方程式为②配成的水合肼的浓度

③
 的产率为
的产率为
您最近一年使用:0次
2022-10-28更新
|
235次组卷
|
5卷引用:贵州省毕节市金沙县2022-2023学年高三上学期期中教学质量检测化学试题
名校
解题方法
5 . 丙烯腈(CH2=CHCN)是合成纤维、合成橡胶和合成树脂的重要单体,可以由乙炔与HCN反应制得。原理如下CH≡CH+HCN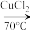 CH2=CHCN
CH2=CHCN
Ⅰ.制备催化剂CuCl2
(1)通过查阅资料有两种方案可以制备
方案1:铜屑与H2O2在浓盐酸中反应
方案2:铜丝在氯气中燃烧
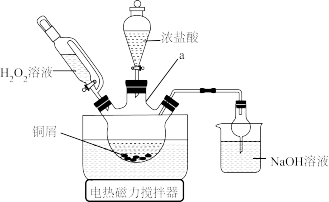
方案1的实验原理如图所示_____
②请写出方案1的反应原理___________ (用离子方程式表达)
(2)用恒压滴液漏斗分批多次滴加H2O2,且H2O2过量,原因是_____
(3)方案2燃烧后的固体溶于水,过滤后发现一些白色固体X,为检测X的成分,某同学将其溶于稀硫酸,白色固体变为红色,且溶液呈蓝色,推测X为_____
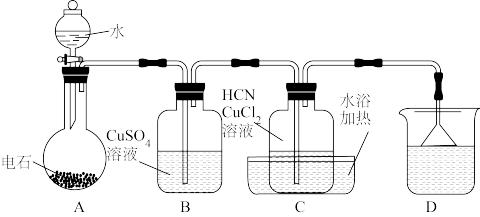
Ⅱ.合成丙烯腈
已知:①电石的主要成分是CaC2,还含有少量硫化钙
②HCN易挥发,有毒,具有较强的还原性_____
(5)纯净的乙炔是无色、无臭的气体。但用电石制取的乙炔时常伴有有臭鸡蛋气味,这种物质是_____
(6)从下列选择装置D中可盛放的溶液
(7)工业用200 kg 含CaC2质量分数80%的电石,生产得到丙烯腈79.5 kg,计算产率_____
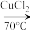 CH2=CHCN
CH2=CHCNⅠ.制备催化剂CuCl2
(1)通过查阅资料有两种方案可以制备
方案1:铜屑与H2O2在浓盐酸中反应
方案2:铜丝在氯气中燃烧
方案1的实验原理如图所示
②请写出方案1的反应原理
(2)用恒压滴液漏斗分批多次滴加H2O2,且H2O2过量,原因是
(3)方案2燃烧后的固体溶于水,过滤后发现一些白色固体X,为检测X的成分,某同学将其溶于稀硫酸,白色固体变为红色,且溶液呈蓝色,推测X为
Ⅱ.合成丙烯腈
已知:①电石的主要成分是CaC2,还含有少量硫化钙
②HCN易挥发,有毒,具有较强的还原性
(5)纯净的乙炔是无色、无臭的气体。但用电石制取的乙炔时常伴有有臭鸡蛋气味,这种物质是
(6)从下列选择装置D中可盛放的溶液
| A.高锰酸钾溶液 | B.NaOH溶液 | C.饱和食盐水 | D.盐酸溶液 |
您最近一年使用:0次
2022-04-13更新
|
2083次组卷
|
8卷引用:贵州省遵义市2022届高三模拟卷(二)理综化学试题
贵州省遵义市2022届高三模拟卷(二)理综化学试题(已下线)【直抵名校】04-备战2022年高考化学名校进阶模拟卷(通用版)(已下线)专题17化学实验综合题-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题16化学实验综合题-2022年高考真题+模拟题汇编(全国卷)(已下线)专题17化学实验综合题-五年(2018~2022)高考真题汇编(全国卷)(已下线)考点51 物质的制备-备战2023年高考化学一轮复习考点帮(全国通用)江苏省南京市金陵中学河西分校2022-2023学年高二上学期期末检测化学试题江西省宜春市上高二中2022-2023学年高二下学期第二次月考(期中) 化学试题
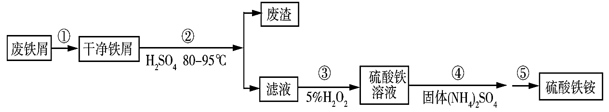
6 . 硫酸铁铵[NH4Fe(SO4)2·xH2O]是一种重要铁盐。为充分利用资源,变废为宝,在实验室中探究采用废铁屑来制备硫酸铁铵,具体流程如下:
(1)步骤①的目的是去除废铁屑表面的油污,方法是_________________ 。
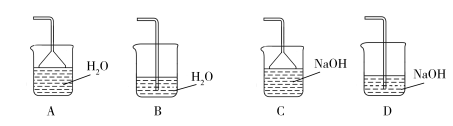
(2)步骤②需要加热的目的是_________________ ,温度保持80~95 ℃,采用的合适加热方式是_________________ 。铁屑中含有少量硫化物,反应产生的气体需要净化处理,合适的装置为_________________ (填标号)。_________________ 。分批加入H2O2,同时为了_________________ ,溶液要保持pH小于0.5。
(4)步骤⑤的具体实验操作有______________ ,经干燥得到硫酸铁铵晶体样品。
(5)采用热重分析法测定硫酸铁铵晶体样品所含结晶水数,将样品加热到150 ℃时,失掉1.5个结晶水,失重5.6%。硫酸铁铵晶体的化学式为______________ 。
(1)步骤①的目的是去除废铁屑表面的油污,方法是
(2)步骤②需要加热的目的是
(4)步骤⑤的具体实验操作有
(5)采用热重分析法测定硫酸铁铵晶体样品所含结晶水数,将样品加热到150 ℃时,失掉1.5个结晶水,失重5.6%。硫酸铁铵晶体的化学式为
您最近一年使用:0次
2019-06-09更新
|
15483次组卷
|
49卷引用:贵州省铜仁市玉屏民族中学2020届高三下学期第六次模拟考试化学试题
贵州省铜仁市玉屏民族中学2020届高三下学期第六次模拟考试化学试题贵州省贵阳市2022-2023学年高三上学期10月质量监测化学试题2019年全国统一考试化学试题(新课标Ⅰ)河北省张家口市第四中学2018-2019学年高二下学期6月月考理科综合化学试题 甘肃省武威市第六中学2020届高三上学期第一次阶段性复习过关考试化学试题广西桂林十八中2020届高三上学期8月第一次月考化学试题(已下线)专题10.3 化学实验方案的设计与评价 (讲)-《2020年高考一轮复习讲练测》(已下线)专题10.3 化学实验方案的设计与评价 (练)-《2020年高考一轮复习讲练测》甘肃省天水市甘谷第一中学2020届高三上学期第四次检测考试化学试题【全国百强校】广西壮族自治区玉林高级中学2020届高三上学期第一次月考(8月)理综化学试题2019届上海奉贤区高考第一次模拟化学试题湖南省株洲市茶陵二中2020届高三上学期第二次月考化学试题2020届上海市奉贤区高考化学一模试卷专题5.2 化学实验的设计与评价(综合提升卷)——巅峰冲刺2020年高考化学二轮专项提升(已下线)专题6.2 实验综合题(必考)(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升(已下线)专题3.3 铁及其重要化合物(讲)——2020年高考化学一轮复习讲练测四川省南充市白塔中学2019-2020学年高二下学期第二次月考化学试题(已下线)专题3.3 铁及其重要化合物(练)——2020年高考化学一轮复习讲练测四川省成都实验中学2021届高三上学期入学考试化学试题(已下线)第11讲 铁及其重要化合物(精讲)——2021年高考化学一轮复习讲练测(已下线)专题讲座(三)“铁三角”综合实验题解题策略(精讲)——2021年高考化学一轮复习讲练测甘肃省天水市第一中学2019-2020学年高二下学期期末考试化学试题天津一中2020届高三第二次月考化学试题甘肃省天水市第一中学2021届高三上学期第一次考试化学试题山西省太原市第五中学2021届高三上学期9月阶段性考试化学试题山东省枣庄市第三中学2021届高三上学期9月阶段性检测化学试题辽宁省锦州市渤海大学附属中学、育明高级中学2021届高三上学期第二次月考化学试题宁夏回族自治区青铜峡市高级中学2021届高三上学期第二次月考化学试题山东省枣庄滕州一中2021届高三10月月考化学试题河南省郑州市第一〇六高级中学2021届高三上学期9月月考化学试题山东省潍坊市诸城一中2021届高三11月份模拟化学试题江西省九江市浔阳区九江市第七中学2021届高三上学期期中考试化学试题广东省深圳、汕头、潮州、揭阳名校2021届高三12月联考化学试题(已下线)专题10 化学实验基础——备战2021年高考化学纠错笔记(已下线)押全国卷理综第26题 实验综合-备战2021年高考化学临考题号押题(课标全国卷)(已下线)考点31 物质的制备 定量分析-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点34 物质的制备与合成-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)第07讲 铁及其化合物(练) — 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)第7讲 铁及其化合物(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)第2周 晚练题-备战2022年高考化学周测与晚练(新高考专用)(已下线)专题10 化学实验综合—2022年高考化学二轮复习讲练测(全国版)-讲义(已下线)押全国卷理综第26题 实验综合-备战2022年高考化学临考题号押题(全国卷)(已下线)回归教材重难点10 实验方案的设计与评价-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)第07讲 铁及其化合物(讲)-2023年高考化学一轮复习讲练测(新教材新高考)宁夏银川市贺兰县景博中学2022-2023学年高三上学期第二次月考化学试题(已下线)题型32 硫酸铁铵、高铁酸盐的制备(已下线)T27-实验题甘肃省平凉市泾川县第三中学2023-2024学年高三上学期第3次月考化学试题2023届广西钦州市灵山县那隆中学高三下学期5月考前冲刺保温卷理综试卷-高中化学



