解题方法
1 .  (三氯化六氨合钴)属于经典配合物,实验室以
(三氯化六氨合钴)属于经典配合物,实验室以 为原料制备
为原料制备 的方法和过程如下:
的方法和过程如下:
Ⅰ.制备 。
。
已知:钴单质与氯气在加热条件下反应可制得纯净 ,钴单质在300℃以上易被氧气氧化;
,钴单质在300℃以上易被氧气氧化; 的熔点为86℃,易潮解。
的熔点为86℃,易潮解。
制备装置如图:
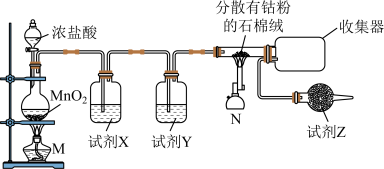
(1)试剂X是___________ ;试剂Z的作用为___________ 。
(2)上述装置制取氯气的化学方程式为___________ 。
Ⅱ.制备 ——配合、氧化。
——配合、氧化。
步骤ⅰ:在锥形瓶中,将4g 固体溶于8.4mL水中,再加入6g研细的
固体溶于8.4mL水中,再加入6g研细的 晶体,溶解得到混合溶液。
晶体,溶解得到混合溶液。
步骤ⅱ:将上述混合溶液转移至三颈烧瓶中,加入研细的活性炭和浓氨水,再逐滴加入 溶液,水浴加热至50~60℃,保持20min。然后用冰水浴冷却至0℃左右,抽滤,得粗产品。
溶液,水浴加热至50~60℃,保持20min。然后用冰水浴冷却至0℃左右,抽滤,得粗产品。
(3)滴加 时若速度过快,产物中会含有
时若速度过快,产物中会含有 杂质,原因为
杂质,原因为___________ 。
(4)水浴加热温度控制在50~60℃,温度不宜过高的原因是___________ 。
Ⅲ.测定 产品纯度。
产品纯度。
(5)用如图装置测定产品中 的含量(部分装置已省略):
的含量(部分装置已省略):

①蒸氨:取 样品(杂质不参与反应)加入过量试剂后,加热三颈烧瓶,蒸出的
样品(杂质不参与反应)加入过量试剂后,加热三颈烧瓶,蒸出的 通入盛有
通入盛有
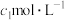
 标准溶液的锥形瓶中。液封装置2的作用是
标准溶液的锥形瓶中。液封装置2的作用是___________ 。
②滴定:将液封装置2中的水倒入锥形瓶后,使用甲基橙作指示剂,用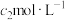
 溶液滴定剩余的
溶液滴定剩余的 ,到达滴定终点时消耗
,到达滴定终点时消耗
 溶液。滴定终点的现象为
溶液。滴定终点的现象为___________ 。
 (三氯化六氨合钴)属于经典配合物,实验室以
(三氯化六氨合钴)属于经典配合物,实验室以 为原料制备
为原料制备 的方法和过程如下:
的方法和过程如下:Ⅰ.制备
 。
。已知:钴单质与氯气在加热条件下反应可制得纯净
 ,钴单质在300℃以上易被氧气氧化;
,钴单质在300℃以上易被氧气氧化; 的熔点为86℃,易潮解。
的熔点为86℃,易潮解。制备装置如图:

(1)试剂X是
(2)上述装置制取氯气的化学方程式为
Ⅱ.制备
 ——配合、氧化。
——配合、氧化。步骤ⅰ:在锥形瓶中,将4g
 固体溶于8.4mL水中,再加入6g研细的
固体溶于8.4mL水中,再加入6g研细的 晶体,溶解得到混合溶液。
晶体,溶解得到混合溶液。步骤ⅱ:将上述混合溶液转移至三颈烧瓶中,加入研细的活性炭和浓氨水,再逐滴加入
 溶液,水浴加热至50~60℃,保持20min。然后用冰水浴冷却至0℃左右,抽滤,得粗产品。
溶液,水浴加热至50~60℃,保持20min。然后用冰水浴冷却至0℃左右,抽滤,得粗产品。(3)滴加
 时若速度过快,产物中会含有
时若速度过快,产物中会含有 杂质,原因为
杂质,原因为(4)水浴加热温度控制在50~60℃,温度不宜过高的原因是
Ⅲ.测定
 产品纯度。
产品纯度。(5)用如图装置测定产品中
 的含量(部分装置已省略):
的含量(部分装置已省略):
①蒸氨:取
 样品(杂质不参与反应)加入过量试剂后,加热三颈烧瓶,蒸出的
样品(杂质不参与反应)加入过量试剂后,加热三颈烧瓶,蒸出的 通入盛有
通入盛有
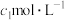
 标准溶液的锥形瓶中。液封装置2的作用是
标准溶液的锥形瓶中。液封装置2的作用是②滴定:将液封装置2中的水倒入锥形瓶后,使用甲基橙作指示剂,用
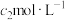
 溶液滴定剩余的
溶液滴定剩余的 ,到达滴定终点时消耗
,到达滴定终点时消耗
 溶液。滴定终点的现象为
溶液。滴定终点的现象为
您最近一年使用:0次
解题方法
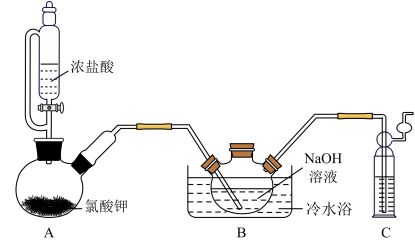
2 . 二氯异氰尿酸钠[(CNO)3Cl2Na]是常用的杀菌消毒剂,常温下为白色固体,难溶于冷水。某同学利用高浓度的NaClO溶液和(CNO)3H3固体,在10℃时反应制备二氯异氰尿酸钠,实验装置如图所示(部分夹持装置略)。
已知:2NaClO+(CNO)3H3=(CNO)3Cl2Na+NaOH+H2O,
回答下列问题:
(1)装置A中制备Cl2的化学方程式为_______ 。
(2)待装置B_______ (填实验现象)时,再由三颈烧瓶上口加入(CNO)3H3固体;反应过程中仍需不断通入Cl2的理由是_______ 。
(3)通过下列实验测定二氯异氰尿酸钠样品中有效氯的含量。
反应原理:
[(CNO)3Cl2]-+H++2H2O=(CNO)3H3+2HClO
HClO+2I-+H+=I2+Cl-+H2O
I2+2S2O =S4O
=S4O +2I-
+2I-
实验步骤:准确称取mg样品,用容量瓶配成250mL溶液;取25.00mL上述溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,充分反应后,用cmol/LNa2S2O3标准溶液滴定至溶液呈微黄色。加入淀粉指示剂继续滴定至终点,消耗Na2S2O3溶液平均为VmL。
①滴定终点现象为_______ 。
②该样品的有效氯含量表达式为_______ 。 (该样品的有效氯=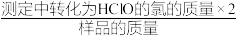 ×100%)
×100%)

已知:2NaClO+(CNO)3H3=(CNO)3Cl2Na+NaOH+H2O,
回答下列问题:
(1)装置A中制备Cl2的化学方程式为
(2)待装置B
(3)通过下列实验测定二氯异氰尿酸钠样品中有效氯的含量。
反应原理:
[(CNO)3Cl2]-+H++2H2O=(CNO)3H3+2HClO
HClO+2I-+H+=I2+Cl-+H2O
I2+2S2O
 =S4O
=S4O +2I-
+2I-实验步骤:准确称取mg样品,用容量瓶配成250mL溶液;取25.00mL上述溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,充分反应后,用cmol/LNa2S2O3标准溶液滴定至溶液呈微黄色。加入淀粉指示剂继续滴定至终点,消耗Na2S2O3溶液平均为VmL。
①滴定终点现象为
②该样品的有效氯含量表达式为
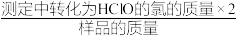 ×100%)
×100%)
您最近一年使用:0次
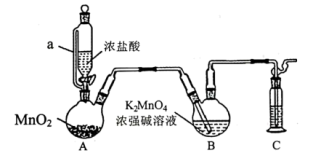
3 .  溶液常用作氧化还原反应滴定的标准液,利用
溶液常用作氧化还原反应滴定的标准液,利用 氧化
氧化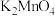 制备
制备 的装置如图所示(加热、夹持装置略):
的装置如图所示(加热、夹持装置略):
已知: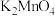 在浓强碱溶液中可稳定存在,碱性减弱时易发生反应:
在浓强碱溶液中可稳定存在,碱性减弱时易发生反应: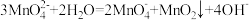
回答下列问题:
(1)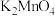 的化学名称为
的化学名称为_______ 。
(2)装置A中所发生反应的化学方程式为_______ ;其中a的作用是_______ 。
(3)装置C中盛装的试剂是_______ 。
(4)分析发现该装置有不足之处,改进的方法是_______ 。
(5)为测定某 固体的纯度,现用
固体的纯度,现用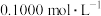 的酸性
的酸性 溶液进行滴定。(已知:
溶液进行滴定。(已知: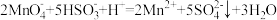 )
)
①确称取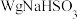 固体溶于水配成
固体溶于水配成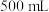 溶液,下列仪器中肯定需要的是
溶液,下列仪器中肯定需要的是_______ (填仪器名称)。
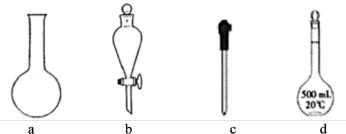
②取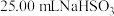 溶液置于锥形瓶中,用
溶液置于锥形瓶中,用 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液
溶液 。滴定终点的现象为
。滴定终点的现象为_______ , 固体的纯度为
固体的纯度为_______ 。
 溶液常用作氧化还原反应滴定的标准液,利用
溶液常用作氧化还原反应滴定的标准液,利用 氧化
氧化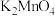 制备
制备 的装置如图所示(加热、夹持装置略):
的装置如图所示(加热、夹持装置略):
已知:
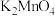 在浓强碱溶液中可稳定存在,碱性减弱时易发生反应:
在浓强碱溶液中可稳定存在,碱性减弱时易发生反应: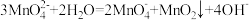
回答下列问题:
(1)
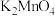 的化学名称为
的化学名称为(2)装置A中所发生反应的化学方程式为
(3)装置C中盛装的试剂是
(4)分析发现该装置有不足之处,改进的方法是
(5)为测定某
 固体的纯度,现用
固体的纯度,现用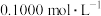 的酸性
的酸性 溶液进行滴定。(已知:
溶液进行滴定。(已知: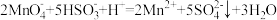 )
)①确称取
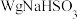 固体溶于水配成
固体溶于水配成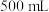 溶液,下列仪器中肯定需要的是
溶液,下列仪器中肯定需要的是
②取
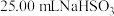 溶液置于锥形瓶中,用
溶液置于锥形瓶中,用 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液
溶液 。滴定终点的现象为
。滴定终点的现象为 固体的纯度为
固体的纯度为
您最近一年使用:0次
2021-08-22更新
|
318次组卷
|
4卷引用:贵州省贵阳清镇北大培文学校2022-2023学年高二下学期3月月考(4班)化学试题
名校
解题方法
4 . 菠菜富含膳食纤维、胡萝卜素、维生素c、维生素e、钙、磷、铁、等矿物质。14~18岁青少年每日合理摄入铁量为20~25mg,某化学小组针对菠菜中含铁量进行如下实验。
(一)实验目的:菠菜含铁量是否满足青少年日常所需
(二)实验方案:取适量新鲜菠菜平均分成三份,实验操作和现象记录如下:
(1)灼烧菠菜时,除了酒精灯还需要下列仪器中的_______ (填选项)。
A. B.
B. C.
C. D.
D. E.
E.
(2)写出实验三中 参与的最主要反应的离子方程式
参与的最主要反应的离子方程式_______ 。
(3)检验试剂KSCN溶液中的 采用
采用_______ 的方法。
(4)由三组实验做出如下推断,其中合理的是:_______(填选项)。
(三)实验数据:菠菜中含铁量的测定,实验步骤如下:
①取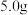 新鲜菠菜,充分灼烧,将灰分转移至干燥器中冷却。
新鲜菠菜,充分灼烧,将灰分转移至干燥器中冷却。
②向灰分中加入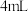 盐酸和
盐酸和 ,浸泡
,浸泡 ,过滤并用少量盐酸洗涤烧杯和沉淀,滤液和洗涤液合并;
,过滤并用少量盐酸洗涤烧杯和沉淀,滤液和洗涤液合并;
③将合并液定容成 待测液,利用分光光度法测得铁的浓度为
待测液,利用分光光度法测得铁的浓度为 。
。
根据上述实验,回答下列问题:
(5)步骤②洗涤烧杯和沉淀的目的是_______ 。
(6)步骤③定容操作若仰视容量瓶刻度线,会造成菠菜样品含铁量测定结果_______ 。(填“偏高”、“偏低”或“无影响”)。
(7)根据实验数据计算菠菜含铁量为_______ 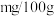 。
。
(四)实验结论:由于菠菜中含有大量草酸( )与铁元素形成沉淀影响铁元素吸收,所以不是理想的补铁剂。(附:猪肝每
)与铁元素形成沉淀影响铁元素吸收,所以不是理想的补铁剂。(附:猪肝每 中含铁量达到
中含铁量达到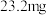 ,且容易被人体吸收。)
,且容易被人体吸收。)
(一)实验目的:菠菜含铁量是否满足青少年日常所需
(二)实验方案:取适量新鲜菠菜平均分成三份,实验操作和现象记录如下:
| 实验 | 操作步骤 | 检验试剂 | 现象 |
| 实验一 | 适量蒸馏水浸泡,过滤,取滤液,加检验试剂后加入适量 ,再次加入检验试剂 ,再次加入检验试剂 | KSCN溶液 | 均无明显现象 |
| 实验二 | 充分灼烧,加适量盐酸浸泡,取滤液,加检验试剂 | KSCN溶液 | 极浅的红色 |
| 实验三 | 充分灼烧,加适量盐酸、 浸泡,取滤液,加检验试剂 浸泡,取滤液,加检验试剂 | KSCN溶液 | 较深的红色 |
A.
 B.
B. C.
C. D.
D. E.
E.
(2)写出实验三中
 参与的最主要反应的离子方程式
参与的最主要反应的离子方程式(3)检验试剂KSCN溶液中的
 采用
采用(4)由三组实验做出如下推断,其中合理的是:_______(填选项)。
| A.菠菜样品中含铁量极低 | B.菠菜中的铁元素很难用蒸馏水直接溶出 |
| C.仅用盐酸无法溶出菠菜灰分中的铁元素 | D.灼烧的目的是将菠菜中的铁元素氧化 |
(三)实验数据:菠菜中含铁量的测定,实验步骤如下:
①取
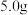 新鲜菠菜,充分灼烧,将灰分转移至干燥器中冷却。
新鲜菠菜,充分灼烧,将灰分转移至干燥器中冷却。②向灰分中加入
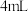 盐酸和
盐酸和 ,浸泡
,浸泡 ,过滤并用少量盐酸洗涤烧杯和沉淀,滤液和洗涤液合并;
,过滤并用少量盐酸洗涤烧杯和沉淀,滤液和洗涤液合并;③将合并液定容成
 待测液,利用分光光度法测得铁的浓度为
待测液,利用分光光度法测得铁的浓度为 。
。根据上述实验,回答下列问题:
(5)步骤②洗涤烧杯和沉淀的目的是
(6)步骤③定容操作若仰视容量瓶刻度线,会造成菠菜样品含铁量测定结果
(7)根据实验数据计算菠菜含铁量为
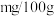 。
。(四)实验结论:由于菠菜中含有大量草酸(
 )与铁元素形成沉淀影响铁元素吸收,所以不是理想的补铁剂。(附:猪肝每
)与铁元素形成沉淀影响铁元素吸收,所以不是理想的补铁剂。(附:猪肝每 中含铁量达到
中含铁量达到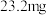 ,且容易被人体吸收。)
,且容易被人体吸收。)
您最近一年使用:0次
2023-03-02更新
|
605次组卷
|
4卷引用:贵州省遵义市南白中学2022-2023学年高一下学期第一次联考化学试题
名校
解题方法
5 . 碘化钾( )是实验室常用的化学试剂,用途广泛。一种利用含碘废液(碘的主要存在形式为
)是实验室常用的化学试剂,用途广泛。一种利用含碘废液(碘的主要存在形式为 和
和 )制备碘化钾的实验步骤如下:
)制备碘化钾的实验步骤如下:
步骤Ⅰ:取含碘废液,调节溶液 为
为 ,加入一定量
,加入一定量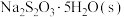 ,溶解,加热至30℃,加入稍过量
,溶解,加热至30℃,加入稍过量 粉末,搅拌,充分反应后,过滤得
粉末,搅拌,充分反应后,过滤得 沉淀;
沉淀;
步骤Ⅱ:在 圆底烧瓶中加入上述制备的
圆底烧瓶中加入上述制备的 沉淀,铁粉(过量),
沉淀,铁粉(过量),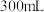 蒸馏水,搅拌,沸水浴加热1小时,冷却,抽滤。将滤液倒入
蒸馏水,搅拌,沸水浴加热1小时,冷却,抽滤。将滤液倒入 烧杯中,加入约
烧杯中,加入约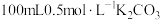 溶液,搅拌,煮沸,静置,过滤,得滤液A;
溶液,搅拌,煮沸,静置,过滤,得滤液A;
步骤Ⅲ:用氢碘酸调滤液A的 ,将滤液倒入___________(填仪器名称)中加热至___________(填现象),冷却,干燥,得到
,将滤液倒入___________(填仪器名称)中加热至___________(填现象),冷却,干燥,得到 晶体。
晶体。
回答下列问题:
(1)步骤Ⅰ中的控温方法为___________ , 与
与 转化为
转化为 的反应为①
的反应为① ,②
,② ,则反应②中氧化剂与还原剂的物质的量之比为
,则反应②中氧化剂与还原剂的物质的量之比为___________ 。
(2)步骤Ⅱ中铁粉转化为 ,该反应的化学方程式为
,该反应的化学方程式为___________ 。
(3)步骤Ⅲ中,仪器的名称是___________ ,现象是___________ 。
(4)产品中KI含量的测定
称取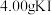 4.00样品,配成
4.00样品,配成 溶液,取
溶液,取 溶液于锥形瓶中,加入
溶液于锥形瓶中,加入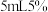 乙酸溶液及3滴曙红钠盐作指示剂,用
乙酸溶液及3滴曙红钠盐作指示剂,用 的
的 标准溶液避光滴定至沉淀呈红色(终点),平行滴定三次,消耗
标准溶液避光滴定至沉淀呈红色(终点),平行滴定三次,消耗 标准溶液分别为
标准溶液分别为 、
、 、
、 。
。
①用 标准溶液滴定时要避光的原因是
标准溶液滴定时要避光的原因是___________ ,在滴定时 溶液应盛放在
溶液应盛放在___________ (“酸式”或“碱式”)滴定管。
②样品中 的质量分数为
的质量分数为___________ 。
 )是实验室常用的化学试剂,用途广泛。一种利用含碘废液(碘的主要存在形式为
)是实验室常用的化学试剂,用途广泛。一种利用含碘废液(碘的主要存在形式为 和
和 )制备碘化钾的实验步骤如下:
)制备碘化钾的实验步骤如下:步骤Ⅰ:取含碘废液,调节溶液
 为
为 ,加入一定量
,加入一定量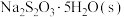 ,溶解,加热至30℃,加入稍过量
,溶解,加热至30℃,加入稍过量 粉末,搅拌,充分反应后,过滤得
粉末,搅拌,充分反应后,过滤得 沉淀;
沉淀;步骤Ⅱ:在
 圆底烧瓶中加入上述制备的
圆底烧瓶中加入上述制备的 沉淀,铁粉(过量),
沉淀,铁粉(过量),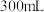 蒸馏水,搅拌,沸水浴加热1小时,冷却,抽滤。将滤液倒入
蒸馏水,搅拌,沸水浴加热1小时,冷却,抽滤。将滤液倒入 烧杯中,加入约
烧杯中,加入约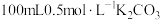 溶液,搅拌,煮沸,静置,过滤,得滤液A;
溶液,搅拌,煮沸,静置,过滤,得滤液A;步骤Ⅲ:用氢碘酸调滤液A的
 ,将滤液倒入___________(填仪器名称)中加热至___________(填现象),冷却,干燥,得到
,将滤液倒入___________(填仪器名称)中加热至___________(填现象),冷却,干燥,得到 晶体。
晶体。回答下列问题:
(1)步骤Ⅰ中的控温方法为
 与
与 转化为
转化为 的反应为①
的反应为① ,②
,② ,则反应②中氧化剂与还原剂的物质的量之比为
,则反应②中氧化剂与还原剂的物质的量之比为(2)步骤Ⅱ中铁粉转化为
 ,该反应的化学方程式为
,该反应的化学方程式为(3)步骤Ⅲ中,仪器的名称是
(4)产品中KI含量的测定
称取
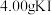 4.00样品,配成
4.00样品,配成 溶液,取
溶液,取 溶液于锥形瓶中,加入
溶液于锥形瓶中,加入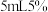 乙酸溶液及3滴曙红钠盐作指示剂,用
乙酸溶液及3滴曙红钠盐作指示剂,用 的
的 标准溶液避光滴定至沉淀呈红色(终点),平行滴定三次,消耗
标准溶液避光滴定至沉淀呈红色(终点),平行滴定三次,消耗 标准溶液分别为
标准溶液分别为 、
、 、
、 。
。①用
 标准溶液滴定时要避光的原因是
标准溶液滴定时要避光的原因是 溶液应盛放在
溶液应盛放在②样品中
 的质量分数为
的质量分数为
您最近一年使用:0次
2024-01-02更新
|
210次组卷
|
2卷引用:贵州省贵阳市2023-2024学年高三上学期11月质量检测化学试题
6 . 铁酸锌(ZnFe2O4)是一种重要的磁性材料与催化剂,实验室可以通过前驱固相法制备铁酸锌,具体步骤如下:
Ⅰ.7.840 g (NH4)2Fe(SO4)2·6H2O(M=392 g·mol-1)与2.870 g ZnSO4·7H2O(M=287 g·mol-1)溶于100 mL水中,加热至75℃。
Ⅱ.加热足量0.002 mol/L(NH4)2C2O4溶液到75℃与Ⅰ中溶液混合。
Ⅲ.将混合液在90-100℃加热搅拌5 min,生成固体前驱物[ZnFe2(C2O4)3·6H2O]。
Ⅳ.待混合溶液冷却进行过滤,用冷的蒸馏水洗涤。
Ⅴ.将过滤得到的固体前驱物干燥2 h,然后在700℃灼烧2 h,得到产品1.928 g。
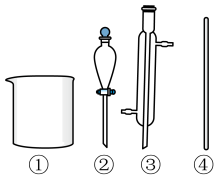
(1)下列仪器在步骤Ⅰ中需使用的是___________ (填标号),无需使用的是___________ (填名称)。
(2)步骤Ⅱ中采用的加热方式是___________ 加热。
(3)步骤Ⅲ中发生的离子反应方程式为___________ 。
(4)步骤Ⅳ中检验固体前驱物洗涤干净的操作和现象为___________ 。
(5)步骤Ⅴ中固体前驱物在高温条件下发生分解,生成三种无色气体,该反应的化学方程式为___________ 。
(6)本实验的产率为___________ 。
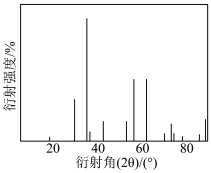
(7)将所得产品用X射线衍射法检测后,得到X射线衍射图谱如图所示,则ZnFe2O4属于___________ (填“晶体”或“非晶体”)。
Ⅰ.7.840 g (NH4)2Fe(SO4)2·6H2O(M=392 g·mol-1)与2.870 g ZnSO4·7H2O(M=287 g·mol-1)溶于100 mL水中,加热至75℃。
Ⅱ.加热足量0.002 mol/L(NH4)2C2O4溶液到75℃与Ⅰ中溶液混合。
Ⅲ.将混合液在90-100℃加热搅拌5 min,生成固体前驱物[ZnFe2(C2O4)3·6H2O]。
Ⅳ.待混合溶液冷却进行过滤,用冷的蒸馏水洗涤。
Ⅴ.将过滤得到的固体前驱物干燥2 h,然后在700℃灼烧2 h,得到产品1.928 g。
(1)下列仪器在步骤Ⅰ中需使用的是

(2)步骤Ⅱ中采用的加热方式是
(3)步骤Ⅲ中发生的离子反应方程式为
(4)步骤Ⅳ中检验固体前驱物洗涤干净的操作和现象为
(5)步骤Ⅴ中固体前驱物在高温条件下发生分解,生成三种无色气体,该反应的化学方程式为
(6)本实验的产率为
(7)将所得产品用X射线衍射法检测后,得到X射线衍射图谱如图所示,则ZnFe2O4属于

您最近一年使用:0次
解题方法
7 . 富马酸亚铁(结构简式为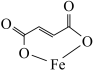 ,M=170)常用于治疗缺铁性贫血,也可作食品营养强化剂。某化学兴趣小组用富马酸(HOOCCH=CHCOOH)和FeSO4制备富马酸亚铁,并对其纯度进行测定,过程如下:
,M=170)常用于治疗缺铁性贫血,也可作食品营养强化剂。某化学兴趣小组用富马酸(HOOCCH=CHCOOH)和FeSO4制备富马酸亚铁,并对其纯度进行测定,过程如下:
步骤I:富马酸亚铁晶体的制备
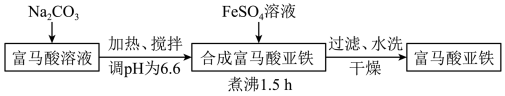
(1)合成富马酸亚铁时使用如图所示装置(加热和夹持装置略去)。仪器A的名称是_______ ,球形冷凝管的作用为_______ 。

(2)调pH时最好选用的酸为_______ 。
a.盐酸 b.硫酸 c.硝酸
(3)合成富马酸亚铁的化学方程式为_______ 。
(4)煮沸过程中会持续通入氮气,其目的是_______ 。
(5)水洗环节中,判断富马酸亚铁产品已洗净的实验方法是_______ 。
步骤Ⅱ:产品纯度的测定
取0.4000g样品置于250mL锥形瓶中,加入15.00mL硫酸,加热溶解后冷却,再加入50.00mL新煮沸过的冷水和2滴邻二氮菲指示液,此时溶液星红色;立即用0.1000mol/L的硫酸铈铵(NH4)2Ce(SO4)3标准液滴定(还原产物为Ce3+),滴定终点溶液变为浅蓝色。平行测定三次,平均消耗22.00mL标准液。
(6)滴定过程的硫酸铈铵[(NH4)2Ce(SO4)3]标准液应装入_______ (填“酸式”或“碱式”)滴定管。根据上述实验数据,测得产品的纯度是_______ %。
 ,M=170)常用于治疗缺铁性贫血,也可作食品营养强化剂。某化学兴趣小组用富马酸(HOOCCH=CHCOOH)和FeSO4制备富马酸亚铁,并对其纯度进行测定,过程如下:
,M=170)常用于治疗缺铁性贫血,也可作食品营养强化剂。某化学兴趣小组用富马酸(HOOCCH=CHCOOH)和FeSO4制备富马酸亚铁,并对其纯度进行测定,过程如下:步骤I:富马酸亚铁晶体的制备

(1)合成富马酸亚铁时使用如图所示装置(加热和夹持装置略去)。仪器A的名称是

(2)调pH时最好选用的酸为
a.盐酸 b.硫酸 c.硝酸
(3)合成富马酸亚铁的化学方程式为
(4)煮沸过程中会持续通入氮气,其目的是
(5)水洗环节中,判断富马酸亚铁产品已洗净的实验方法是
步骤Ⅱ:产品纯度的测定
取0.4000g样品置于250mL锥形瓶中,加入15.00mL硫酸,加热溶解后冷却,再加入50.00mL新煮沸过的冷水和2滴邻二氮菲指示液,此时溶液星红色;立即用0.1000mol/L的硫酸铈铵(NH4)2Ce(SO4)3标准液滴定(还原产物为Ce3+),滴定终点溶液变为浅蓝色。平行测定三次,平均消耗22.00mL标准液。
(6)滴定过程的硫酸铈铵[(NH4)2Ce(SO4)3]标准液应装入
您最近一年使用:0次
2024-03-08更新
|
76次组卷
|
2卷引用:贵州省贵阳市白云区第二高级中学2023-2024学年高三上学期质量监测化学试卷
8 . 磷酸亚铁锂(LiFePO4)是生产锂电池的重要材料。实验室中用如图装置制备LiFePO4:在仪器A中加入40mL蒸馏水、少量抗坏血酸,再加入0.01molH3PO4和0.01molFeSO4•7H2O,用搅拌器搅拌溶解后,缓慢加入0.03molLiOH•H2O,继续搅拌5min。快速将反应液装入反应釜中,保持170℃恒温5h。
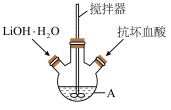
(1)仪器A的名称是___________ ;实验所用蒸馏水若未经煮沸直接使用,则可能发生反应的离子方程式为 ___________ 。
(2)实验中可用Na2SO3代替抗坏血酸,其原理是___________ (用离子方程式表示);不能用铁粉代替抗坏血酸的原因是 ___________ 。
(3)反应釜中反应充分后,要得到LiFePO4固体产品的实验操作是___________ 、 ___________ 、过滤、洗涤、干燥。
(4)检验产品中是否混有Fe(OH)3或FePO4杂质的方法是___________ 。
(5)若实验得到无杂质产品1.28g,则LiFePO4的产率约为 ___________。

(1)仪器A的名称是
(2)实验中可用Na2SO3代替抗坏血酸,其原理是
(3)反应釜中反应充分后,要得到LiFePO4固体产品的实验操作是
(4)检验产品中是否混有Fe(OH)3或FePO4杂质的方法是
(5)若实验得到无杂质产品1.28g,则LiFePO4的产率约为 ___________。
| A.85% | B.80% | C.75% | D.70% |
您最近一年使用:0次
名校
解题方法
9 . 碳酸锰(MnCO3)是制造电信器材软磁铁氧体、合成MnO2和制造其他锰盐的原料。实验室以KMnO4为原料制备少量MnCO3并研究其性质,制备MnCO3的装置如图所示。

已知:MnCO3溶于稀酸、难溶于乙醇,100℃开始分解。请回答下列问题:
(1)仪器A的名称为___________ 。
(2)在烧瓶中加入一定的KMnO4粉末,滴加硫酸酸化的H2C2O4溶液,该反应中若有1mol氧化剂被还原,则生成的氧化产物的物质的量为___________ ;反应过程中c(Mn2+)随时间的变化曲线如图所示,则tmin时,c(Mn2+)迅速增大的原因是___________ 。

(3)反应一段时间后,当装置A中的溶液由紫色变为无色,再滴加NH4HCO3溶液充分反应生成MnCO3.生成MnCO3的离子方程式为___________ 。
(4)实验结束后,将装置A中的混合物过滤,用___________ 洗涤滤渣,再___________ (填“低温”或“高温”)烘干,即得到干燥的MnCO3固体。
(5)在空气中加热MnCO3固体,随着温度的升高,残留固体的质盘变化如图所示。则A→B反应的化学方程式为___________ ,C点的成分为___________ (填化学式)。


已知:MnCO3溶于稀酸、难溶于乙醇,100℃开始分解。请回答下列问题:
(1)仪器A的名称为
(2)在烧瓶中加入一定的KMnO4粉末,滴加硫酸酸化的H2C2O4溶液,该反应中若有1mol氧化剂被还原,则生成的氧化产物的物质的量为

(3)反应一段时间后,当装置A中的溶液由紫色变为无色,再滴加NH4HCO3溶液充分反应生成MnCO3.生成MnCO3的离子方程式为
(4)实验结束后,将装置A中的混合物过滤,用
(5)在空气中加热MnCO3固体,随着温度的升高,残留固体的质盘变化如图所示。则A→B反应的化学方程式为

您最近一年使用:0次
解题方法
10 . 废旧磷酸铁锂电池的回收利用具有重要研究价值。利用废旧电池正极极片料(主要成分为LiFePO4,还含有少量的Al、石墨等)回收金属化合物,并通过电解Na2SO4溶液生产所需的H2SO4溶液和NaOH溶液,从而实现物质的循环利用。工艺流程如下,回答下列问题:
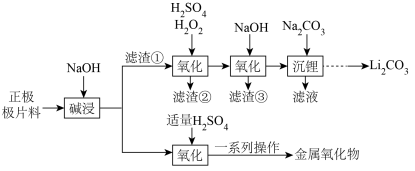
(1)加快“碱浸”速率的方法___________ (任写1条)。
(2)“氧化”过程H2O2的用量比理论用量稍高的原因是___________ 。
(3)滤渣③的主要成分是___________ 。
(4)“沉淀”中发生反应的离子方程式为___________ ,“沉淀”过程后的“一系列操作”具体为___________ 。
(5)“沉锂”所得“滤液”经纯化后得Na2SO4溶液,利用下列装置电解Na2SO4溶液制备H2SO4溶液和NaOH溶液,从而实现物质循环利用。

①离子交换膜b应为___________ (填“阳离子”或“阴离子”)交换膜;
②一定条件下,c(Na2SO4)、电解时间对电解所得溶液的c(H+)、c(OH-)及电流效率(η(NaOH)、η(H2SO4))的影响如图,则最佳电解条件中c(Na2SO4)为___________ mol·L-1左右、电解时间为___________ h左右。

(6)生产中通常需要测定正极极片料的总铁量。取mg样品,用盐酸充分溶解、过滤、洗涤,将滤液和洗涤液合并后配成250mL溶液。取25.00mL与适量TiCl3溶液反应,将Fe3+恰好完全还原为Fe2+。加入混酸介质,滴入指示剂,用0.01mol·L-1K2Cr2O7标准溶液滴定,三次滴定平均消耗VmLK2Cr2O7标准溶液。
①用K2Cr2O7标准溶液滴定过程中反应的离子方程式为___________ 。
②样品中铁的质量分数为___________ 。

(1)加快“碱浸”速率的方法
(2)“氧化”过程H2O2的用量比理论用量稍高的原因是
(3)滤渣③的主要成分是
(4)“沉淀”中发生反应的离子方程式为
(5)“沉锂”所得“滤液”经纯化后得Na2SO4溶液,利用下列装置电解Na2SO4溶液制备H2SO4溶液和NaOH溶液,从而实现物质循环利用。

①离子交换膜b应为
②一定条件下,c(Na2SO4)、电解时间对电解所得溶液的c(H+)、c(OH-)及电流效率(η(NaOH)、η(H2SO4))的影响如图,则最佳电解条件中c(Na2SO4)为

(6)生产中通常需要测定正极极片料的总铁量。取mg样品,用盐酸充分溶解、过滤、洗涤,将滤液和洗涤液合并后配成250mL溶液。取25.00mL与适量TiCl3溶液反应,将Fe3+恰好完全还原为Fe2+。加入混酸介质,滴入指示剂,用0.01mol·L-1K2Cr2O7标准溶液滴定,三次滴定平均消耗VmLK2Cr2O7标准溶液。
①用K2Cr2O7标准溶液滴定过程中反应的离子方程式为
②样品中铁的质量分数为
您最近一年使用:0次



