1 . 如图是铜与浓硫酸反应并验证其产物性质的装置图。请回答下列问题。
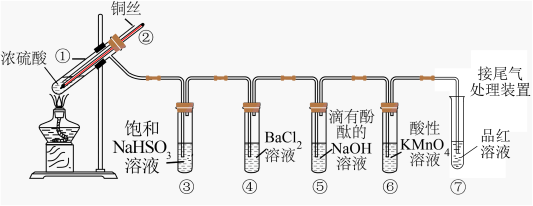
(1)试管①中发生反应的化学方程式为____ ;其中硫酸发生了____ (填“氧化”或“还原”)反应。
(2)一段时间后,④中溶液无明显现象,⑤⑥⑦溶液均褪色,试管⑤⑥⑦中的现象分别说明SO2的水溶液具有____ 、SO2具有____ 、漂白性。
(3)下列说法正确的是____ (填字母)。
a.上下移动铜丝可控制反应的发生与停止
b.反应结束后,从导管向装置中鼓入空气,使气体完全被吸收,防止污染
c.实验结束后,试管①中有白色固体出现,为确认白色固体为产物CuSO4,可立刻向试管①中加水,观察颜色
(4)充分反应后发现,铜丝与硫酸都有剩余,在此情况下,加入下列物质能使溶液中n(Cu2+)变大的是____ (填字母)。
a.HClb.Fe2O3c.KNO3
(5)反应停止后,待装置冷却,向试管④中加入氯水,产生白色沉淀,反应的离子方程式为____ 。
(6)为了测定尾气中SO2的含量,将尾气样品经过管道通入盛有400mL0.1mol·L-1酸性KMnO4溶液的密闭容器中。若管道中气体流量为aL·min-1,经过8min溶液恰好褪色,假定样品中SO2被充分吸收,该尾气样品中SO2的含量为____ g·L-1。(假设尾气中其他气体不与酸性KMnO4溶液反应)

(1)试管①中发生反应的化学方程式为
(2)一段时间后,④中溶液无明显现象,⑤⑥⑦溶液均褪色,试管⑤⑥⑦中的现象分别说明SO2的水溶液具有
(3)下列说法正确的是
a.上下移动铜丝可控制反应的发生与停止
b.反应结束后,从导管向装置中鼓入空气,使气体完全被吸收,防止污染
c.实验结束后,试管①中有白色固体出现,为确认白色固体为产物CuSO4,可立刻向试管①中加水,观察颜色
(4)充分反应后发现,铜丝与硫酸都有剩余,在此情况下,加入下列物质能使溶液中n(Cu2+)变大的是
a.HClb.Fe2O3c.KNO3
(5)反应停止后,待装置冷却,向试管④中加入氯水,产生白色沉淀,反应的离子方程式为
(6)为了测定尾气中SO2的含量,将尾气样品经过管道通入盛有400mL0.1mol·L-1酸性KMnO4溶液的密闭容器中。若管道中气体流量为aL·min-1,经过8min溶液恰好褪色,假定样品中SO2被充分吸收,该尾气样品中SO2的含量为
您最近一年使用:0次
2022-08-24更新
|
77次组卷
|
2卷引用:贵州省黔东南六校联盟2022-2023学年高二上学期期中联考化学试题
名校
2 . 我国近代化学工业英基人侯德榜先生设计出“侯氏制碱法”,提高了食盐的转化率,缩短了生产流程,减少了对环境的污染。钢仁一中化学实验社团模拟“侯氏制碱法”开展如下项目式学习:
项目一:粗盐的提纯
粗盐中除了含有泥沙之外,还含有少量 等杂质离子,粗盐提纯的流程如图所示:
等杂质离子,粗盐提纯的流程如图所示: 分别为足量的
分别为足量的_____________ 、_____________ 。
(2)操作2的名称是_____________________ 。
(3)“滤液”中加入足量的试剂 生成气泡的离子方程式为
生成气泡的离子方程式为_____________________________ 。
项目二:模拟“侯氏制碱法“利用上述实验制得的 全部用于制备纯碱,工艺流程如图所示:
全部用于制备纯碱,工艺流程如图所示:

(4)氮化和碳酸化过程在如图所示装置中进行, 导管应通入的气体是
导管应通入的气体是_____________ (填化学式),仪器 的作用是
的作用是_____________________________________________ 。
(5)写出煅烧固体时发生的化学方程式:_________________________________________________ 。
(6)称取了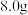 粗盐进行实验,最终制得
粗盐进行实验,最终制得 纯碱,假设完全转化,则粗盐的纯度是
纯碱,假设完全转化,则粗盐的纯度是_________  。(保留2位有效数字)
。(保留2位有效数字)
项目一:粗盐的提纯
粗盐中除了含有泥沙之外,还含有少量
 等杂质离子,粗盐提纯的流程如图所示:
等杂质离子,粗盐提纯的流程如图所示:
 分别为足量的
分别为足量的(2)操作2的名称是
(3)“滤液”中加入足量的试剂
 生成气泡的离子方程式为
生成气泡的离子方程式为项目二:模拟“侯氏制碱法“利用上述实验制得的
 全部用于制备纯碱,工艺流程如图所示:
全部用于制备纯碱,工艺流程如图所示:
(4)氮化和碳酸化过程在如图所示装置中进行,
 导管应通入的气体是
导管应通入的气体是 的作用是
的作用是(5)写出煅烧固体时发生的化学方程式:
(6)称取了
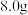 粗盐进行实验,最终制得
粗盐进行实验,最终制得 纯碱,假设完全转化,则粗盐的纯度是
纯碱,假设完全转化,则粗盐的纯度是 。(保留2位有效数字)
。(保留2位有效数字)
您最近一年使用:0次
3 . 已知SO2+I2+2H2O=H2SO4+2HI,某化学兴趣小组选用下列实验装置,测定工业原料气(含SO2、N2、O2)中SO2的含量。
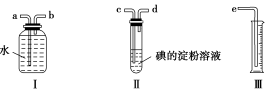
(1)若原料气从左流向右时,上述装置组装连接的顺序:原料气→__________________ (填“a”“b”“c”“d”“e”)。
(2)装置Ⅱ中发生反应的离子方程式为_____________ ;当装置Ⅱ中出现________ 现象时,立即停止通气。
(3)若碘溶液的浓度为0.05 mol/L、体积为20 mL,收集到的N2与O2的体积为297.6 mL(已折算为标准状况下的体积),SO2的体积分数为________ 。

(1)若原料气从左流向右时,上述装置组装连接的顺序:原料气→
(2)装置Ⅱ中发生反应的离子方程式为
(3)若碘溶液的浓度为0.05 mol/L、体积为20 mL,收集到的N2与O2的体积为297.6 mL(已折算为标准状况下的体积),SO2的体积分数为
您最近一年使用:0次
2018-09-06更新
|
466次组卷
|
6卷引用:贵州省毕节市实验高级中学2017-2018学年高一下学期期中考试化学试题
名校
解题方法
4 . 尿素[CO(NH2)2]是目前使用量较大的一种化学氮肥。某化学实验小组以尿素为原料制备 (水合肼)并验证水合肼还原性的实验流程如图1所示:
(水合肼)并验证水合肼还原性的实验流程如图1所示:

已知① 沸点用196.6℃;
沸点用196.6℃;
② 沸点为118℃,且能与NaClO剧烈反应生成
沸点为118℃,且能与NaClO剧烈反应生成 。
。
I. 的制备
的制备
(1)从图2的A~E中选择合适的装置制备并收集较纯净的 ,各装置合理的连接顺序为a→_______→_______→_______→_______→_______→_______→d。
,各装置合理的连接顺序为a→_______→_______→_______→_______→_______→_______→d。__________

(2)“步骤一”在高温条件下会有副反应发生,为确保该步骤在低温环境下进行,常采取的措施为_______ ,该步骤发生反应的离子方程式为_______ 。
(3)“步骤二”在图3所示装置中完成。为了避免生成 ,将滴液漏斗b中的NaClO与NaOH混合液缓慢滴入盛有mg尿素的三颈烧瓶a中,边滴加边搅拌,温度迅速升高到120℃。
,将滴液漏斗b中的NaClO与NaOH混合液缓慢滴入盛有mg尿素的三颈烧瓶a中,边滴加边搅拌,温度迅速升高到120℃。

①仪器c的名称为_______
②生成水合肼的化学方程式为_______ 。
Ⅱ.验证 的还原性
的还原性
(4)将“步骤二”制得的水合肼配成1000mL溶液,移出25mL于锥形瓶中,滴加2滴淀粉溶液,用0.05mol/L的 溶液滴定,当滴定完全时,消耗
溶液滴定,当滴定完全时,消耗 溶液VmL。
溶液VmL。
①滴定过程中水合肼被氧化为 ,反应的化学方程式为
,反应的化学方程式为_______ 。
②配成的水合肼的浓度
_______ mol/L(用含V的代数式表示)。
③ 的产率为
的产率为_______ (用含m、V的代数式表示)。
 (水合肼)并验证水合肼还原性的实验流程如图1所示:
(水合肼)并验证水合肼还原性的实验流程如图1所示:
已知①
 沸点用196.6℃;
沸点用196.6℃;②
 沸点为118℃,且能与NaClO剧烈反应生成
沸点为118℃,且能与NaClO剧烈反应生成 。
。I.
 的制备
的制备(1)从图2的A~E中选择合适的装置制备并收集较纯净的
 ,各装置合理的连接顺序为a→_______→_______→_______→_______→_______→_______→d。
,各装置合理的连接顺序为a→_______→_______→_______→_______→_______→_______→d。
(2)“步骤一”在高温条件下会有副反应发生,为确保该步骤在低温环境下进行,常采取的措施为
(3)“步骤二”在图3所示装置中完成。为了避免生成
 ,将滴液漏斗b中的NaClO与NaOH混合液缓慢滴入盛有mg尿素的三颈烧瓶a中,边滴加边搅拌,温度迅速升高到120℃。
,将滴液漏斗b中的NaClO与NaOH混合液缓慢滴入盛有mg尿素的三颈烧瓶a中,边滴加边搅拌,温度迅速升高到120℃。
①仪器c的名称为
②生成水合肼的化学方程式为
Ⅱ.验证
 的还原性
的还原性(4)将“步骤二”制得的水合肼配成1000mL溶液,移出25mL于锥形瓶中,滴加2滴淀粉溶液,用0.05mol/L的
 溶液滴定,当滴定完全时,消耗
溶液滴定,当滴定完全时,消耗 溶液VmL。
溶液VmL。①滴定过程中水合肼被氧化为
 ,反应的化学方程式为
,反应的化学方程式为②配成的水合肼的浓度

③
 的产率为
的产率为
您最近一年使用:0次
2022-10-28更新
|
235次组卷
|
5卷引用:贵州省毕节市金沙县2022-2023学年高三上学期期中教学质量检测化学试题
名校
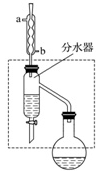
5 . 乙酸丁酯是重要的化工原料,具有水果香味。实验室制备乙酸丁酯(CH3COOCH2CH2CH2CH3)的反应装置示意图和有关信息如下:
(1)乙酸丁酯粗产品的制备
在干燥的50 mL圆底烧瓶中,装入沸石,加入12.0 mL正丁醇和16.0 mL冰醋酸(过量),再加3~4滴浓硫酸。然后再安装分水器(作用:实验过程中不断分离除去反应生成的水)、冷凝管,然后小火加热。写出制备乙酸丁酯的化学方程式_________ 。将烧瓶中反应后的混合物冷却与分水器的酯层合并。装置中冷水应从________ (填“a”或“b”)口通入;通过分水器不断分离除去反应生成的水的目的是_____________ 。(2)乙酸丁酯的精制
将乙酸丁酯粗产品用如下的操作进行精制:①水洗、②蒸馏、③用无水MgSO4干燥、④用10%碳酸钠洗涤。①正确的操作步骤是________________ (填标号)。
A.①②③④ B.③①④② C.④①③② D.③④①②
②在乙酸丁酯的精制中,用10%碳酸钠洗涤的主要目的是_________ 。
③在洗涤、分液操作中,应充分振荡,然后静置,待分层后________ (填标号)。
a.直接将乙酸丁酯从分液漏斗的上口倒出
b.直接将乙酸丁酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸丁酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸丁酯从上口倒出
(3)计算产率
测量分水器内由乙酸与丁醇反应生成的水体积为1.8 mL,假设在制取乙酸丁酯过程中反应物和生成物没有损失,且忽略副反应,乙酸丁酯的产率为________ 。
乙酸 | 正丁醇 | 乙酸丁酯 | |
熔点/℃ | 16.6 | -89.5 | -73.5 |
沸点/℃ | 117.9 | 117 | 126.0 |
密度/g·cm-3 | 1.1 | 0.80 | 0.88 |
在干燥的50 mL圆底烧瓶中,装入沸石,加入12.0 mL正丁醇和16.0 mL冰醋酸(过量),再加3~4滴浓硫酸。然后再安装分水器(作用:实验过程中不断分离除去反应生成的水)、冷凝管,然后小火加热。写出制备乙酸丁酯的化学方程式
将乙酸丁酯粗产品用如下的操作进行精制:①水洗、②蒸馏、③用无水MgSO4干燥、④用10%碳酸钠洗涤。①正确的操作步骤是
A.①②③④ B.③①④② C.④①③② D.③④①②
②在乙酸丁酯的精制中,用10%碳酸钠洗涤的主要目的是
③在洗涤、分液操作中,应充分振荡,然后静置,待分层后
a.直接将乙酸丁酯从分液漏斗的上口倒出
b.直接将乙酸丁酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸丁酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸丁酯从上口倒出
(3)计算产率
测量分水器内由乙酸与丁醇反应生成的水体积为1.8 mL,假设在制取乙酸丁酯过程中反应物和生成物没有损失,且忽略副反应,乙酸丁酯的产率为
您最近一年使用:0次
2018-11-26更新
|
456次组卷
|
3卷引用:贵州省铜仁市思南中学2020-2021学年高二下学期期中考试化学试题



