名校
解题方法
1 . 碘化钾( )是实验室常用的化学试剂,用途广泛。一种利用含碘废液(碘的主要存在形式为
)是实验室常用的化学试剂,用途广泛。一种利用含碘废液(碘的主要存在形式为 和
和 )制备碘化钾的实验步骤如下:
)制备碘化钾的实验步骤如下:
步骤Ⅰ:取含碘废液,调节溶液 为
为 ,加入一定量
,加入一定量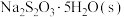 ,溶解,加热至30℃,加入稍过量
,溶解,加热至30℃,加入稍过量 粉末,搅拌,充分反应后,过滤得
粉末,搅拌,充分反应后,过滤得 沉淀;
沉淀;
步骤Ⅱ:在 圆底烧瓶中加入上述制备的
圆底烧瓶中加入上述制备的 沉淀,铁粉(过量),
沉淀,铁粉(过量),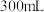 蒸馏水,搅拌,沸水浴加热1小时,冷却,抽滤。将滤液倒入
蒸馏水,搅拌,沸水浴加热1小时,冷却,抽滤。将滤液倒入 烧杯中,加入约
烧杯中,加入约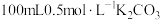 溶液,搅拌,煮沸,静置,过滤,得滤液A;
溶液,搅拌,煮沸,静置,过滤,得滤液A;
步骤Ⅲ:用氢碘酸调滤液A的 ,将滤液倒入___________(填仪器名称)中加热至___________(填现象),冷却,干燥,得到
,将滤液倒入___________(填仪器名称)中加热至___________(填现象),冷却,干燥,得到 晶体。
晶体。
回答下列问题:
(1)步骤Ⅰ中的控温方法为___________ , 与
与 转化为
转化为 的反应为①
的反应为① ,②
,② ,则反应②中氧化剂与还原剂的物质的量之比为
,则反应②中氧化剂与还原剂的物质的量之比为___________ 。
(2)步骤Ⅱ中铁粉转化为 ,该反应的化学方程式为
,该反应的化学方程式为___________ 。
(3)步骤Ⅲ中,仪器的名称是___________ ,现象是___________ 。
(4)产品中KI含量的测定
称取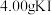 4.00样品,配成
4.00样品,配成 溶液,取
溶液,取 溶液于锥形瓶中,加入
溶液于锥形瓶中,加入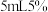 乙酸溶液及3滴曙红钠盐作指示剂,用
乙酸溶液及3滴曙红钠盐作指示剂,用 的
的 标准溶液避光滴定至沉淀呈红色(终点),平行滴定三次,消耗
标准溶液避光滴定至沉淀呈红色(终点),平行滴定三次,消耗 标准溶液分别为
标准溶液分别为 、
、 、
、 。
。
①用 标准溶液滴定时要避光的原因是
标准溶液滴定时要避光的原因是___________ ,在滴定时 溶液应盛放在
溶液应盛放在___________ (“酸式”或“碱式”)滴定管。
②样品中 的质量分数为
的质量分数为___________ 。
 )是实验室常用的化学试剂,用途广泛。一种利用含碘废液(碘的主要存在形式为
)是实验室常用的化学试剂,用途广泛。一种利用含碘废液(碘的主要存在形式为 和
和 )制备碘化钾的实验步骤如下:
)制备碘化钾的实验步骤如下:步骤Ⅰ:取含碘废液,调节溶液
 为
为 ,加入一定量
,加入一定量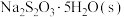 ,溶解,加热至30℃,加入稍过量
,溶解,加热至30℃,加入稍过量 粉末,搅拌,充分反应后,过滤得
粉末,搅拌,充分反应后,过滤得 沉淀;
沉淀;步骤Ⅱ:在
 圆底烧瓶中加入上述制备的
圆底烧瓶中加入上述制备的 沉淀,铁粉(过量),
沉淀,铁粉(过量),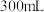 蒸馏水,搅拌,沸水浴加热1小时,冷却,抽滤。将滤液倒入
蒸馏水,搅拌,沸水浴加热1小时,冷却,抽滤。将滤液倒入 烧杯中,加入约
烧杯中,加入约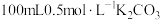 溶液,搅拌,煮沸,静置,过滤,得滤液A;
溶液,搅拌,煮沸,静置,过滤,得滤液A;步骤Ⅲ:用氢碘酸调滤液A的
 ,将滤液倒入___________(填仪器名称)中加热至___________(填现象),冷却,干燥,得到
,将滤液倒入___________(填仪器名称)中加热至___________(填现象),冷却,干燥,得到 晶体。
晶体。回答下列问题:
(1)步骤Ⅰ中的控温方法为
 与
与 转化为
转化为 的反应为①
的反应为① ,②
,② ,则反应②中氧化剂与还原剂的物质的量之比为
,则反应②中氧化剂与还原剂的物质的量之比为(2)步骤Ⅱ中铁粉转化为
 ,该反应的化学方程式为
,该反应的化学方程式为(3)步骤Ⅲ中,仪器的名称是
(4)产品中KI含量的测定
称取
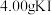 4.00样品,配成
4.00样品,配成 溶液,取
溶液,取 溶液于锥形瓶中,加入
溶液于锥形瓶中,加入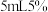 乙酸溶液及3滴曙红钠盐作指示剂,用
乙酸溶液及3滴曙红钠盐作指示剂,用 的
的 标准溶液避光滴定至沉淀呈红色(终点),平行滴定三次,消耗
标准溶液避光滴定至沉淀呈红色(终点),平行滴定三次,消耗 标准溶液分别为
标准溶液分别为 、
、 、
、 。
。①用
 标准溶液滴定时要避光的原因是
标准溶液滴定时要避光的原因是 溶液应盛放在
溶液应盛放在②样品中
 的质量分数为
的质量分数为
您最近一年使用:0次
2024-01-02更新
|
210次组卷
|
2卷引用:贵州省贵阳市2023-2024学年高三上学期11月质量检测化学试题
2 . 中学化学常见的滴定法包括中和滴定法、氧化还原反应滴定法等。
(1)探究小组甲用酸性KMnO4溶液滴定某补血剂[主要成分硫酸亚铁晶体(FeSO4•7H2O)]中铁元素的含量。
①下列滴定装置中(夹持部分略去),最合理的是:____ (填字母序号)。
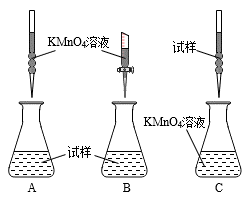
②滴定终点的现象是_____ 。
(2)常温下,探究小组乙将0.1 mol·L-1盐酸滴入20 mL 0.1 mol·L-1氨水中,溶液的pH随加入盐酸体积的变化曲线如图所示。
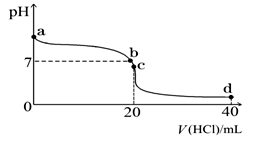
①a点处假设溶液的pH=10,则该点处由水电离产生的c(OH-)=_____ 。
②取c点时的饱和溶液并向其加入水玻璃(硅酸钠水溶液),振荡、静置。写出实验现象并用必要的文字和相关离子方程式给予解释:____ 。
③d点所示溶液中离子浓度由大到小的排序是_____ 。
(1)探究小组甲用酸性KMnO4溶液滴定某补血剂[主要成分硫酸亚铁晶体(FeSO4•7H2O)]中铁元素的含量。
①下列滴定装置中(夹持部分略去),最合理的是:

②滴定终点的现象是
(2)常温下,探究小组乙将0.1 mol·L-1盐酸滴入20 mL 0.1 mol·L-1氨水中,溶液的pH随加入盐酸体积的变化曲线如图所示。

①a点处假设溶液的pH=10,则该点处由水电离产生的c(OH-)=
②取c点时的饱和溶液并向其加入水玻璃(硅酸钠水溶液),振荡、静置。写出实验现象并用必要的文字和相关离子方程式给予解释:
③d点所示溶液中离子浓度由大到小的排序是
您最近一年使用:0次
名校
解题方法
3 . “化学——我们的生活,我们的未来”,学习化学应该明白“从生活中来,到生活中去”的道理。
(1)小苏打常用于糕点制作,还可治疗胃酸过多等,有多种用途。请写出小苏打溶液与氢氧化钠溶液反应的离子方程式:_________ 。
(2)过氧化钠常用作呼吸面具或潜水艇中的供氧剂,请你写出过氧化钠与二氧化碳反应的化学方程式:_________ 。
(3)有小组同学称取10 g所制备Na2O2的样品(设样品中杂质不参与下列反应),利用下列装置测定Na2O2样品的纯度(夹持仪器省略),已知Na2O2的摩尔质量为78 g/mol。

有同学提出该实验装置存在缺陷,应该在A、B装置之间增加一个盛有饱和 溶液的洗气瓶,该同学想法是否有必要?理由是
溶液的洗气瓶,该同学想法是否有必要?理由是_________ 。倒出量筒内水的体积后,折算成标准状况下O2的体积为1120 mL,计算样品中Na2O2的质量分数约为_________ 。
(4)向30 mL NaOH溶液中逐渐通入一定量的CO2,再向该溶液中逐滴加入2 mol/L盐酸,所加入盐酸的体积(单位为mL)与产生二氧化碳的体积(标准状况下)关系如图所示。
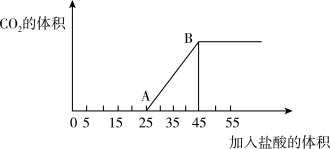
A点溶液中溶质为:_________ ,计算原NaOH溶液的物质的量浓度是_________ mol/L。
(1)小苏打常用于糕点制作,还可治疗胃酸过多等,有多种用途。请写出小苏打溶液与氢氧化钠溶液反应的离子方程式:
(2)过氧化钠常用作呼吸面具或潜水艇中的供氧剂,请你写出过氧化钠与二氧化碳反应的化学方程式:
(3)有小组同学称取10 g所制备Na2O2的样品(设样品中杂质不参与下列反应),利用下列装置测定Na2O2样品的纯度(夹持仪器省略),已知Na2O2的摩尔质量为78 g/mol。

有同学提出该实验装置存在缺陷,应该在A、B装置之间增加一个盛有饱和
 溶液的洗气瓶,该同学想法是否有必要?理由是
溶液的洗气瓶,该同学想法是否有必要?理由是(4)向30 mL NaOH溶液中逐渐通入一定量的CO2,再向该溶液中逐滴加入2 mol/L盐酸,所加入盐酸的体积(单位为mL)与产生二氧化碳的体积(标准状况下)关系如图所示。

A点溶液中溶质为:
您最近一年使用:0次



