名校
1 . 《化学与生活》(1)性能各异的各种材料的广泛应用大大提高了人们的生活水平。试回答问题:
①我国发射的“神舟”系列飞船上使用了一种由我国科学家合成的新型“连续纤维增韧”航空材料,其主要成分是由碳化硅、陶瓷和碳纤维复合而成。下列相关叙述不正确的是_____ 填字母)。
a.它耐高温抗氧化 b.它比钢铁轻、硬,但质地较脆c.它是一种新型无机非金属材料
②工业制备下列物质时,不需要石灰石的是___________ (填字母)。
a.玻璃 b.水泥 c.陶瓷
③材料与化学密切相关,表中对应关系正确的是_____ (填字母)。
(2)①下图是某品牌白醋标签上的部分文字说明。
所列原料中,富含淀粉的是_________ ,(填序号,下同),属于防腐剂的是_______ 。试写出淀粉完全水解的化学方程式_____________ 。
②误食“工业盐”(亚硝酸钠)作为食盐引起的恶性食物中毒事故屡有发生。所以在肉制品加工中使用护色剂必须严格控制其使用量,确保食用安全。已知NaNO2能发生如下反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O,根据上述反应,可以用试纸和生活中常见的物质进行实验,以鉴别NaNO2和NaCl,可选用的物质有①自来水②碘化钾淀粉试纸③淀粉④白糖⑤白酒⑥食醋。进行实验时,必须选用的物质有____________ 。
(3)中共十九大报告提出:“大力推进生态文明建设”。
①南京青奥会期间使用了全生物降解塑料袋用于餐饮和处理垃圾,而不用传统的高分子材料聚乙烯、聚氯乙烯及聚苯乙烯等。制取高分子材料聚氯乙烯的单体是_________ (填结构简式)。
②下图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。该电化腐蚀称为______ ,图中A、B、C、D四个区域,生成铁锈最多的是__________ (填字母)。

③汽车尾气中含有污染大气的NOx和CO。给汽车排气管加装“催化转化器”,可使CO和NOx反应生成无毒无污染的气体,反应的化学方程式为_______________ 。
④含铬元素的废水必须治理达标。某兴趣小组探究含铬(Cr2O72-)废水的处理方法,经查阅资料,拟采用(NH4)2Fe(SO4)2将Cr2O72-还原为Cr3+,再用氨水将Cr3+转变成难溶的Cr(OH)3。该方案运用了污水处理方法中的沉淀法和___________ 。指导老师指出该方案处理后的废水中因含有大量__________ (填离子符号),能导致水体富营养化。
①我国发射的“神舟”系列飞船上使用了一种由我国科学家合成的新型“连续纤维增韧”航空材料,其主要成分是由碳化硅、陶瓷和碳纤维复合而成。下列相关叙述不正确的是
a.它耐高温抗氧化 b.它比钢铁轻、硬,但质地较脆c.它是一种新型无机非金属材料
②工业制备下列物质时,不需要石灰石的是
a.玻璃 b.水泥 c.陶瓷
③材料与化学密切相关,表中对应关系正确的是
| 选项 | 材料 | 主要化学成分 |
| a | 刚玉、金刚石 | 三氧化二铝 |
| b | 大理石、石灰石 | 碳酸钙 |
| c | 光导纤维、普通玻璃 | 硅酸盐 |
(2)①下图是某品牌白醋标签上的部分文字说明。
所列原料中,富含淀粉的是
| 原料:①水②大米③白酒④碘酒⑤苯甲酸钠 产品标准:GB18187-2000液态发酵 保质期:24个月 用途:凉拌、烹饪 酸度:≥6.00 g/100mL |
②误食“工业盐”(亚硝酸钠)作为食盐引起的恶性食物中毒事故屡有发生。所以在肉制品加工中使用护色剂必须严格控制其使用量,确保食用安全。已知NaNO2能发生如下反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O,根据上述反应,可以用试纸和生活中常见的物质进行实验,以鉴别NaNO2和NaCl,可选用的物质有①自来水②碘化钾淀粉试纸③淀粉④白糖⑤白酒⑥食醋。进行实验时,必须选用的物质有
(3)中共十九大报告提出:“大力推进生态文明建设”。
①南京青奥会期间使用了全生物降解塑料袋用于餐饮和处理垃圾,而不用传统的高分子材料聚乙烯、聚氯乙烯及聚苯乙烯等。制取高分子材料聚氯乙烯的单体是
②下图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。该电化腐蚀称为

③汽车尾气中含有污染大气的NOx和CO。给汽车排气管加装“催化转化器”,可使CO和NOx反应生成无毒无污染的气体,反应的化学方程式为
④含铬元素的废水必须治理达标。某兴趣小组探究含铬(Cr2O72-)废水的处理方法,经查阅资料,拟采用(NH4)2Fe(SO4)2将Cr2O72-还原为Cr3+,再用氨水将Cr3+转变成难溶的Cr(OH)3。该方案运用了污水处理方法中的沉淀法和
您最近一年使用:0次
2 . 下列物质性质与应用对应关系正确的是
| A.二氧化锰具有还原性,可用于实验室制备氯气 |
| B.Na2O2能与水或二氧化碳反应生成氧气,可用作供氧剂 |
| C.碳酸氢钠能与碱反应,可用作食品的膨松剂 |
| D.证明一瓶红棕色气体是溴蒸气还是二氧化氮,可用湿润的碘化钾-淀粉试纸检验,观察试纸颜色的变化 |
您最近一年使用:0次
3 . 亚硝酸钠(NaNO2)是一种用途广泛的工业盐,因其外观和相似容易误食中毒。亚硝酸钠加热到 320 ℃以上会分解产生 Na2O、N2和O2。其水溶液呈碱性,能与 AgNO3 液反应生成难溶于水、易溶于酸的 AgNO2。由于NaNO2有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。回答下列问题。
(1)从物质分类角度来看,NaNO2,属于___________ (填标号)。
a.酸性氧化物 b.钠盐 c.碱 d.电解质
(2)下列方法能用来区分固体 NaNO2 和 NaCl 的是___________(填标号)。
(3)处理含 NaNO2的废水方法之一如下,补充并配平该化学方程式(若系数为 1,请标注”1”) _________
______NaNO2 + ______KI+ ______=______NO↑+______I2+ ______K2SO4+ _____Na2SO4+______H2O
(4)已知 NO在常温下是无色、有毒的气体。用上述反应来处理 NaNO2 并不是最佳方法,其原因是___________ 。
(5)误食 NaNO2会导致人体血红蛋白中的 Fe2+转化为 Fe3+而中毒,该过程中 NaNO2 表现出的性质与下列___________(填标号)反应中 H2O2 表现出的性质相同。
(6)已知亚硝酸钠可以与氯化铵反应生成氮气和氯化钠,写出该反应的化学方程式,并用单线桥表示其电子转移的方向和数目:___________ 。
(1)从物质分类角度来看,NaNO2,属于
a.酸性氧化物 b.钠盐 c.碱 d.电解质
(2)下列方法能用来区分固体 NaNO2 和 NaCl 的是___________(填标号)。
| A.分别溶于水 |
| B.分别溶于水并滴加 AgNO3 溶液 |
| C.分别加强热并收集气体检验 |
| D.用筷子分别蘸取固体品尝味道 |
______NaNO2 + ______KI+ ______=______NO↑+______I2+ ______K2SO4+ _____Na2SO4+______H2O
(4)已知 NO在常温下是无色、有毒的气体。用上述反应来处理 NaNO2 并不是最佳方法,其原因是
(5)误食 NaNO2会导致人体血红蛋白中的 Fe2+转化为 Fe3+而中毒,该过程中 NaNO2 表现出的性质与下列___________(填标号)反应中 H2O2 表现出的性质相同。
A.2H2O2 2H2O+O2↑ 2H2O+O2↑ |
| B.H2O2+Cl2=2HCl+O2↑ |
| C.H2O2+H2SO4+2KI=2H2O+I2+K2SO4 |
| D.5H2O2+2KMnO4+6HCl=2MnCl2+2KCl+5O2 ↑+8H2O |
您最近一年使用:0次
2023-11-01更新
|
21次组卷
|
2卷引用:安徽省阜阳市临泉第一中学2023-2024学年高一上学期10月月考化学试题
解题方法
4 . 亚硝酸钠(NaNO2)是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。亚硝酸钠加热到320℃以上会分解产生Na2O、N2和O2,亚硝酸钠水溶液呈碱性,能与AgNO3溶液反应生成难溶于水、易溶于酸的AgNO2.回答下列问题:
(1)下列方法不能用来区分固体NaNO2和NaCl的是_______(填序号)。
(2)误食NaNO2会导致人体血红蛋白中的Fe2+转化为Fe3+而中毒,该过程中NaNO2表现出的性
质与下列_______ (填空)反应中H2O2表现出的性质相同。
A.2H2O2 2H2O+O2↑
2H2O+O2↑
B.H2O2+Cl2=2HCl+O2↑
C. H2O2+H2SO4+2KI=2H2O+I2+K2SO4
D.5H2O2+2KMnO4+6HCl=2MnCl2+2KCl+5O2↑+8H2O
服用维生素C可将Fe3+转化为Fe2+从而解毒,维生素C的作用是_______ (填“氧化剂”“还原剂”或“既是氧化剂又是还原剂”)。
(3)可用Cl2将溶液中的NO 氧化为NO
氧化为NO ,同时生成Cl-,已知Cl2+NaNO2+H2O=2HCl+NaNO3,则该反应的离子方程式为
,同时生成Cl-,已知Cl2+NaNO2+H2O=2HCl+NaNO3,则该反应的离子方程式为_______ 。
(1)下列方法不能用来区分固体NaNO2和NaCl的是_______(填序号)。
| A.分别溶于水并滴加酚酞试液 | B.分别溶于水并滴加HNO3酸化的AgNO3溶液 |
| C.分别加强热并收集气体检验 | D.用筷子分别蘸取固体品尝味道 |
质与下列
A.2H2O2
 2H2O+O2↑
2H2O+O2↑ B.H2O2+Cl2=2HCl+O2↑
C. H2O2+H2SO4+2KI=2H2O+I2+K2SO4
D.5H2O2+2KMnO4+6HCl=2MnCl2+2KCl+5O2↑+8H2O
服用维生素C可将Fe3+转化为Fe2+从而解毒,维生素C的作用是
(3)可用Cl2将溶液中的NO
 氧化为NO
氧化为NO ,同时生成Cl-,已知Cl2+NaNO2+H2O=2HCl+NaNO3,则该反应的离子方程式为
,同时生成Cl-,已知Cl2+NaNO2+H2O=2HCl+NaNO3,则该反应的离子方程式为
您最近一年使用:0次
5 . 亚硝酸钠(NaNO2)是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。亚硝酸钠加热到320℃以上会分解产生Na2O、N2和O2,亚硝酸钠水溶液呈碱性,能与AgNO3溶液反应生成难溶于水、易溶于酸的AgNO2。回答下列问题:
(1)下列方法不能用来区分固体NaNO2和NaCl的是____ (填序号)。
(2)误食NaNO2会导致人体血红蛋白中的Fe2+转化为Fe3+而中毒,该过程中NaNO2表现出的性质与下列____ (填序号)反应中H2O2表现出的性质相同。
A.2H2O2 2H2O+O2↑
2H2O+O2↑
B.H2O2+Cl2=2HCl+O2↑
C.H2O2+H2SO4+2KI=2H2O+I2+K2SO4
D.5H2O2+2KMnO4+6HCl=2MnCl2+2KCl+5O2↑+8H2O
服用维生素C可将Fe3+转化为Fe2+从而解毒,维生素C的作用是____ (填“氧化剂”“还原剂”或“既是氧化剂又是还原剂”)。
(3)亚硝酸钠受热分解的化学方程式为4NaNO2 2Na2O+2N2↑+3O2↑,若反应中有12.4gNa2O固体生成,则转移电子的物质的量为
2Na2O+2N2↑+3O2↑,若反应中有12.4gNa2O固体生成,则转移电子的物质的量为____ mol。
(4)可用Cl2将溶液中的NO 氧化为NO
氧化为NO ,同时生成Cl-,已知Cl2+NaNO2+H2O=2HCl+NaNO3,则该反应的离子方程式为
,同时生成Cl-,已知Cl2+NaNO2+H2O=2HCl+NaNO3,则该反应的离子方程式为_____ 。
(1)下列方法不能用来区分固体NaNO2和NaCl的是
| A.分别溶于水并滴加酚酞试液 | B.分别溶于水并滴加HNO3酸化的AgNO3溶液 |
| C.分别加强热并收集气体检验 | D.用筷子分别蘸取固体品尝味道 |
A.2H2O2
 2H2O+O2↑
2H2O+O2↑B.H2O2+Cl2=2HCl+O2↑
C.H2O2+H2SO4+2KI=2H2O+I2+K2SO4
D.5H2O2+2KMnO4+6HCl=2MnCl2+2KCl+5O2↑+8H2O
服用维生素C可将Fe3+转化为Fe2+从而解毒,维生素C的作用是
(3)亚硝酸钠受热分解的化学方程式为4NaNO2
 2Na2O+2N2↑+3O2↑,若反应中有12.4gNa2O固体生成,则转移电子的物质的量为
2Na2O+2N2↑+3O2↑,若反应中有12.4gNa2O固体生成,则转移电子的物质的量为(4)可用Cl2将溶液中的NO
 氧化为NO
氧化为NO ,同时生成Cl-,已知Cl2+NaNO2+H2O=2HCl+NaNO3,则该反应的离子方程式为
,同时生成Cl-,已知Cl2+NaNO2+H2O=2HCl+NaNO3,则该反应的离子方程式为
您最近一年使用:0次
名校
解题方法
6 . 如图所示装置有多种用途,请回答下列问题:

(1)洗气:除去Cl2中的水蒸气,装置内应盛放_____________ ;
(2)检验:证明CO中混有CO2,装置内应盛放_____________ ;
(3)集气:若用排空气法收集比空气重的气体时,气体应从装置的_____________ 端通入(填“A”或“B”,下同);若用排水法收集O2时,瓶内应先装满水,气体从_____________ 端通入。
(4)贮气:若要用水将装置中的氧气排出进行实验时,水应从_____________ 端通入。
(5)控制气体流量:医院给病人输O2时,也利用了类似的装置,并在装置中盛放大约半瓶蒸馏水,氧气应从_____________ 端通入。

(1)洗气:除去Cl2中的水蒸气,装置内应盛放
(2)检验:证明CO中混有CO2,装置内应盛放
(3)集气:若用排空气法收集比空气重的气体时,气体应从装置的
(4)贮气:若要用水将装置中的氧气排出进行实验时,水应从
(5)控制气体流量:医院给病人输O2时,也利用了类似的装置,并在装置中盛放大约半瓶蒸馏水,氧气应从
您最近一年使用:0次
7 . 硫酸亚铁铵[(NH4)2Fe(SO4)2]是分析化学中的重要试剂,在不同温度下加热分解产物不同。设计如图实验装置(夹持装置略去),在500℃时隔绝空气加热A中的硫酸亚铁铵至分解完全。确定分解产物的成分。
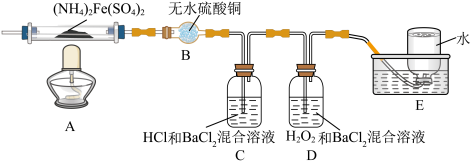
(1)B装置的作用是_________ 。
(2)实验中,观察到C中无明显现象,D中有白色沉淀生成,可确定产物中一定有_______ 气体产生,写出D中发生反应的离子方程式________ 。
(3)A中固体分解后产生NH3,写出其两种用途_________ 。
(4)用实验的方法验证C溶液含有NH4+:_________ 。

(1)B装置的作用是
(2)实验中,观察到C中无明显现象,D中有白色沉淀生成,可确定产物中一定有
(3)A中固体分解后产生NH3,写出其两种用途
(4)用实验的方法验证C溶液含有NH4+:
您最近一年使用:0次
解题方法
8 . 肼(N2H4,无色液体)是一种用途广泛的化工原料。实验室中先制备次氯酸钠,再用次氯酸钠溶液和氨反应制备肼并验证肼的性质。实验装置如图所示。

已知:Cl2(g)+2NaOH(aq)=NaClO(aq)+NaCl(aq)+H2O(g) △H<0。当温度超过40℃时,Cl2与NaOH溶液反应生成NaClO3。回答下列问题:
(1)仪器a的名称是________________ ,装置B的作用是____________________________ 。
(2)为控制D装置中的反应温度,除用冷水浴外,还需采取的实验操作是________________ 。
(3)当三颈烧瓶中出现黄绿色气体时立即关闭分液漏斗活塞、移去酒精灯、关闭K1。此时装置C的作用是________________________________ 。
(4)将D装置水槽中的冷水换为热水,把三颈烧瓶中黄绿色气体赶走后,打开K2,通入NH3,使其与NaClO溶液反应制取肼。理论上通入三颈烧瓶的Cl2和NH3的最佳物质的量之比为______________ 。
(5)请从提供的下列试剂中选择合适试剂,设计合理的实验方案验证肼的还原性____________ (说明操作、现象和结论)。
①淀粉-KI溶液 ②稀硫酸(酚酞) ③NaHCO3 ④AgC1

已知:Cl2(g)+2NaOH(aq)=NaClO(aq)+NaCl(aq)+H2O(g) △H<0。当温度超过40℃时,Cl2与NaOH溶液反应生成NaClO3。回答下列问题:
(1)仪器a的名称是
(2)为控制D装置中的反应温度,除用冷水浴外,还需采取的实验操作是
(3)当三颈烧瓶中出现黄绿色气体时立即关闭分液漏斗活塞、移去酒精灯、关闭K1。此时装置C的作用是
(4)将D装置水槽中的冷水换为热水,把三颈烧瓶中黄绿色气体赶走后,打开K2,通入NH3,使其与NaClO溶液反应制取肼。理论上通入三颈烧瓶的Cl2和NH3的最佳物质的量之比为
(5)请从提供的下列试剂中选择合适试剂,设计合理的实验方案验证肼的还原性
①淀粉-KI溶液 ②稀硫酸(酚酞) ③NaHCO3 ④AgC1
您最近一年使用:0次
9 . 实验室中的试纸种类很多、用途也比较广泛。下列试纸使用时不需要对试纸预先用蒸馏水润湿的是( )
| A.用蓝色石蕊试纸检验氯化氢气体 |
| B.用KI淀粉试纸检验氯气的存在 |
| C.收集氨气时,用红色石蕊试纸检验是否收集满 |
| D.用pH试纸检测稀盐酸溶液的pH |
您最近一年使用:0次
2017-11-08更新
|
528次组卷
|
5卷引用:河北省邯郸市第二中学2017-2018学年高二上学期期中考试化学试题
河北省邯郸市第二中学2017-2018学年高二上学期期中考试化学试题2020届高三化学二轮冲刺新题专练——药品的保存和使用、指示剂试纸的使用(提升练)安徽省滁州市凤阳博文国际学校2019-2020学年高一上学期期末检测化学试题天津市第一中学2022-2023学年高一上学期期末质量调查化学试题(已下线)专项04 化学实验基础知识与基本技能-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(人教版2019必修第一册)
10 . 水蒸气通过的灼热的焦炭后,流出气体的主要成分是 CO 和 H2,还有 CO2和水蒸气等。现利用下图中提供实验装置,证明上述混合气体中有CO 和 H2。(A中加热装置在图中略去)回答下列问题:

(1) C装置的用途是____________
(2)仪器 E 中需加入的试剂是_____________
(3)仪器 F 中需加入的试剂是:______ ,其目的是_________________
(4)装置F和G的位置能否颠倒_____ ,(填“能”或“否”)理由是____________________
(5)能证明混合气中含有 CO 的实验现象是________________________
(6)有人认为该实验装置存在一个缺陷,你认为这个缺陷是___________

(1) C装置的用途是
(2)仪器 E 中需加入的试剂是
(3)仪器 F 中需加入的试剂是:
(4)装置F和G的位置能否颠倒
(5)能证明混合气中含有 CO 的实验现象是
(6)有人认为该实验装置存在一个缺陷,你认为这个缺陷是
您最近一年使用:0次



