名校
解题方法
1 . 化合物X由3种元素组成。某兴趣小组按如下流程进行实验:

已知:A由两种气体组成,且两种气体组成元素相同。请回答下列问题:
(1)X的组成元素有___________ ;X的化学式为___________ 。
(2)固体B的成分是___________ (用化学式表示)
(3)X化学性质相当活泼,1mol X吸收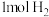 只生成一种二元弱酸Y和1mol气体C,请写出Y与足量NaOH溶液反应的离子方程式
只生成一种二元弱酸Y和1mol气体C,请写出Y与足量NaOH溶液反应的离子方程式___________ 。
(4)设计实验证明溶液G中的阳离子___________ 。

已知:A由两种气体组成,且两种气体组成元素相同。请回答下列问题:
(1)X的组成元素有
(2)固体B的成分是
(3)X化学性质相当活泼,1mol X吸收
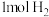 只生成一种二元弱酸Y和1mol气体C,请写出Y与足量NaOH溶液反应的离子方程式
只生成一种二元弱酸Y和1mol气体C,请写出Y与足量NaOH溶液反应的离子方程式(4)设计实验证明溶液G中的阳离子
您最近一年使用:0次
2022-06-26更新
|
646次组卷
|
6卷引用:浙江省舟山市普陀中学2023届高三返校考试化学试题
浙江省舟山市普陀中学2023届高三返校考试化学试题(已下线)2023年1月浙江省普通高校招生选考科目考试化学仿真模拟试卷C(已下线)2019年高考浙江卷化学试题变式题(物质组成的测定)浙江省温州浙南名校联盟2021-2022学年高二下学期期末联考化学试题 浙江省宁波市余姚中学2022-2023学年高二下学期3月月考化学试题 浙江省杭州市临平区杭州二中树兰高级中学2022-2023学年高二下学期第一次调研化学试题
2 . 磷酸亚铁锂(LiFePO4)是生产锂电池的重要材料。实验室中用下图装置制备LiFePO4:在仪器A中加入40mL蒸馏水、少量抗坏血酸,再加入0.01molH3PO4和0.01molFeSO4·7H2O,用搅拌器搅拌溶解后,缓慢加入0.03molLiOH·H2O,继续搅拌5min。快速将反应液装入反应釜中,保持170℃恒温5h。
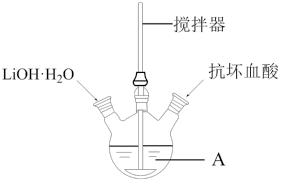
(1)仪器A的名称是_______ ;实验所用蒸馏水若未经煮沸直接使用,则可能发生反应的离子方程式为_______ 。
(2)实验中可用Na2SO3代替抗坏血酸,其原理是_______ (用离子方程式表示);不能用铁粉代替抗坏血酸的原因是_______ 。
(3)反应釜中反应充分后,要得到LiFePO4固体产品的实验操作是将反应液冷却至室温,_______ 、用蒸馏水洗涤沉淀、_______ 。
(4)检验产品中是否混有Fe(OH)3或FePO4杂质的方法是_______ 。
(5)若实验得到无杂质产品1.28g,则LiFePO4的产率为_______ %(保留小数点后1位)。

(1)仪器A的名称是
(2)实验中可用Na2SO3代替抗坏血酸,其原理是
(3)反应釜中反应充分后,要得到LiFePO4固体产品的实验操作是将反应液冷却至室温,
(4)检验产品中是否混有Fe(OH)3或FePO4杂质的方法是
(5)若实验得到无杂质产品1.28g,则LiFePO4的产率为
您最近一年使用:0次
解题方法
3 . 某固体X可能含有 、Fe3+、Na+、Cl-、
、Fe3+、Na+、Cl-、 、
、 中的几种离子,将固体X均分为两份,进行如下实验:
中的几种离子,将固体X均分为两份,进行如下实验:
(1)一份固体溶于水得透明溶液,加入足量BaCl2溶液,得白色沉淀6. 63 g,在沉淀中加入过量稀盐酸,仍有4. 66g白色沉淀。
(2)另一份固体与过量NaOH固体混合后充分加热,产生使湿润的红色石蕊试纸变蓝色的气体0. 672 L(标准状况)。
下列说法正确的是
 、Fe3+、Na+、Cl-、
、Fe3+、Na+、Cl-、 、
、 中的几种离子,将固体X均分为两份,进行如下实验:
中的几种离子,将固体X均分为两份,进行如下实验:(1)一份固体溶于水得透明溶液,加入足量BaCl2溶液,得白色沉淀6. 63 g,在沉淀中加入过量稀盐酸,仍有4. 66g白色沉淀。
(2)另一份固体与过量NaOH固体混合后充分加热,产生使湿润的红色石蕊试纸变蓝色的气体0. 672 L(标准状况)。
下列说法正确的是
A.该固体中一定含有 、 、 、 、 、Na+ 、Na+ |
| B.固体X中Na+物质的量至少为0.03mol |
| C.该固体中一定没有Fe3+和Cl- |
D.该固体中只含有 、 、 、 、 |
您最近一年使用:0次
4 . 某同学看到“利用零价铁还原 脱除地下水中硝酸盐”的相关报道后,利用如下装置探究铁粉与
脱除地下水中硝酸盐”的相关报道后,利用如下装置探究铁粉与 溶液的反应。实验过程如下:
溶液的反应。实验过程如下:

ⅰ.打开弹簧夹,缓慢通入 ,并保持后续反应均在
,并保持后续反应均在 氛围中进行;
氛围中进行;
ⅱ.加入pH已调至2.5的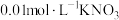 酸性溶液100mL,一段时间后铁屑部分溶解,溶液逐渐变为浅绿色;待铁粉不再溶解静置后发现,剩余固体表面有少量白色物质附着;
酸性溶液100mL,一段时间后铁屑部分溶解,溶液逐渐变为浅绿色;待铁粉不再溶解静置后发现,剩余固体表面有少量白色物质附着;
ⅲ.过滤剩余固体时,表面的白色物质变为红褐色;
ⅳ.检测到滤液中存在 、
、 和
和 。
。
(1)通入 并保持后续反应均在
并保持后续反应均在 氛围中进行的实验目的是
氛围中进行的实验目的是_______ 。
(2)白色物质是_______ ,用化学方程式解释其变为红褐色的原因:_______ 。
(3)用 ]检验滤液中
]检验滤液中 的实验方案是
的实验方案是_______ 。
(4)取少量滤液,向其中加入几滴KSCN溶液,无明显现象;再加入几滴稀硫酸,溶液呈红色。溶液变成红色的原因是_______ 。
(5)该同学进一步查阅文献发现,用铁粉、碳粉混合物脱除硝酸盐,效果更佳。他用上述 溶液继续设计如下实验,探究碳粉的作用。
溶液继续设计如下实验,探究碳粉的作用。
③关于碳粉的作用,还可以提出的假设是_______ 。
 脱除地下水中硝酸盐”的相关报道后,利用如下装置探究铁粉与
脱除地下水中硝酸盐”的相关报道后,利用如下装置探究铁粉与 溶液的反应。实验过程如下:
溶液的反应。实验过程如下:
ⅰ.打开弹簧夹,缓慢通入
 ,并保持后续反应均在
,并保持后续反应均在 氛围中进行;
氛围中进行;ⅱ.加入pH已调至2.5的
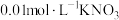 酸性溶液100mL,一段时间后铁屑部分溶解,溶液逐渐变为浅绿色;待铁粉不再溶解静置后发现,剩余固体表面有少量白色物质附着;
酸性溶液100mL,一段时间后铁屑部分溶解,溶液逐渐变为浅绿色;待铁粉不再溶解静置后发现,剩余固体表面有少量白色物质附着;ⅲ.过滤剩余固体时,表面的白色物质变为红褐色;
ⅳ.检测到滤液中存在
 、
、 和
和 。
。(1)通入
 并保持后续反应均在
并保持后续反应均在 氛围中进行的实验目的是
氛围中进行的实验目的是(2)白色物质是
(3)用
 ]检验滤液中
]检验滤液中 的实验方案是
的实验方案是(4)取少量滤液,向其中加入几滴KSCN溶液,无明显现象;再加入几滴稀硫酸,溶液呈红色。溶液变成红色的原因是
(5)该同学进一步查阅文献发现,用铁粉、碳粉混合物脱除硝酸盐,效果更佳。他用上述
 溶液继续设计如下实验,探究碳粉的作用。
溶液继续设计如下实验,探究碳粉的作用。| 假设 | 实验操作 | 现象及结论 |
| 假设1:碳粉可用作还原剂,脱除硝酸盐 | 向烧杯中加入① 的浓度 的浓度 |  浓度无明显变化,说明假设1不成立 浓度无明显变化,说明假设1不成立 |
| 假设2:碳粉、铁粉形成无数个微小的原电池,促进了硝酸盐的脱除 | 按下图所示组装实验装置,一段时间后,测定 浓度 浓度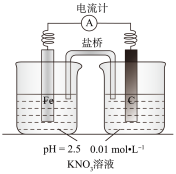 | ② |
您最近一年使用:0次
名校
解题方法
5 . 下列方案设计、现象和结论有正确的是
| 目的 | 方案设计 | 现象和结论 | |
| A | 鉴定 与溴蒸气 与溴蒸气 | 两气体分别通入淀粉KI溶液中 | 变蓝色的是通入溴蒸气 |
| B | 检验固体混合物是否存在铵盐 | 将固体溶于水,加入足量浓NaOH溶液,加热,用红色湿润石蕊试纸检验产生的气体 | 若试纸不变蓝,说明固体中不存在铵盐 |
| C | 检验 的氧化性 的氧化性 | 在 溶液中加入 溶液中加入 溶液 溶液 | 若溶液出现淡黄色沉淀,则说明 具有氧化性 具有氧化性 |
| D | 检验火柴头中的氯元素 | 取用火柴头浸泡过的溶液,加 溶液、稀硝酸和 溶液、稀硝酸和 溶液 溶液 | 若出现白色沉淀,说明有氯元素 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-05-21更新
|
563次组卷
|
4卷引用:浙江省精诚联盟2022届高三下学期适应性考试化学试题
浙江省精诚联盟2022届高三下学期适应性考试化学试题(已下线)第28讲 物质的分离、提纯和检验(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)专题05 突破化学实验基础(选择题)-2023年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)天津市第二十一中学2023-2024学年高三上学期期中质量检测化学试题
6 . 下列实验方案与实验结论均正确的是
| 选项 | 实验方案 | 实验结论 |
| A | 向Fe(NO3)2溶液中滴加稀盐酸,再加入几滴KSCN溶液,溶液变为红色 | 稀盐酸可以将Fe2+氧化为Fe3+ |
| B | 取未知溶液于试管中,加入足量稀盐酸,无明显现象,再加入BaCl2溶液,溶液中有白色沉淀生成 | 溶液中一定含有SO |
| C | 取未知溶液于试管中,加入BaCl2溶液,有白色沉淀生成,再加入足量稀盐酸,沉淀不溶解 | 溶液中一定含有SO |
| D | 取未知溶液于试管中,滴入几滴0.1mol·L-1的 溶液,将湿润的红色石蕊试纸放在试管口处,试纸不变色 溶液,将湿润的红色石蕊试纸放在试管口处,试纸不变色 | 溶液中不含NH |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-04-19更新
|
489次组卷
|
3卷引用:第02练 离子反应-2023年高考化学一轮复习小题多维练(全国通用)
(已下线)第02练 离子反应-2023年高考化学一轮复习小题多维练(全国通用)陕西省西安中学 2023 届高三上学期第二次质量检测化学试题河南省商丘市虞城县高级中学2021-2022学年高一下学期期中考试化学试题
7 . 下列有关实验操作、现象和结论均正确的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向某白色晶体中滴加几滴浓硫酸,将湿润的品红试纸靠近试管口 | 产生的无色气体使试纸变白 | 该晶体中一定含有SO |
| B | 向5mL0.1mol·L-1KI溶液中加入10mL0.1mol·L-1FeCl3溶液,充分反应后滴加KSCN溶液 | 溶液变红 | I-与Fe3+的反应是可逆反应 |
| C | 常温下,用pH计测量0.1mol·L-1NH4CN溶液的pH | pH=8.6 | 电离平衡常数:Kb(NH3·H2O)>Ka(HCN) |
| D | 取一支试管装入2mL2mol·L-1NaOH溶液,先滴入1mL1mol·L-1MgCl2溶液,再滴入几滴1mol·L-1CuCl2溶液 | 先生成白色沉淀,后沉淀变为蓝色 | Ksp[Cu(OH)2]>Ksp(Mg(OH)2) |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
8 . 化学实验中常将溶液或试剂进行酸化,下列酸化处理的措施正确的是
A.检验溶液中是否含有 时,用 时,用 酸化后再加 酸化后再加 溶液 溶液 |
B.为提高 溶液的氧化能力,用盐酸酸化 溶液的氧化能力,用盐酸酸化 溶液 溶液 |
C.检验某溶液是否含有 时,用 时,用 酸化后,加KSCN溶液 酸化后,加KSCN溶液 |
D.检验溶液中是否含有 时,用盐酸酸化后,加 时,用盐酸酸化后,加 溶液 溶液 |
您最近一年使用:0次
2022-04-10更新
|
397次组卷
|
8卷引用:2014届浙江省衢州第二中学高三上学期期中考试化学试卷
名校
解题方法
9 . 溶液中只可能含有 、
、 、
、 、
、 、
、 、
、 、
、 、
、 中的几种。
中的几种。
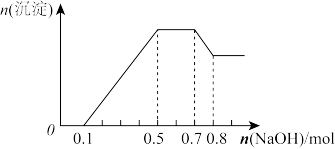
①若加入锌粒,产生无色无味的气体;②若加入 溶液,产生白色沉淀,且产生的沉淀量与加入
溶液,产生白色沉淀,且产生的沉淀量与加入 的物质的量之间的关系如图所示。则下列说法正确的是
的物质的量之间的关系如图所示。则下列说法正确的是
 、
、 、
、 、
、 、
、 、
、 、
、 、
、 中的几种。
中的几种。①若加入锌粒,产生无色无味的气体;②若加入
 溶液,产生白色沉淀,且产生的沉淀量与加入
溶液,产生白色沉淀,且产生的沉淀量与加入 的物质的量之间的关系如图所示。则下列说法正确的是
的物质的量之间的关系如图所示。则下列说法正确的是
A.溶液中的阳离子一定含有 、 、 、 、 ,可能含有 ,可能含有 |
B.溶液中一定不含 和 和 ,一定含有 ,一定含有 |
C.溶液中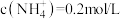 |
D.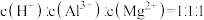 |
您最近一年使用:0次
2022-04-05更新
|
200次组卷
|
3卷引用:重庆市实验中学校2021-2022学年高三上学期11月月考化学试题
解题方法
10 . 从废旧磷酸铁锂电池正极材料(含 、铝箔、石墨粉等)中回收
、铝箔、石墨粉等)中回收 、
、 的工艺流程如下:
的工艺流程如下:

资料:
①碳酸锂及碳酸氢锂的溶解度随温度升高不断降低,杂质的溶解度相反。
②溴甲酚绿—甲基红是比甲基橙变色范围更小的指示剂, 以下为暗红色,
以下为暗红色,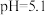 为灰绿色,
为灰绿色, 以上为绿色。
以上为绿色。
回答下列问题:
(1)“预处理”:旧电池拆解前进行放电处理有利于锂在正极的回收,其原因_______ 。
(2)“除铁”:向滤液1中加适量过氧化氢,得浅黄色溶液,滴入氢氧化钠,调节 ,搅拌1h后分离,得到固体沉淀铁黄(
,搅拌1h后分离,得到固体沉淀铁黄( )。除铁过程中发生反应的总离子反应方程式
)。除铁过程中发生反应的总离子反应方程式_______ ;检验浅黄色溶液中是否含 的操作是:
的操作是:_______ 。
(3)“沉锂”:向滤液2中加入饱和碳酸钠溶液沉锂。沉锂时的离子反应方程式为_______ ,得到碳酸锂沉淀的操作为_______ 。
a.静置,过滤b.加热后,趁热过滤c.蒸发浓缩、冷却结晶d.蒸发结晶
(4)“纯化”:选用碳化分解蒸发法纯化碳酸锂。机理如下:
碳化反应:
分解反应:

综合考虑,最适宜的碳化温度范围为_______ ,(“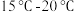 ”、“
”、“ ”、“
”、“ ”)。
”)。
解释二氧化碳流速一定时,碳酸锂回收率随温度升高而减小的原因:_______ 。
(5)碳酸锂纯度分析:取 碳酸锂产物配成
碳酸锂产物配成 溶液,取
溶液,取 于锥形瓶中,滴加溴甲酚绿-甲基红指示剂,用标定好的
于锥形瓶中,滴加溴甲酚绿-甲基红指示剂,用标定好的 的盐酸滴定。溶液由绿色变为暗红色时停止操作,煮沸
的盐酸滴定。溶液由绿色变为暗红色时停止操作,煮沸 ,冷却后继续滴定至暗红色,消耗盐酸
,冷却后继续滴定至暗红色,消耗盐酸 。实验中若不进行煮沸处理,则测定结果
。实验中若不进行煮沸处理,则测定结果_______ (“偏高”、“偏低”、“无影响”),计算样品纯度为_______ %(保留2位小数)。
 、铝箔、石墨粉等)中回收
、铝箔、石墨粉等)中回收 、
、 的工艺流程如下:
的工艺流程如下:
资料:
①碳酸锂及碳酸氢锂的溶解度随温度升高不断降低,杂质的溶解度相反。
②溴甲酚绿—甲基红是比甲基橙变色范围更小的指示剂,
 以下为暗红色,
以下为暗红色,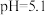 为灰绿色,
为灰绿色, 以上为绿色。
以上为绿色。回答下列问题:
(1)“预处理”:旧电池拆解前进行放电处理有利于锂在正极的回收,其原因
(2)“除铁”:向滤液1中加适量过氧化氢,得浅黄色溶液,滴入氢氧化钠,调节
 ,搅拌1h后分离,得到固体沉淀铁黄(
,搅拌1h后分离,得到固体沉淀铁黄( )。除铁过程中发生反应的总离子反应方程式
)。除铁过程中发生反应的总离子反应方程式 的操作是:
的操作是:(3)“沉锂”:向滤液2中加入饱和碳酸钠溶液沉锂。沉锂时的离子反应方程式为
a.静置,过滤b.加热后,趁热过滤c.蒸发浓缩、冷却结晶d.蒸发结晶
(4)“纯化”:选用碳化分解蒸发法纯化碳酸锂。机理如下:
碳化反应:

分解反应:


综合考虑,最适宜的碳化温度范围为
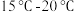 ”、“
”、“ ”、“
”、“ ”)。
”)。解释二氧化碳流速一定时,碳酸锂回收率随温度升高而减小的原因:
(5)碳酸锂纯度分析:取
 碳酸锂产物配成
碳酸锂产物配成 溶液,取
溶液,取 于锥形瓶中,滴加溴甲酚绿-甲基红指示剂,用标定好的
于锥形瓶中,滴加溴甲酚绿-甲基红指示剂,用标定好的 的盐酸滴定。溶液由绿色变为暗红色时停止操作,煮沸
的盐酸滴定。溶液由绿色变为暗红色时停止操作,煮沸 ,冷却后继续滴定至暗红色,消耗盐酸
,冷却后继续滴定至暗红色,消耗盐酸 。实验中若不进行煮沸处理,则测定结果
。实验中若不进行煮沸处理,则测定结果
您最近一年使用:0次



