名校
解题方法
1 . 不能鉴别Fe2+和Fe3+的是
| A.氯水 | B.盐酸 | C.氢氧化钠溶液 | D.硫氰化钾溶液 |
您最近一年使用:0次
2018-04-14更新
|
445次组卷
|
5卷引用:上海市闵行区2018届高三下学期质量调研(二模)化学试题
2 . 下列有关化学实验的操作或说法中,正确的是
| A.用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液中一定不含K+ |
| B.分液漏斗和容量瓶在使用前都要检漏 |
| C.向某溶液中加入稀盐酸,产生的气体能使澄清石灰水变浑浊,该溶液一定是碳酸盐溶液 |
| D.0.84g铁和50.00 mL 1.00 mol/L的稀硝酸反应,反应后溶液中一定只有Fe3+ |
您最近一年使用:0次
名校
3 . 下列关于物质结构和性质的叙述中正确的是
| A.用酸性KMnO4溶液可以检验绿矾(FeSO4·7H2O)是否变质 |
| B.非极性键只存在于双原子的单质分子(如Cl2)中 |
| C.在共价化合物分子内,可能存在离子键 |
| D.在氮原子中,质子数为7而中子数不一定为7 |
您最近一年使用:0次
2017-05-19更新
|
166次组卷
|
3卷引用:内蒙古鄂尔多斯市2017届高三模拟考试理综化学试题
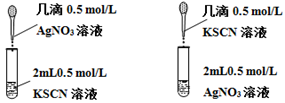
4 . 某小组为探究AgNO3溶液和不同类型盐溶液反应的多样性,设计如下实验:
已知:AgSCN为白色难溶物;(SCN)2与卤素单质性质相似,(SCN)2为有色物质。
(1)①中的白色沉淀是___________________ 。
(2)分离并洗涤①的沉淀,滴加0.5mol/L KI溶液,白色沉淀转变为黄色沉淀,用离子方程式解释上述变化____________________________ 。
(3)②中可能发生的离子反应有_________________ 。
(4)实验①的设计目的_______________________ 。
(5)对于③中红色褪去的原因及Ag+与SCN-反应的情况,小组进行以下分析和设计:
Ⅰ.甲同学认为,红色褪去的原因与平衡移动原理有关,解释为_________________ 。
Ⅱ.乙同学为了探究③中是否发生Ag+氧化SCN-的反应,又设计以下对比实验:
现象:生成白色沉淀,长时间观察,溶液和沉淀均未发生颜色改变。
Ⅲ.丙同学认为,理论上Ag+能够氧化SCN-,为证明其猜想,设计如下实验:
现象:电流计指针发生偏转,a电极上产生具有金属光泽的物质,b电极附近的溶液发生颜色变化。
丙同学的设计在证明氧化还原反应的优点是___________________________ 。
(6)通过以上探究,得出AgNO3溶液和不同类型盐溶液反应多样性的结论是______ 。

已知:AgSCN为白色难溶物;(SCN)2与卤素单质性质相似,(SCN)2为有色物质。
(1)①中的白色沉淀是
(2)分离并洗涤①的沉淀,滴加0.5mol/L KI溶液,白色沉淀转变为黄色沉淀,用离子方程式解释上述变化
(3)②中可能发生的离子反应有
(4)实验①的设计目的
(5)对于③中红色褪去的原因及Ag+与SCN-反应的情况,小组进行以下分析和设计:
Ⅰ.甲同学认为,红色褪去的原因与平衡移动原理有关,解释为
Ⅱ.乙同学为了探究③中是否发生Ag+氧化SCN-的反应,又设计以下对比实验:
现象:生成白色沉淀,长时间观察,溶液和沉淀均未发生颜色改变。
Ⅲ.丙同学认为,理论上Ag+能够氧化SCN-,为证明其猜想,设计如下实验:

现象:电流计指针发生偏转,a电极上产生具有金属光泽的物质,b电极附近的溶液发生颜色变化。
丙同学的设计在证明氧化还原反应的优点是
(6)通过以上探究,得出AgNO3溶液和不同类型盐溶液反应多样性的结论是
您最近一年使用:0次
名校
5 . 某实验小组探究少量Cl2和FeBr2反应的过程。
(1)配制FeBr2溶液:
ⅰ.配制50mL1.0mol/LFeBr2溶液;
ⅱ.上述溶液呈淡黄色。取少量此溶液,向其中滴入KSCN溶液,变为浅红色。
①配制50mL1.0mol/LFeBr2溶液需要的玻璃容器是________________ 。
②由ⅱ可知,此FeBr2溶液呈黄色的原因是其中含有________ ,用离子方程式解释产生其原因:_______ 。
(2)氯气和FeBr2反应实验操作及现象如下:
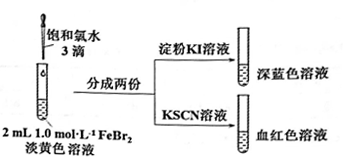
据此甲同学得出结论:少量Cl2既能和Fe2+又能和Br-发生氧化还原反应。
①Cl2和Fe2+发生反应的离子方程式是________________ 。
②乙同学认为上述实验不能证明Cl2和Br-发生反应,理由是_____________ 。
③乙同学改进实验如下:在上述FeBr2溶液中加入过量铁粉,取上清液2 mL,向其中滴加3滴饱和氯水后,再加入CCl4,振荡后静置,观察现象。乙得出结论:少量Cl2只与Fe2+反应,不与Br-反应。乙得出该结论依据的实验现象是____________________ 。
(3)丙同学继续设计实验,探究反应过程:
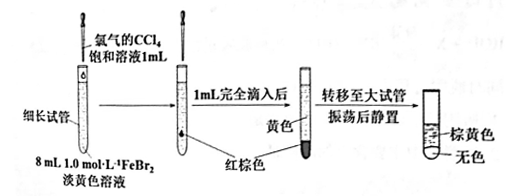
①转移到大试管前CCl4液体中呈红棕色的物质是___________ 。
②丙通过此实验可得出结论:________ 。
(1)配制FeBr2溶液:
ⅰ.配制50mL1.0mol/LFeBr2溶液;
ⅱ.上述溶液呈淡黄色。取少量此溶液,向其中滴入KSCN溶液,变为浅红色。
①配制50mL1.0mol/LFeBr2溶液需要的玻璃容器是
②由ⅱ可知,此FeBr2溶液呈黄色的原因是其中含有
(2)氯气和FeBr2反应实验操作及现象如下:

据此甲同学得出结论:少量Cl2既能和Fe2+又能和Br-发生氧化还原反应。
①Cl2和Fe2+发生反应的离子方程式是
②乙同学认为上述实验不能证明Cl2和Br-发生反应,理由是
③乙同学改进实验如下:在上述FeBr2溶液中加入过量铁粉,取上清液2 mL,向其中滴加3滴饱和氯水后,再加入CCl4,振荡后静置,观察现象。乙得出结论:少量Cl2只与Fe2+反应,不与Br-反应。乙得出该结论依据的实验现象是
(3)丙同学继续设计实验,探究反应过程:

①转移到大试管前CCl4液体中呈红棕色的物质是
②丙通过此实验可得出结论:
您最近一年使用:0次
2017-03-15更新
|
785次组卷
|
4卷引用:2017届北京市海淀区高三3月适应性考试(零模)理综化学试卷
2017届北京市海淀区高三3月适应性考试(零模)理综化学试卷2020届高考化学二轮复习大题精准训练——反应原理(历程)的探究式实验(已下线)专题6.2 实验综合题(必考)(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升北京市中央民族大学附属中学2022届高三9月月考化学试题
名校
解题方法
6 . 硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]是透明、浅蓝绿色晶体,易溶于水而不溶于酒精等有机溶剂,在空气中一般比较稳定,不易被氧化。制备步骤如下:
步骤1.称取还原铁粉0.4g,炭粉0.3g,放入50mL 锥形瓶中,加入3.5 mL2mol·L-1硫酸置于60℃ 热水浴中加热(如下左图),待反应完全,取出冷却,再加入6 mol·L-1的硫酸2 mL。
步骤2.在上述反应液中加入浓氨水0.8 mL,振荡混匀,抽滤(如上右图)。向滤液中加入10mL无水乙醇,静置,大量晶体析出,倾析,再次抽滤。
步骤3.取出晶体,用干净的滤纸吸干,称量并分析样品。
请回答下列问题:
(1)步骤1中炭粉的作用是_______ ,加入6 mol·L-1硫酸的作用是____________ 。
(2)向滤液中加入无水乙醇目的是_________________ 。
(3)产品中金属阳离子的检验方法及现象________________ 。
(4)称取获得的硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O](摩尔质量为392g·mol-1)1.9600 g 配成100mL溶液,取出20.00mL滴加稀H2SO4酸化后用0 . 0100 mol·L-1KMnO4标准溶液进行滴定,消耗KMnO4溶液为18.00mL 。
下列有关滴定的操作正确的是_(填字母编号)。
a.滴定过程中眼睛注视滴定管中液面变化
b.滴定完成后取下滴定管握住中部防止掉落
c.读数过程中保持滴定管自然悬垂
d.读数时视线与刻度线、凹液面最低处切线相平齐
滴定过程中反应离子方程式为____________ ,制得硫酸亚铁铵样品的纯度为__________ 。
步骤1.称取还原铁粉0.4g,炭粉0.3g,放入50mL 锥形瓶中,加入3.5 mL2mol·L-1硫酸置于60℃ 热水浴中加热(如下左图),待反应完全,取出冷却,再加入6 mol·L-1的硫酸2 mL。

步骤2.在上述反应液中加入浓氨水0.8 mL,振荡混匀,抽滤(如上右图)。向滤液中加入10mL无水乙醇,静置,大量晶体析出,倾析,再次抽滤。
步骤3.取出晶体,用干净的滤纸吸干,称量并分析样品。
请回答下列问题:
(1)步骤1中炭粉的作用是
(2)向滤液中加入无水乙醇目的是
(3)产品中金属阳离子的检验方法及现象
(4)称取获得的硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O](摩尔质量为392g·mol-1)1.9600 g 配成100mL溶液,取出20.00mL滴加稀H2SO4酸化后用0 . 0100 mol·L-1KMnO4标准溶液进行滴定,消耗KMnO4溶液为18.00mL 。
下列有关滴定的操作正确的是_(填字母编号)。
a.滴定过程中眼睛注视滴定管中液面变化
b.滴定完成后取下滴定管握住中部防止掉落
c.读数过程中保持滴定管自然悬垂
d.读数时视线与刻度线、凹液面最低处切线相平齐
滴定过程中反应离子方程式为
您最近一年使用:0次
2017-03-15更新
|
369次组卷
|
2卷引用:2017届安徽省“江南十校”高三3月联考理综化学试卷
7 . 已知还原性:SO32->I-。某溶液X可能含有NH4+、Na+、Ba2+、Fe3+、I-、SO32-、SO42-中的几种,为确定其组成,某同学进行如下实验:
下列说法正确的是

下列说法正确的是
| A.溶液X肯定只存在NH4+、SO42- |
| B.溶液X一定不含有Ba2+、Fe3+,可能含有I- |
| C.为确定可能存在的阴离子,可另取试液滴加足量盐酸、BaCl2溶液 |
| D.为确定可能存在的阳离子,可用经过稀硫酸洗过的铂丝蘸取溶液X在酒精灯火焰上灼烧 |
您最近一年使用:0次
2017-03-11更新
|
511次组卷
|
2卷引用:浙江省台州市2017届高三2月选考科目教学质量评估测试化学试题
8 . 某工厂的污水中可能含有NH4+、Fe2+、Cl-、Fe3+、SO42-、HCO3-离子中的一种或几种,为检验上述离子,某兴趣小组设计了如下实验方案,请回答下列问题:
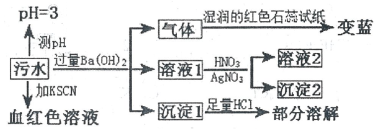
下列说法正确的是

下列说法正确的是
| A.该污水中一定存在Fe3+,不存在Fe2+ | B.沉淀l为BaCO3和BaSO4 |
| C.沉淀2可能为AgCl和Ag2SO4 | D.该污水中一定存在NH4+、Cl-、Fe3+、SO42-离子 |
您最近一年使用:0次
9 . 对于某些离子的检验及结论一定正确的是
| A.加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32— |
| B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42— |
| C.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ |
| D.加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ |
您最近一年使用:0次
2016-12-09更新
|
153次组卷
|
6卷引用:山东省临沂市第十九中学2019届高三上学期第三次质量调研考试化学试题
山东省临沂市第十九中学2019届高三上学期第三次质量调研考试化学试题(已下线)2010-2011学年福建省福州市八县(市)高一下学期期中联考化学试卷2015-2016学年广东省惠州市高一上学期期末质检化学试卷江苏省盐城市时杨中学2017-2018学年高二上学期期中考试(必修)化学试题【市级联考】浙江省台州市2018-2019学年高一下学期期中考试化学试题(已下线)【新东方】高中化学5036
14-15高三上·山西忻州·期中
名校
解题方法
10 . 在Na+浓度为0.5mol/L的某澄清溶液中,还可能含有下表中的若干种离子:
取该溶液100mL进行如下实验(气体体积在标准状况下测定):
试回答下列问题:
(1)实验I能确定一定不存在的阳离子是______________________ 。
(2)实验I中生成沉淀的离子方程式为________________________ 。
(3)通过实验I、Ⅱ、Ⅲ和必要计算,填写下表中阴离子的浓度(能计算出的,填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“不能确定”)
(4)判断K+是否存在,若存在求其最小浓度(若不存在说明理由)___________________ 。
| 阳离子 | K+、Ag+、Mg2+、Ba2+ |
| 阴离子 | NO3-、CO32-、SiO32-、SO42- |
| 序号 | 实验内容 | 实验结果 |
| Ⅰ | 向该溶液中加入足量稀HCl | 产生白色沉淀并放出0.56L气体 |
| Ⅱ | 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为2.4g |
| Ⅲ | 在Ⅱ的滤液中滴加BaC12溶液 | 无明显现象 |
(1)实验I能确定一定不存在的阳离子是
(2)实验I中生成沉淀的离子方程式为
(3)通过实验I、Ⅱ、Ⅲ和必要计算,填写下表中阴离子的浓度(能计算出的,填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“不能确定”)
| 阴离子 | NO3- | CO32- | SiO32- | SO42- |
| c/mol·L-1 | | | | |
您最近一年使用:0次
2016-12-09更新
|
780次组卷
|
21卷引用:云南省玉溪市第一中学2019届高三上学期第二次调研考试化学试题
云南省玉溪市第一中学2019届高三上学期第二次调研考试化学试题(已下线)2015届山西省忻州第一中学高三上学期期中考试化学试卷2015-2016学年山西阳泉十五中高三第一次阶段考试化学试卷2016届河南省宜阳县实验学校高三第二次月考化学试卷2015-2016学年黑龙江省大庆铁人中学高一上期末化学试卷2015-2016学年河北石家庄一中高一下学情反馈一化学卷2015-2016学年河南省南阳市宛东五校高一下第一次联考化学试卷陕西省西安中学2018届高三10月月考化学试题内蒙古巴彦淖尔市第一中学2018届高三9月月考理科综合化学试题陕西省西安中学2018届高三上学期期中考试化学试题江西省南昌市第二中学2017-2018学年高一上学期第三次月考化学试题(已下线)【中等生百日捷进提升系列-技能方法】专题18 以离子性质为基础的无机推断题2019届高三化学一轮练习卷:离子的检验与推断【全国校级联考】四川省眉山一中办学共同体2019届高三9月月考化学试题(已下线)2019高考备考一轮复习精品资料 第二章 化学物质及其变化 第2讲 离子反应和离子方程式【押题专练】甘肃省白银市会宁二中2019届高三上学期9月月考化学试题【全国百强校】山西省山西大学附属中学2019届高三上学期9月模块诊断化学试题(已下线)2019届高考热点题型和提分秘籍 第二章 化学物质及其变化 第2讲 离子反应 (题型专练)江西省遂川中学、吉安县中2017-2018学年高一上学期联考化学试题【全国百强校】吉林省实验中学2018-2019学年高一上学期期末考试化学试题【全国百强校】山西省山西大学附属中学2018-2019学年高一下学期2月模块诊断化学试题



