1 . 下列说法错误的是
| A.焰色反应实验前,铂丝应先用盐酸洗涤后灼烧至无色 |
| B.向某溶液中加入2滴KSCN溶液,溶液不显红色,再向溶液中滴几滴新制氯水,溶液变为血红色,该原溶液中一定含有Fe2+ |
C.加入BaCl2溶液,生成白色沉淀,加稀盐酸沉淀不消失,则原溶液中一定含有 |
| D.实验室制备氢氧化亚铁时,滴加氢氧化钠溶液的胶头滴管应伸入液面下 |
您最近一年使用:0次
名校
2 . 已知1L某待测液中除含有0.2mol·L-1的Na+外,还可能含有下列离子中的一种或几种:
现进行如下实验操作(每次实验所加试剂均过量):
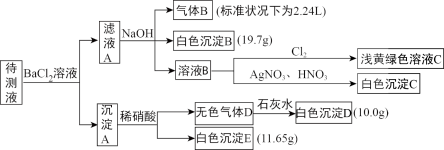
已知:NaHCO3+NaOH=Na2CO3+H2O
(1)由气体B可确定待测液中含有的离子是___________ 。
(2)由沉淀D和沉淀E可以判断待测液中一定含有的离子是___________ ,据此可以排除的离子是___________ 。
(3)由白色沉淀B可确定待测液中含有的离子是___________ 。
(4)某同学读图后,认为待测液中一定不含溴离子,他判断的依据是___________ 。
(5)综合分析,待测液中K+的最小浓度为___________ 。
| 阳离子 | K+、NH 、Mg2+、Ba2+、Fe3+ 、Mg2+、Ba2+、Fe3+ |
| 阴离子 | Cl-、Br-、CO 、HCO 、HCO 、SO 、SO |

已知:NaHCO3+NaOH=Na2CO3+H2O
(1)由气体B可确定待测液中含有的离子是
(2)由沉淀D和沉淀E可以判断待测液中一定含有的离子是
(3)由白色沉淀B可确定待测液中含有的离子是
(4)某同学读图后,认为待测液中一定不含溴离子,他判断的依据是
(5)综合分析,待测液中K+的最小浓度为
您最近一年使用:0次
2021-01-06更新
|
368次组卷
|
7卷引用:山西省实验中学2018届高三上学期学业质量监测化学试题
山西省实验中学2018届高三上学期学业质量监测化学试题陕西省西安市长安区第一中学2020-2021学年高一上学期第二次月考化学试题青海省湟川中学2020-2021学年高一下学期开学考试化学试题河北省辛集市高中2020-2021学年高二下学期期中考试化学试题(已下线)专题五 物质的量(B卷)-2021-2022学年高一化学优选好题单元专题双测卷(人教版2019必修第一册)吉林省长春市第五中学2022-2023学年高二下学期第三学程(期末)化学试题吉林省长春市实验中学2022-2023学年高二下学期期末考试化学试题
3 . 下列关于常见离子的检验方法和结论,其中正确的是
| A.加入AgNO3溶液,有白色沉淀生成,证明原溶液一定有Cl− |
B.先加入BaCl2溶液,有白色沉淀生成,再加入稀盐酸沉淀不溶解,证明原溶液一定有SO |
| C.先加入KSCN溶液,无现象,再加氯水后溶液变红,证明原溶液一定有Fe2+ |
| D.加入KSCN溶液变红,证明原溶液一定有Fe3+,一定没有Fe2+ |
您最近一年使用:0次
2021-01-06更新
|
174次组卷
|
3卷引用:安徽省砀山县第二中学2020-2021学年高一上学期第二次月考化学试题
4 . 以含钴废催化剂(主要成分为Co、Fe、SiO2)为原料制取复合氧化钴的流程如下:
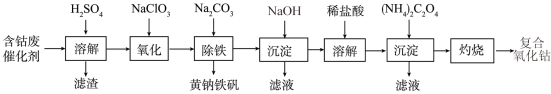
(1)用H2SO4溶解后过滤,得到的滤渣是____ (填化学式)。将滤渣洗涤2~3次,再将洗液与滤液合并的目的是_________________________________ 。
(2)在加热搅拌条件下加入NaClO3,将Fe2+氧化成Fe3+,反应的离子方程式是__________ 。
(3)已知:铁氰化钾的化学式为K3[Fe(CN)6];亚铁氰化钾的化学式为K4[Fe(CN)6]。
3Fe2++2[Fe(CN)6]3− =Fe3[Fe(CN)6]2↓(蓝色沉淀)
4Fe3++3[Fe(CN)6]4− = Fe4[Fe(CN)6]3↓(蓝色沉淀)
确定Fe2+是否氧化完全的方法是_________________________________ 。(仅供选择的试剂:铁氰化钾溶液、亚铁氰化钾溶液、铁粉、KSCN溶液)
(4)已知CoCl2的溶解度曲线如图所示。
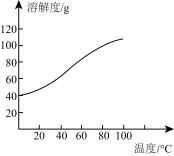
向碱式碳酸钴沉淀中加入足量稀盐酸边加热边搅拌至完全溶解后,需趁热过滤的原因是_________________ 。

(1)用H2SO4溶解后过滤,得到的滤渣是
(2)在加热搅拌条件下加入NaClO3,将Fe2+氧化成Fe3+,反应的离子方程式是
(3)已知:铁氰化钾的化学式为K3[Fe(CN)6];亚铁氰化钾的化学式为K4[Fe(CN)6]。
3Fe2++2[Fe(CN)6]3− =Fe3[Fe(CN)6]2↓(蓝色沉淀)
4Fe3++3[Fe(CN)6]4− = Fe4[Fe(CN)6]3↓(蓝色沉淀)
确定Fe2+是否氧化完全的方法是
(4)已知CoCl2的溶解度曲线如图所示。

向碱式碳酸钴沉淀中加入足量稀盐酸边加热边搅拌至完全溶解后,需趁热过滤的原因是
您最近一年使用:0次
5 . 侯德榜将氨碱法制取碳酸钠和合成氨联合起来,将制碱技术发展到新的水平。氨碱法的反应原理为NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl,过滤所得NaHCO3可用于制纯碱。现对过滤所得滤液进行如下实验,所得结论正确的是
| A.用铂丝蘸取少量滤液进行焰色反应,观察到火焰呈黄色,说明滤液中含有Na+ |
B.取少量滤液于试管中,加热试管,将湿润的红色石蕊试纸置于试管口,试纸未变蓝,说明滤液中不含 |
| C.取少量滤液,向其中加入足量稀盐酸,再加入硝酸银溶液,观察到有白色沉淀生成,说明滤液中含有Cl- |
D.取少量滤液,向其中加入适量澄清石灰水,观察到有白色沉淀生成,说明滤液中含有 |
您最近一年使用:0次
2020-12-14更新
|
628次组卷
|
10卷引用:江苏省如皋中学2020-2021学年高二上学期教学质量调研(二)化学(选修)试题
(已下线)江苏省如皋中学2020-2021学年高二上学期教学质量调研(二)化学(选修)试题(已下线)解密11 化学实验(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密11 化学实验(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)江苏省如皋市2020-2021学年高一下学期第三次调研考试化学(必)试题(已下线)课时08 离子检验与推断-2022年高考化学一轮复习小题多维练(全国通用)(已下线)专题16 基础化学实验-2022年高考化学二轮复习重点专题常考点突破练(已下线)考点50 物质的分离、提纯和检验-备战2023年高考化学一轮复习考点帮(全国通用)浙江省吴兴高级中学2021-2022学年高一下学期学考模拟化学试题 (已下线)第3讲 离子反应的应用(离子共存、离子检验和推断)(已下线)江苏省南通市如皋市2022-2023学年高一下学期5月期中考试化学试题
6 . 现只用一种试剂(可以加热)鉴别 NH4Cl、(NH4)2SO4、K2SO4、 NaCl四种无色溶液,该试剂是
| A.AgNO3溶液 | B.BaCl2溶液 | C.Ba(OH)2溶液 | D.NaOH溶液 |
您最近一年使用:0次
2020-12-14更新
|
282次组卷
|
6卷引用:福建省长泰县第一中学2020-2021学年高一上学期11月考试化学试题
7 . 下列说法中,正确的是
| A.某物质的焰色试验中,火焰呈黄色,则该物质中一定不含有钾元素 |
| B.为除去FeCl2中的FeCl3杂质,可通过加入过量Fe粉,充分反应后过滤可除杂 |
| C.向某溶液滴入AgNO3溶液,产生白色沉淀,则原溶液中一定存在Cl- |
| D.向某溶液中滴入氯水后,再滴入KSCN溶液,溶液变红,则原溶液中一定含有Fe2+ |
您最近一年使用:0次
名校
解题方法
8 . 某无色溶液只可能含有下列离子Na+、Ba2+、Cu2+、CO 、Cl﹣、Mg2+中的某些离子。①向此溶液中滴加稀盐酸无明显现象。②取少量①的溶液并加入少量的Na2SO4溶液,有白色沉淀产生。③取②的上层清液并加入过量的NaOH溶液,无明显现象。
、Cl﹣、Mg2+中的某些离子。①向此溶液中滴加稀盐酸无明显现象。②取少量①的溶液并加入少量的Na2SO4溶液,有白色沉淀产生。③取②的上层清液并加入过量的NaOH溶液,无明显现象。
(1)应最先判断出溶液中一定不含有哪种离子______ ,说明判断的理由____________ 。由步骤①可判断原溶液中一定不含有的离子是______ ,说明判断的理由____________ 。
(2)②中反应的离子方程式为________ 。不能确定是否含有的离子是______ 。
 、Cl﹣、Mg2+中的某些离子。①向此溶液中滴加稀盐酸无明显现象。②取少量①的溶液并加入少量的Na2SO4溶液,有白色沉淀产生。③取②的上层清液并加入过量的NaOH溶液,无明显现象。
、Cl﹣、Mg2+中的某些离子。①向此溶液中滴加稀盐酸无明显现象。②取少量①的溶液并加入少量的Na2SO4溶液,有白色沉淀产生。③取②的上层清液并加入过量的NaOH溶液,无明显现象。(1)应最先判断出溶液中一定不含有哪种离子
(2)②中反应的离子方程式为
您最近一年使用:0次
2020-12-03更新
|
101次组卷
|
2卷引用:青海省西宁市海湖中学2020-2021学年高一上学期第二次阶段考试化学试题
名校
9 . 某学习小组欲检测一失去标签的试剂瓶中固体物质的成分,将固体溶于水,形成的溶液中含有Na+、NH 、Mg2+、Fe2+、SO
、Mg2+、Fe2+、SO 、MnO
、MnO 、CO
、CO 、SO
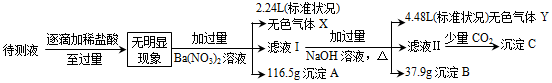
、SO 中的若干种,取一定量待测液进行如下实验:
中的若干种,取一定量待测液进行如下实验:
回答下列问题:
(1)该待测液中一定含有的离子是________ ;无法确定是否含有的离子是_______ ;
(2)沉淀B的成分及物质的量为___________________ (物质写化学式)。
(3)生成无色气体X时的离子方程式为________________ 。
(4)生成沉淀C时的离子反应方程式为________________ 。
(5)在催化剂、加热条件下气体X与气体Y可以反应转化为对环境无害的物质,该反应的化学方程式为__________ ,所得氧化产物与还原产物的质量之比为_________ 。
 、Mg2+、Fe2+、SO
、Mg2+、Fe2+、SO 、MnO
、MnO 、CO
、CO 、SO
、SO 中的若干种,取一定量待测液进行如下实验:
中的若干种,取一定量待测液进行如下实验:
回答下列问题:
(1)该待测液中一定含有的离子是
(2)沉淀B的成分及物质的量为
(3)生成无色气体X时的离子方程式为
(4)生成沉淀C时的离子反应方程式为
(5)在催化剂、加热条件下气体X与气体Y可以反应转化为对环境无害的物质,该反应的化学方程式为
您最近一年使用:0次
2020-12-02更新
|
265次组卷
|
4卷引用:山东省威海市威海文登区2021届高三上学期期中考试化学试题
山东省威海市威海文登区2021届高三上学期期中考试化学试题(已下线)解密04 离子反应(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密04 离子反应(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)吉林省吉化第一高级中学校2021-2022学年高二下学期复课检测化学试题
名校
10 . X溶液中可能含有下列8种离子中的几种:Fe3+、Fe2+、Na+、NH 、CO
、CO 、Cl−、SO
、Cl−、SO 、SO
、SO 。某同学为确定其成分,设计并完成以下实验(已知:Fe3+与SCN−呈血红色,且不考虑水解,所加试剂均足量):
。某同学为确定其成分,设计并完成以下实验(已知:Fe3+与SCN−呈血红色,且不考虑水解,所加试剂均足量):
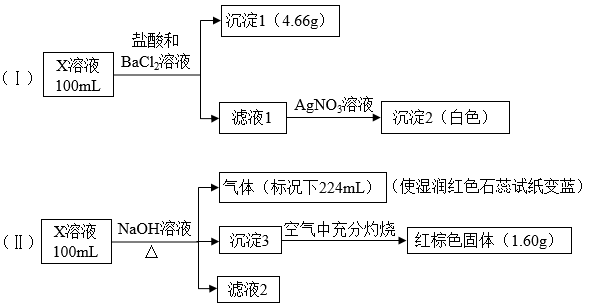
下列说法正确的是
 、CO
、CO 、Cl−、SO
、Cl−、SO 、SO
、SO 。某同学为确定其成分,设计并完成以下实验(已知:Fe3+与SCN−呈血红色,且不考虑水解,所加试剂均足量):
。某同学为确定其成分,设计并完成以下实验(已知:Fe3+与SCN−呈血红色,且不考虑水解,所加试剂均足量):
下列说法正确的是
A.X溶液中一定存在Na+、SO 、SO 、SO 、CO 、CO |
B.X溶液中一定存在NH 、Na+、SO 、Na+、SO ,至少含有Fe3+、Fe2+离子中的一种 ,至少含有Fe3+、Fe2+离子中的一种 |
| C.取少量X溶液,先加入适量氯水,再加少量KSCN溶液,若溶液呈血红色,则含有Fe2+ |
D.X溶液中一定含有Cl−,且c(Cl−) 0.1mol·L−1 0.1mol·L−1 |
您最近一年使用:0次
2020-11-29更新
|
662次组卷
|
2卷引用:安徽省安庆市第一中学2020-2021学年高一上学期期中考试化学试题



