1 . 二氧化氯 是目前国际上公认的第四代高效、无毒的广谱消毒剂,是一种黄绿色气体,易溶于水,浓度过大时易发生分解爆炸。近来有学者发现使用复合法
是目前国际上公认的第四代高效、无毒的广谱消毒剂,是一种黄绿色气体,易溶于水,浓度过大时易发生分解爆炸。近来有学者发现使用复合法 发生器进行消毒的水中含有中等毒性的
发生器进行消毒的水中含有中等毒性的 ,进一步研究表明
,进一步研究表明 是由于
是由于 制备过程中未完全反应的
制备过程中未完全反应的 原料液进入水体引起的。实验室模拟复合法二氧化氯发生器反应工艺,探索反应温度对氯酸盐残留量的影响。实验原理:
原料液进入水体引起的。实验室模拟复合法二氧化氯发生器反应工艺,探索反应温度对氯酸盐残留量的影响。实验原理: 溶液(质量分数33.3%)与盐酸溶液(HCl质量分数
溶液(质量分数33.3%)与盐酸溶液(HCl质量分数 )经计量泵按1∶1比例进入反应残液一同混合形成二氧化氯复合消毒液模拟实验装置:
)经计量泵按1∶1比例进入反应残液一同混合形成二氧化氯复合消毒液模拟实验装置:
ⅰ.将 溶液与盐酸溶液按1∶1比例加入烧瓶1中,产生黄绿色气体后通入高纯
溶液与盐酸溶液按1∶1比例加入烧瓶1中,产生黄绿色气体后通入高纯 ;
;
ⅱ.反应90分钟,将5个口瓶内的液体和烧瓶内的反应残液一同倒入一个棕色广口瓶内,形成浓度均匀的复合二氧化氯消毒液;
ⅲ.分别在反应温度20℃、30℃、40℃、50℃、60℃、70℃、80℃、90℃重复上述过程;
ⅳ.测试复合二氧化氯消毒液中各组分浓度,收集整理数据。
(1)用来滴加反应液的仪器名称:______ ;为确保实验准确性,控制反应温度,发生装置选择的加热方式:______ 。
(2)烧瓶1中反应的化学方程式:____________ 。
(3)若已知所用盐酸的密度是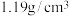 ,则盐酸的浓度是:
,则盐酸的浓度是:____________ 。
(4)通入高纯 的作用:
的作用:____________ 。
(5) 转化率及
转化率及 产率随温度的变化如图,据图可知,随反应温度的提高,氯酸盐残留量
产率随温度的变化如图,据图可知,随反应温度的提高,氯酸盐残留量______ (填“升高”或“降低”);改变反应时间,重复实验, 产率随温度变化趋势均如图所示,不考虑有副反应发生,试分析90℃时
产率随温度变化趋势均如图所示,不考虑有副反应发生,试分析90℃时 产率降低的可能原因
产率降低的可能原因____________ 。 等金属离子,还可杀菌消毒,下列与二氧化氯杀菌消毒原理一致的是
等金属离子,还可杀菌消毒,下列与二氧化氯杀菌消毒原理一致的是______ 。
a.臭氧浴足盆 b.酒精消毒 c.明矾净水
 是目前国际上公认的第四代高效、无毒的广谱消毒剂,是一种黄绿色气体,易溶于水,浓度过大时易发生分解爆炸。近来有学者发现使用复合法
是目前国际上公认的第四代高效、无毒的广谱消毒剂,是一种黄绿色气体,易溶于水,浓度过大时易发生分解爆炸。近来有学者发现使用复合法 发生器进行消毒的水中含有中等毒性的
发生器进行消毒的水中含有中等毒性的 ,进一步研究表明
,进一步研究表明 是由于
是由于 制备过程中未完全反应的
制备过程中未完全反应的 原料液进入水体引起的。实验室模拟复合法二氧化氯发生器反应工艺,探索反应温度对氯酸盐残留量的影响。实验原理:
原料液进入水体引起的。实验室模拟复合法二氧化氯发生器反应工艺,探索反应温度对氯酸盐残留量的影响。实验原理: 溶液(质量分数33.3%)与盐酸溶液(HCl质量分数
溶液(质量分数33.3%)与盐酸溶液(HCl质量分数 )经计量泵按1∶1比例进入反应残液一同混合形成二氧化氯复合消毒液模拟实验装置:
)经计量泵按1∶1比例进入反应残液一同混合形成二氧化氯复合消毒液模拟实验装置: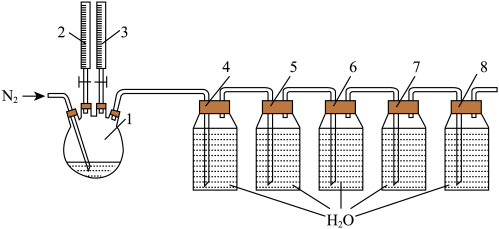
ⅰ.将
 溶液与盐酸溶液按1∶1比例加入烧瓶1中,产生黄绿色气体后通入高纯
溶液与盐酸溶液按1∶1比例加入烧瓶1中,产生黄绿色气体后通入高纯 ;
;ⅱ.反应90分钟,将5个口瓶内的液体和烧瓶内的反应残液一同倒入一个棕色广口瓶内,形成浓度均匀的复合二氧化氯消毒液;
ⅲ.分别在反应温度20℃、30℃、40℃、50℃、60℃、70℃、80℃、90℃重复上述过程;
ⅳ.测试复合二氧化氯消毒液中各组分浓度,收集整理数据。
(1)用来滴加反应液的仪器名称:
(2)烧瓶1中反应的化学方程式:
(3)若已知所用盐酸的密度是
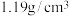 ,则盐酸的浓度是:
,则盐酸的浓度是:(4)通入高纯
 的作用:
的作用:(5)
 转化率及
转化率及 产率随温度的变化如图,据图可知,随反应温度的提高,氯酸盐残留量
产率随温度的变化如图,据图可知,随反应温度的提高,氯酸盐残留量 产率随温度变化趋势均如图所示,不考虑有副反应发生,试分析90℃时
产率随温度变化趋势均如图所示,不考虑有副反应发生,试分析90℃时 产率降低的可能原因
产率降低的可能原因
 等金属离子,还可杀菌消毒,下列与二氧化氯杀菌消毒原理一致的是
等金属离子,还可杀菌消毒,下列与二氧化氯杀菌消毒原理一致的是a.臭氧浴足盆 b.酒精消毒 c.明矾净水
您最近一年使用:0次
解题方法
2 . 某食品膨松剂起作用物质为NaHCO3,某兴趣小组研究加热情况下该膨松剂放出气体的量,设计实验的装置图如图。
(1)A装置中NaOH溶液的作用是除去空气中的_______ ,C装置内所盛试剂是_______ ,E装置的作用是_______ ,若没有E装置,测定的结果_______ (填“偏高”、“偏低”或“无影响”)。
(2)分解产物Na2CO3是重要化工原料,研究其性质:分别取少量Na2CO3溶液。
①与碱反应:滴加澄清石灰水,现象为_______ 。
②与盐反应:滴加X溶液,产生白色沉淀,则X可能为_______ (写其中一种的名称)。
③与酸反应:滴加盐酸,开始没有气泡,反应产生两种盐,推测两种盐的化学式_______ 。
(3)取a克Na2CO3与NaHCO3混合物进行下列三组实验,其中能测定Na2CO3质量分数的是_______ (填序号)。
A.充分加热,质量减少b克
B.与足量稀盐酸充分反应,加热、蒸干,灼烧,得b克固体
C.与足量稀硫酸充分反应,逸出气体用氯化钙吸收,增重b克
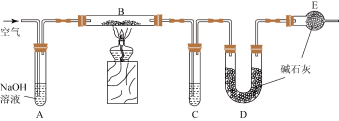
(1)A装置中NaOH溶液的作用是除去空气中的
(2)分解产物Na2CO3是重要化工原料,研究其性质:分别取少量Na2CO3溶液。
①与碱反应:滴加澄清石灰水,现象为
②与盐反应:滴加X溶液,产生白色沉淀,则X可能为
③与酸反应:滴加盐酸,开始没有气泡,反应产生两种盐,推测两种盐的化学式
(3)取a克Na2CO3与NaHCO3混合物进行下列三组实验,其中能测定Na2CO3质量分数的是
A.充分加热,质量减少b克
B.与足量稀盐酸充分反应,加热、蒸干,灼烧,得b克固体
C.与足量稀硫酸充分反应,逸出气体用氯化钙吸收,增重b克
您最近一年使用:0次
名校
3 . 某食品膨松剂作用物质为NaHCO3,某兴趣小组研究加热情况下该膨松剂放出气体的量,设计实验的装置图如下。
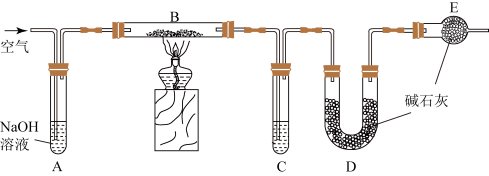
已知:碱石灰是固体氢氧化钠和氧化钙的混合物;2NaHCO3 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
回答下列问题:
(1)A装置中NaOH溶液的作用是除去空气中的_______ ,C装置内所盛试剂是_______ ,E装置的作用是_______ ,若没有E装置,测定的结果_______ (填“偏高”、“偏低”或“无影响”);若没有A装置,B装置左侧用橡皮塞封闭,实验结果将_______ (填“偏高”、“偏低”或“无影响”)。
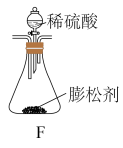
(2)充分加热后,测得D的质量增加6.6g,若装置B换为装置F进行实验(膨松剂质量相同)。不考虑导致误差因素,则测得D的质量增加_______ 。
(3)分解产物Na2CO3是重要化工原料,研究其性质:分别取少量NaCO3溶液,
①与碱反应:滴加澄清石灰水,现象为_______ ,
②与盐反应:滴加X溶液,产生白色沉淀,则X可能为_______ (写其中一种的名称)。
③与酸反应:滴加盐酸,开始没有气泡,反应产生两种盐,推测两种盐的化学式_______ ;
(4)取a克Na2CO3与NaHCO3混合物进行下列三组实验,其中能测定Na2CO3质量分数的是_______ (填序号)。
A.充分加热,质量减少b克
B.与足量稀盐酸充分反应,加热、蒸干,灼烧,得b克固体
C.与足量稀硫酸充分反应,逸出气体用氯化钙吸收,增重b克
任选上述合理方案中的一种,计算Na2CO3的质量分数为_______ 。


已知:碱石灰是固体氢氧化钠和氧化钙的混合物;2NaHCO3
 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑回答下列问题:
(1)A装置中NaOH溶液的作用是除去空气中的
(2)充分加热后,测得D的质量增加6.6g,若装置B换为装置F进行实验(膨松剂质量相同)。不考虑导致误差因素,则测得D的质量增加
(3)分解产物Na2CO3是重要化工原料,研究其性质:分别取少量NaCO3溶液,
①与碱反应:滴加澄清石灰水,现象为
②与盐反应:滴加X溶液,产生白色沉淀,则X可能为
③与酸反应:滴加盐酸,开始没有气泡,反应产生两种盐,推测两种盐的化学式
(4)取a克Na2CO3与NaHCO3混合物进行下列三组实验,其中能测定Na2CO3质量分数的是
A.充分加热,质量减少b克
B.与足量稀盐酸充分反应,加热、蒸干,灼烧,得b克固体
C.与足量稀硫酸充分反应,逸出气体用氯化钙吸收,增重b克
任选上述合理方案中的一种,计算Na2CO3的质量分数为
您最近一年使用:0次
2023-06-08更新
|
587次组卷
|
6卷引用:四川省眉山市仁寿第一中学校南校区2023-2024学年高一上学期开学化学试题
四川省眉山市仁寿第一中学校南校区2023-2024学年高一上学期开学化学试题广东省佛山市南海区2022-2023学年高一上学期初高衔接学习素养测试化学试题浙江省东阳市横店高级中学2022-2023学年高一上学期10月份检测化学试题广东省惠州市实验中学2022-2023学年高一上学期期中考试化学试题(已下线)期中测试卷一【测试范围:第一、二章】-2023-2024学年高一化学上学期期中考点大串讲(人教版2019必修第一册)江西省南昌市第一中学2023-2024学年高一上学期11月期中考试化学试题
4 .  、
、 等均为大气污染物,需处理后才能排放。
等均为大气污染物,需处理后才能排放。
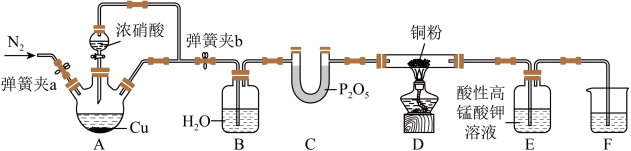
I.某研究性小组探究NO与炽热的铜粉反应,设计如下: ,
, 被还原成Mn2+。
被还原成Mn2+。
(1)实验开始前,检查装置气密性涉及以下操作:将F中的长导管插入液面以下→___________→___________→___________→___________→______________________ (操作可重复使用)。(填序号)
①关闭弹簧夹a,打开弹簧夹b ②观察F中的现象
③用酒精灯加热A中三颈烧瓶 ④撤走酒精灯
(2)装置B的作用为___________ ,实验结束时需通一段时间的N2,目的是___________ 。
(3)反应一段时间后,装置D中铜粉变黑,写出发生反应的化学方程式___________ 。
(4)实验过程中,装置E中溶液颜色变浅,则装置E发生的离子方程式为___________ 。
II.煤的洁净技术(包括固硫技术和脱硫技术)可有效降低燃煤废气中SO2的含量,通过加入固硫剂,将硫元素以固体形式留在煤燃烧的残渣中。
(5)生石灰是常用的固硫剂,SO2与生石灰反应将转化成___________ ;用碱液吸收SO2也是一种常用的脱硫方法,用1L 1.0 mol/L NaOH溶液吸收0.8mol SO2,所得溶液中的SO 和HSO
和HSO 的物质的量浓度之比是
的物质的量浓度之比是___________ 。
 、
、 等均为大气污染物,需处理后才能排放。
等均为大气污染物,需处理后才能排放。I.某研究性小组探究NO与炽热的铜粉反应,设计如下:
 ,
, 被还原成Mn2+。
被还原成Mn2+。(1)实验开始前,检查装置气密性涉及以下操作:将F中的长导管插入液面以下→___________→___________→___________→___________→___________
①关闭弹簧夹a,打开弹簧夹b ②观察F中的现象
③用酒精灯加热A中三颈烧瓶 ④撤走酒精灯
(2)装置B的作用为
(3)反应一段时间后,装置D中铜粉变黑,写出发生反应的化学方程式
(4)实验过程中,装置E中溶液颜色变浅,则装置E发生的离子方程式为
II.煤的洁净技术(包括固硫技术和脱硫技术)可有效降低燃煤废气中SO2的含量,通过加入固硫剂,将硫元素以固体形式留在煤燃烧的残渣中。
(5)生石灰是常用的固硫剂,SO2与生石灰反应将转化成
 和HSO
和HSO 的物质的量浓度之比是
的物质的量浓度之比是
您最近一年使用:0次
2023-10-01更新
|
418次组卷
|
3卷引用:四川省南充市嘉陵第一中学2022-2023学年高一下学期3月月考化学试题
名校
解题方法
5 . 某小组同学欲研究 及
及 的性质。
的性质。
(1)将相关的含硫物质分为如下表所示3组,第2组中物质X的化学式是____________ 。
(2)实验室通常用______试剂检验 。
。
(3)利用如图所示的装置研究 的性质:(熔点:
的性质:(熔点: -
-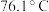 ,
,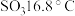 ;沸点:
;沸点: -
- ,
,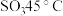 )
)
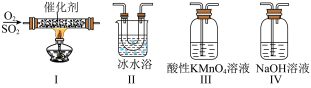
①装置I模拟工业生产中 催化氧化的反应,其化学方程式是
催化氧化的反应,其化学方程式是____________ 。
②甲同学按I、II、III、IV的顺序连接装置,装置II的作用是____________ ;装置III中溶液逐渐褪色,则该反应的离子方程式是____________ 。
③乙同学按I、II、IV的顺序连接装置,若装置Ⅳ中有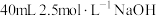 溶液,反应后增重4.8g,则装置IV中发生总反应的化学方程式
溶液,反应后增重4.8g,则装置IV中发生总反应的化学方程式____________ 。
(4)已知 溶液与
溶液与 反应时,
反应时,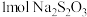 转移
转移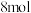 电子。该反应的离子方程式是
电子。该反应的离子方程式是_____ 。
(5)该实验小组的学生丁用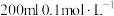 酸性
酸性 溶液测定空气中
溶液测定空气中 含量,若气体流速为
含量,若气体流速为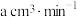 ,当时间为
,当时间为 时酸性
时酸性 溶液恰好褪色,则空气中
溶液恰好褪色,则空气中 的含量为
的含量为___ ( )。
)。
 及
及 的性质。
的性质。(1)将相关的含硫物质分为如下表所示3组,第2组中物质X的化学式是
第1组 | 第2组 | 第3组 |
S(单质) |
|
|
 。
。| A.紫色石蕊 | B.品红 | C.酚酞 | D.高锰酸钾 |
 的性质:(熔点:
的性质:(熔点: -
-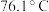 ,
,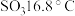 ;沸点:
;沸点: -
- ,
,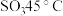 )
)
①装置I模拟工业生产中
 催化氧化的反应,其化学方程式是
催化氧化的反应,其化学方程式是②甲同学按I、II、III、IV的顺序连接装置,装置II的作用是
③乙同学按I、II、IV的顺序连接装置,若装置Ⅳ中有
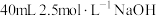 溶液,反应后增重4.8g,则装置IV中发生总反应的化学方程式
溶液,反应后增重4.8g,则装置IV中发生总反应的化学方程式(4)已知
 溶液与
溶液与 反应时,
反应时,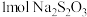 转移
转移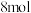 电子。该反应的离子方程式是
电子。该反应的离子方程式是(5)该实验小组的学生丁用
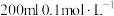 酸性
酸性 溶液测定空气中
溶液测定空气中 含量,若气体流速为
含量,若气体流速为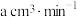 ,当时间为
,当时间为 时酸性
时酸性 溶液恰好褪色,则空气中
溶液恰好褪色,则空气中 的含量为
的含量为 )。
)。
您最近一年使用:0次
名校
解题方法
6 . 某化学小组为探究SO2的性质,按如图所示装置进行实验。请回答下列问题:
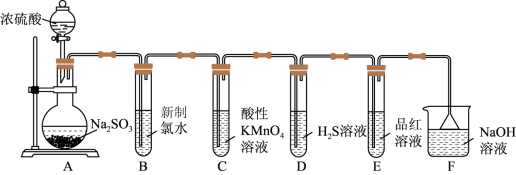
(1)装置A中盛放浓硫酸和亚硫酸钠的仪器名称分别是_______ 、_______ 。
(2)反应后,装置B中产生的现象是_______ ,发生反应的离子方程式为_______ 。
(3)装置C中的现象是_______ ,表现了SO2的_______ ;装置D中的现象是_______ ,发生反应的化学方程式为_______ 。
(4)装置F的作用是_______ ,倒扣漏斗的作用是_______ 。
II.他们拟用下列方法测定空气中SO2含量(假设空气中无其他还原性气体)。
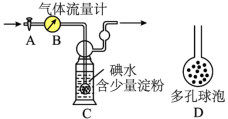
(5)洗气瓶C中导管末端连接一个多孔球泡D,可以提高实验准确度,原因是_______ 。
(6)实验过程中,若C中溶液蓝色消失后没有及时关闭活塞A,则测得的SO2含量会_______ (填“偏高”、“偏低”或“无影响”)。

(1)装置A中盛放浓硫酸和亚硫酸钠的仪器名称分别是
(2)反应后,装置B中产生的现象是
(3)装置C中的现象是
(4)装置F的作用是
II.他们拟用下列方法测定空气中SO2含量(假设空气中无其他还原性气体)。

(5)洗气瓶C中导管末端连接一个多孔球泡D,可以提高实验准确度,原因是
(6)实验过程中,若C中溶液蓝色消失后没有及时关闭活塞A,则测得的SO2含量会
您最近一年使用:0次
7 . 碳粉、CO、H2均可作为实验室还原CuO的还原剂,实验小组对CuO的还原反应及还原产物组成进行探究。
查阅资料:
I .CuO还原反应中相关信息如表所示:
II .CuO高温分解生成Cu2O,Cu2O+2H+=Cu+Cu2++H2O;
II .PdCl2溶液能吸收CO,生成黑色Pd沉淀和一种氢化物、一种氧化物。
回答下列问题:
(1)实验室还原CuO适宜选用的还原剂为_______ ,理由为_______ 。
(2)小组同学用如图所示装置探究碳粉与CuO反应的产物。

①仪器a的名称为_______ 。
②试剂X的作用为_______ 。
③若气体产物中含有CO,则观察到的现象为_______ ;其中反应的化学方程式为_______ 。
(3)某小组同学为测定碳粉还原CuO后固体混合物中单质Cu的质量分数,设计如下实验:准确称取反应管中残留固体8.000g,溶于足量稀硝酸,过滤、洗涤、干燥,所得沉淀的质量为0.160 g;将洗涤液与滤液合并,配成500mL溶液;量取所配溶液25.00mL,加入适当过量的KI溶液;以淀粉为指示剂,用0.500 0 mol·L-1 Na2S2O3标准溶液滴定,达到滴定终点时,消耗标准溶液的体积为12.00mL。已知:2Cu2++5I-=2CuI↓+ ,
, +2
+2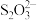 =
=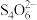 +3I-。
+3I-。
①溶解样品时,不能用稀硫酸代替稀硝酸的原因为_______ .。
②通过计算说明还原产物中是否含有Cu2O:_______ 。
③若CuI吸附部分 ,会导致所测Cu单质的质量分数
,会导致所测Cu单质的质量分数_______ .(填“偏大”“偏小”或“无影响”)。
查阅资料:
I .CuO还原反应中相关信息如表所示:
| 还原剂 | 反应温度/℃ | 产物性状 |
| 碳粉 | >800 | 可能混有砖红色固体或黑色固体 |
| CO | >500 | 可能混有砖红色固体 |
| H2 | 300左右 | 紫红色固体 |
II .PdCl2溶液能吸收CO,生成黑色Pd沉淀和一种氢化物、一种氧化物。
回答下列问题:
(1)实验室还原CuO适宜选用的还原剂为
(2)小组同学用如图所示装置探究碳粉与CuO反应的产物。

①仪器a的名称为
②试剂X的作用为
③若气体产物中含有CO,则观察到的现象为
(3)某小组同学为测定碳粉还原CuO后固体混合物中单质Cu的质量分数,设计如下实验:准确称取反应管中残留固体8.000g,溶于足量稀硝酸,过滤、洗涤、干燥,所得沉淀的质量为0.160 g;将洗涤液与滤液合并,配成500mL溶液;量取所配溶液25.00mL,加入适当过量的KI溶液;以淀粉为指示剂,用0.500 0 mol·L-1 Na2S2O3标准溶液滴定,达到滴定终点时,消耗标准溶液的体积为12.00mL。已知:2Cu2++5I-=2CuI↓+
 ,
, +2
+2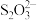 =
=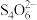 +3I-。
+3I-。①溶解样品时,不能用稀硫酸代替稀硝酸的原因为
②通过计算说明还原产物中是否含有Cu2O:
③若CuI吸附部分
 ,会导致所测Cu单质的质量分数
,会导致所测Cu单质的质量分数
您最近一年使用:0次
名校
解题方法
8 . 草酸铵,化学式为(NH4)2C2O4,溶于水,水溶液显酸性,不稳定,受热可分解,溶液中的钙、镁等离子可以与草酸铵生成沉淀而除去。___ 。
(2)D装置的作用是___ 。
(3)尾气处理的方法是___ 。
(4)草酸铵分解的化学方程式为___ 。
Ⅱ.用草酸铵样品测定硬水中Ca2+和Mg2+的浓度
(5)某化学小组用0.0100mol/L的草酸铵滴定某硬水样品以测定Ca2+和Mg2+的含量。取三份25.00mL的硬水样品分别滴定,平均消耗10.60mL草酸铵溶液,则硬水中Ca2+和Mg2+的总浓度约为____ 。(保留三位有效数字)
(6)草酸铵标准液应放在_____ 滴定管中,若滴定前仰视读数,滴定后平视读数,则所测定的Ca2+和Mg2+浓度将__ (填“偏高”“偏低”或“无影响”)。
Ⅰ.某同学利用如图所示实验装置检验草酸铵的分解产物,现象为B、F中澄清石灰水变浑浊,E中固体变红。
(2)D装置的作用是
(3)尾气处理的方法是
(4)草酸铵分解的化学方程式为
Ⅱ.用草酸铵样品测定硬水中Ca2+和Mg2+的浓度
(5)某化学小组用0.0100mol/L的草酸铵滴定某硬水样品以测定Ca2+和Mg2+的含量。取三份25.00mL的硬水样品分别滴定,平均消耗10.60mL草酸铵溶液,则硬水中Ca2+和Mg2+的总浓度约为
(6)草酸铵标准液应放在
您最近一年使用:0次
2021-09-06更新
|
233次组卷
|
5卷引用:四川省遂宁市射洪中学校2021-2022学年高二下学期期中考试化学试题
9 . 硝酸亚铁可用作媒染剂、分析试剂、催化剂等。
(1)硝酸亚铁可用铁屑在低温下溶于稀硝酸制得,还原产物为NO。反应的化学方程式为________ 。
(2)某小组为探究硝酸亚铁晶体的热分解产物,按下图所示装置进行实验。
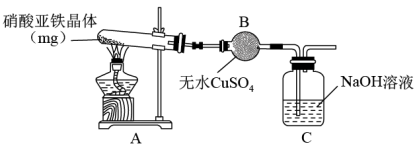
①仪器B的名称是____ ,实验中无水CuSO4变蓝,由此可知硝酸亚铁晶体含有___ 。
②实验中观察到A装置的试管中有红棕色气体生成,检验热分解后固体为氧化铁的实验方案为:
A中硝酸亚铁晶体[Fe(NO3)2·xH2O]分解的化学方程式为______ 。
(3)继续探究mg硝酸亚铁晶体中铁元素的质量分数
①取A中热分解后的固体放入锥形瓶,用稀硫酸溶解,加入过量的KI溶液,滴入2滴___ 作指示剂。
②用a mol/LNa2S2O3标准溶液滴定锥形瓶中的溶液(已知:I2+2S2O32-=2I-+S4O62-),滴定至终点时用去bmLNa2S2O3溶液,则硝酸亚铁晶体中铁的质量分数为______ 。
(1)硝酸亚铁可用铁屑在低温下溶于稀硝酸制得,还原产物为NO。反应的化学方程式为
(2)某小组为探究硝酸亚铁晶体的热分解产物,按下图所示装置进行实验。

①仪器B的名称是
②实验中观察到A装置的试管中有红棕色气体生成,检验热分解后固体为氧化铁的实验方案为:
| 实验步骤 | 现象 |
| 取少量固体加适量稀硫酸,振荡,将溶液分成两份 | 固体溶解得黄色溶液 |
| 一份滴入 | 溶液变成红色 |
| 另一份滴入1~2滴K3 [Fe(CN)6]溶液 |
(3)继续探究mg硝酸亚铁晶体中铁元素的质量分数
①取A中热分解后的固体放入锥形瓶,用稀硫酸溶解,加入过量的KI溶液,滴入2滴
②用a mol/LNa2S2O3标准溶液滴定锥形瓶中的溶液(已知:I2+2S2O32-=2I-+S4O62-),滴定至终点时用去bmLNa2S2O3溶液,则硝酸亚铁晶体中铁的质量分数为
您最近一年使用:0次
2019-09-04更新
|
206次组卷
|
2卷引用:四川省成都市2020届高三高中毕业班摸底测试化学试题
10 . 亚硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的防腐剂。某化学兴趣小组设计如图所示装置(省略夹持装置)制备NaNO2并探究其性质。
②NaNO2易被空气氧化,NO能被酸性高锰酸钾溶液氧化为 ;
;
③HNO2为弱酸,室温下存在反应3HNO2=HNO3+2NO↑+H2O。
回答下列问题:
(1)装置E中盛放铜片的仪器名称是_______ ,其中发生反应的化学方程式为_______ ,检查E装置气密性的方法是_______ 。
(2)上述实验装置中,依次连接的合理顺序为h→_______ 。
(3)装置D中酸性KMnO4溶液的作用是_______ (用离子方程式表示)。
(4)反应结束后,取适量产品溶于稀硫酸中,观察到的实验现象为_______ 。
(5)测定深水井中亚硝酸钠含量:取1000mL水样于锥形瓶中,立即加入500mL0.0001mol/L酸性高锰酸钾溶液,充分反应后用0.0001mol/L草酸溶液滴定高锰酸钾,终点时消耗草酸钠溶液115.00mL。则水中NaNO2的含量为_______ mg/L。若所取样品在空气中放置时间过长,则测定结果_______ (填“偏高”“偏低”或“无影响”)。
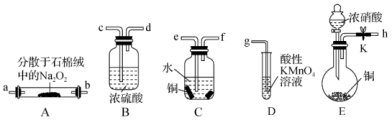
②NaNO2易被空气氧化,NO能被酸性高锰酸钾溶液氧化为
 ;
;③HNO2为弱酸,室温下存在反应3HNO2=HNO3+2NO↑+H2O。
回答下列问题:
(1)装置E中盛放铜片的仪器名称是
(2)上述实验装置中,依次连接的合理顺序为h→
(3)装置D中酸性KMnO4溶液的作用是
(4)反应结束后,取适量产品溶于稀硫酸中,观察到的实验现象为
(5)测定深水井中亚硝酸钠含量:取1000mL水样于锥形瓶中,立即加入500mL0.0001mol/L酸性高锰酸钾溶液,充分反应后用0.0001mol/L草酸溶液滴定高锰酸钾,终点时消耗草酸钠溶液115.00mL。则水中NaNO2的含量为
您最近一年使用:0次
2021-02-09更新
|
170次组卷
|
2卷引用:四川省成都市四川大学附属中学新城分校2021届高三上学期一诊热身考试理科综合能力测试化学试题

 、
、
 、
、 、
、 、
、


