解题方法
1 . 过氧化钠与水反应后滴加酚酞,酚酞先变红后褪色。某小组欲探究其原因,进行以下实验:①取反应后溶液加入二氧化锰后迅速产生大量气体:②、③中红色均不褪去。下列分析错误的是
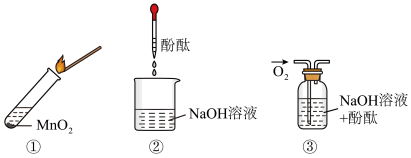
| A.过氧化钠与水反应生成碱 |
B.实验①证明过氧化钠与水反应需要 作催化剂 作催化剂 |
| C.实验②③在本探究过程中证明氧气、氢氧化钠均不能使酚酞褪色 |
| D.过氧化钠与水反应可能生成了具有漂白性的物质 |
您最近一年使用:0次
2 . 氯气在工业生产中有重要的用途。某课外活动小组利用下列装置在实验室中制备氯气,并进行有关氯气性质的研究。
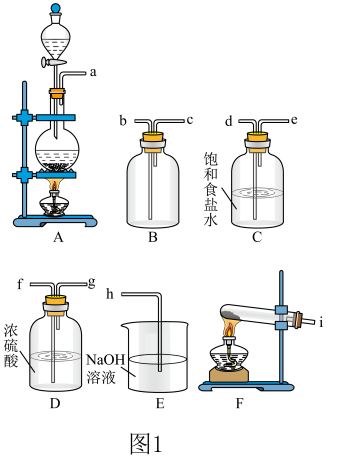
(1)该小组同学欲用图1所示仪器及试剂(不一定全用)制备并收集纯净、干燥的氯气。
①写出实验室制氯气的化学方程式:___________ ;已知浓盐酸的质量分数为36.5%,密度为1.15 g/mL,则该浓盐酸的物质的量浓度是___________ ;浓盐酸起酸性作用和还原剂作用的物质的量之比为___________ 。
②选择装置,将各仪器按先后顺序连接起来,应该是a→___________ →h(用导管口处的字母表示)。
(2)装置C中饱和食盐水的作的作用是___________
(3)用E装置吸收多余氯气,写出E中发生反应的离子方程式:___________ ,实验结束后检验E中溶液含有氯离子的实验操作是___________
(4)该小组同学设计并分别利用图2和图3所示装置探究氯气的氧化性,已知碘单质遇淀粉会变蓝。
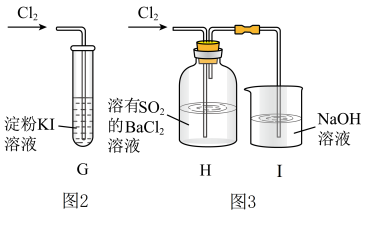
①G中的现象是___________ ,原因是___________ (用化学方程式表示)。
②H中溶液变浑浊,原因是___________ ,___________ (用离子方程式表示)。

(1)该小组同学欲用图1所示仪器及试剂(不一定全用)制备并收集纯净、干燥的氯气。
①写出实验室制氯气的化学方程式:
②选择装置,将各仪器按先后顺序连接起来,应该是a→
(2)装置C中饱和食盐水的作的作用是
(3)用E装置吸收多余氯气,写出E中发生反应的离子方程式:
(4)该小组同学设计并分别利用图2和图3所示装置探究氯气的氧化性,已知碘单质遇淀粉会变蓝。

①G中的现象是
②H中溶液变浑浊,原因是
您最近一年使用:0次
3 . I.氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用。请你根据所学知识回答下列问题:
(1)把氯气通入紫色石蕊溶液中,可以观察到的现象是____ 。
(2)氯气与水反应生成次氯酸(HClO)具有杀菌作用,常用于自来水消毒。请写出氯气与水反应的化学方程式:____ ,在该反应中氧化产物是____ ,还原产物是____ 。
II.如图所示是制取无水氯化铜的实验装置图,将浓盐酸滴加到盛有二氧化锰粉末的圆底烧瓶中。请回答下列问题:
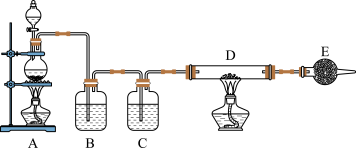
(3)盛放浓盐酸的仪器名称为____ 。
(4)烧瓶中发生反应的离子方程式为____ 。
(5)C瓶中的试剂是____ ,其作用是____ 。
(6)玻璃管D中发生反应的化学方程式为____ ,反应现象是____ 。
(7)干燥管E中盛有碱石灰(CaO+NaOH),其作用是____ 。
(1)把氯气通入紫色石蕊溶液中,可以观察到的现象是
(2)氯气与水反应生成次氯酸(HClO)具有杀菌作用,常用于自来水消毒。请写出氯气与水反应的化学方程式:
II.如图所示是制取无水氯化铜的实验装置图,将浓盐酸滴加到盛有二氧化锰粉末的圆底烧瓶中。请回答下列问题:

(3)盛放浓盐酸的仪器名称为
(4)烧瓶中发生反应的离子方程式为
(5)C瓶中的试剂是
(6)玻璃管D中发生反应的化学方程式为
(7)干燥管E中盛有碱石灰(CaO+NaOH),其作用是
您最近一年使用:0次
4 . 如图是实验室制备氧气并进行一系列相关实验的装置(夹持及加热仪器已省略)。
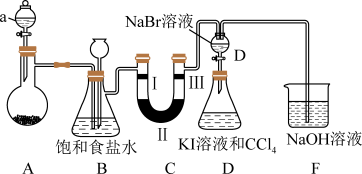
(1)仪器a的名称是_______ 。
(2)装置C的实验目的是验证氧气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ应依次加入_______ (填字母)。
(3)装置B中饱和食盐水的作用是_______ ;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象:_______ 。
(4)实验室常用二氧化锰和浓盐酸制备氯气,发生反应的化学方程式为_______ 。
(5)装置D、E的目的是比较氯、溴、碘单质的氧化性强弱。反应一段时间后,D中溶液逐渐变为棕红色,该实验现象说明了氯的非金属性_______ (填“>”或“<”)溴的非金属性;打开活塞,将装置D中少量溶液加入装置E中,振荡、静置,观察到的现象为_______ ,根据实验现象_______ (填能或否)说明溴、碘的氧化性强弱。
(6)装置F中的溶液可用于吸收余氯,相应的离子反应方程式为_______ 。

(1)仪器a的名称是
(2)装置C的实验目的是验证氧气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ应依次加入
| 选项 | a | b | c | d |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 浓硫酸 | 硅胶 | 无水氯化钙 | 碱石灰 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(4)实验室常用二氧化锰和浓盐酸制备氯气,发生反应的化学方程式为
(5)装置D、E的目的是比较氯、溴、碘单质的氧化性强弱。反应一段时间后,D中溶液逐渐变为棕红色,该实验现象说明了氯的非金属性
(6)装置F中的溶液可用于吸收余氯,相应的离子反应方程式为
您最近一年使用:0次
名校
解题方法
5 . 现有某铁碳合金 (铁和碳两种单质的混合物),某化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了如图所示的实验装置(夹持仪器已省略)和实验方案进行实验探究。

(1)检查上述装置气密性的一种方法是:关闭分液漏斗的活塞,在E装置后面连上一根导管,将导管末端插入水中,然后对A进行加热,观察到_______ ,则证明装置的气密性良好。
(2)先称量E的质量,并将a g铁碳合金样品放入装置A中,再加入足量的浓硫酸,待A中不再逸出气体时,停止加热,拆下E并称重,E增重b g。铁碳合金中铁的质量分数为_______ %(用a、b表示)。
(3)装置B的作用_______ ,装置C的作用_______ 。
(4)甲同学认为,依据此实验测得的数据,计算合金中铁的质量分数可能会偏低,原因是_______ 。

(1)检查上述装置气密性的一种方法是:关闭分液漏斗的活塞,在E装置后面连上一根导管,将导管末端插入水中,然后对A进行加热,观察到
(2)先称量E的质量,并将a g铁碳合金样品放入装置A中,再加入足量的浓硫酸,待A中不再逸出气体时,停止加热,拆下E并称重,E增重b g。铁碳合金中铁的质量分数为
(3)装置B的作用
(4)甲同学认为,依据此实验测得的数据,计算合金中铁的质量分数可能会偏低,原因是
您最近一年使用:0次
6 . 某研究小组探究SO2和Fe(NO3)3溶液的反应。
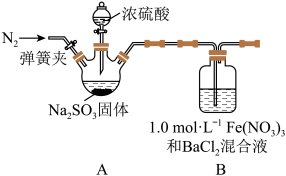
已知:1.0 mol·L-1的Fe(NO3)3溶液的pH=1,铁架台等夹持仪器已略去,请回答:
(1)用于加入浓硫酸的仪器名称为____ 。装置A中发生反应的化学方程式为___________ 。
(2)滴加浓硫酸之前要先打开弹簧夹通入一定量的N2,其目的是____________ 。
(3)实验中,装置B中产生了白色沉淀,该沉淀的成分是___________ ,说明SO2具有______ 性
(4)分析B中产生白色沉淀的原因:
观点1:SO2与Fe3+反应;
观点2:在酸性条件下SO2与 反应;
反应;
基于观点1,装置B中反应的离子方程式是___________ ,为证明该观点,应进一步检验生成的新物质,其实验操作及现象为(假定在反应中SO2的量不足)_____________ 。
基于观点2,只需将装置B中Fe(NO3)3溶液替换为等体积的下列溶液,在相同的条件下进行实验。应选择的最佳试剂是____________ (填序号)。
A. 0.1mol·L-1的稀硝酸
B. 1.5mol·L-1的Fe(NO3)3溶液
C. 6.0mol·L-1 的NaNO3 和0.2mol·L-1盐酸等体积混合的混合液

已知:1.0 mol·L-1的Fe(NO3)3溶液的pH=1,铁架台等夹持仪器已略去,请回答:
(1)用于加入浓硫酸的仪器名称为
(2)滴加浓硫酸之前要先打开弹簧夹通入一定量的N2,其目的是
(3)实验中,装置B中产生了白色沉淀,该沉淀的成分是
(4)分析B中产生白色沉淀的原因:
观点1:SO2与Fe3+反应;
观点2:在酸性条件下SO2与
 反应;
反应;基于观点1,装置B中反应的离子方程式是
基于观点2,只需将装置B中Fe(NO3)3溶液替换为等体积的下列溶液,在相同的条件下进行实验。应选择的最佳试剂是
A. 0.1mol·L-1的稀硝酸
B. 1.5mol·L-1的Fe(NO3)3溶液
C. 6.0mol·L-1 的NaNO3 和0.2mol·L-1盐酸等体积混合的混合液
您最近一年使用:0次
7 . 某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。(已知:Na2SO3+H2SO4===Na2SO4+SO2↑+H2O)
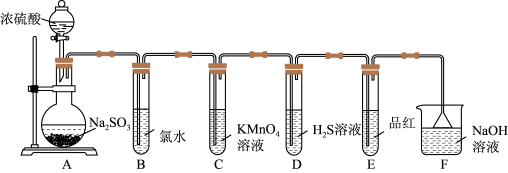
请回答下列问题:
(1)装置A中盛放浓硫酸和亚硫酸钠的仪器名称分别是____ 、____ 。
(2)装置C中的现象是____ ,表现了SO2的_________ (填氧化性或还原性)。
(3)装置E的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象___________ 。
(4)F装置的作用是___ ,漏斗的作用是____ 。

请回答下列问题:
(1)装置A中盛放浓硫酸和亚硫酸钠的仪器名称分别是
(2)装置C中的现象是
(3)装置E的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象
(4)F装置的作用是
您最近一年使用:0次
2013·山东潍坊·一模
名校
解题方法
8 . 某课外活动小组欲利用 CuO 与 NH3反应,研究 NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:
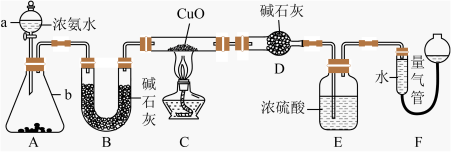
(1)仪器a的名称为_____ ;仪器b中可选择的试剂为________ (填名称)。
(2)实验室中,利用装置A,还可制取的无色气体是______ (填字母)。
A.Cl2 B.O2 C.CO2 D.NO2
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,上述现象证明NH3具有______ 性,写出相应的化学方程式____________ 。
(4)E装置中浓硫酸的作用________ 。
(5)读取气体体积前,应对装置F进行的操作:__________ 。
(6)实验完毕,若测得干燥管D增重mg,装置F测得气体的体积为nL(已折算成标准状况),则氨分子中氮、氢的原子个数比为___________ (用含m、n字母的代数式表示)。

(1)仪器a的名称为
(2)实验室中,利用装置A,还可制取的无色气体是
A.Cl2 B.O2 C.CO2 D.NO2
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,上述现象证明NH3具有
(4)E装置中浓硫酸的作用
(5)读取气体体积前,应对装置F进行的操作:
(6)实验完毕,若测得干燥管D增重mg,装置F测得气体的体积为nL(已折算成标准状况),则氨分子中氮、氢的原子个数比为
您最近一年使用:0次
2020-06-13更新
|
735次组卷
|
40卷引用:内蒙古通辽市科尔沁左翼中旗实验高级中学2021-2022学年高一下学期期中考试(A卷)化学试题
内蒙古通辽市科尔沁左翼中旗实验高级中学2021-2022学年高一下学期期中考试(A卷)化学试题安徽省安庆市怀宁县怀宁中学2019-2020学年高一下学期期中考试化学试题辽宁省六校2020-2021学年高一下学期期中联考化学试题(已下线)2013届山东省潍坊市高三3月第一次模拟考试化学试卷(已下线)2014高考化学名师高考模拟演练练习卷(A)(已下线)2014届高考化学二轮专题冲刺第15讲 实验方案的设计与评价练习卷(已下线)2014高考化学名师知识点精编 专题17氮及其化合物练习卷2017届广东省仲元中学、中山一中等七校高三第一次联考化学试卷2017届江西省铅山一中、横峰中学高三上学期暑假联考化学试卷2017届陕西省西藏民族学院附中高三10月检测化学试卷2017届甘肃省天水一中高三上学期12月月考化学卷2017届甘肃省天水一中高三上12月月考化学试卷苏教版2017届高三单元精练检测九化学试题云南省鹤庆三中2018-2019学年高一下学期期末考试化学试题云南省富宁县一中2019-2020学年高二上学期开学考试化学试题云南省漾濞二中2019-2020学年高二上学期开学考试化学试题安徽省”皖南八校“2020届高三上学期摸底考试化学试题云南省玉溪市新平三中2019-2020学年高一上学期12月月考化学试题云南省玉溪市江川区第二中学2019-2020学年高一上学期12月月考化学试题云南省大姚县一中2019-2020学年高一12月月考化学试题云南省红河哈尼族彝族自治州绿春县一中2019-2020学年高一上学期12月份月考化学试题云南省绿春县二中2019-2020学年高一12月月考化学试题云南省云县第一中学2019-2020学年高二12月月考化学试题1云南省镇康县第一中学2019-2020学年高一12月月考化学试题云南省梁河县第一中学2019-2020学年高一上学期期末考试化学试题云南省广南县第三中学校2019-2020学年高一上学期期末考试化学试题云南省麻栗坡民族中学2019-2020学年高一上学期期末考试化学试题云南省普洱市普洱第二中学2019—2020学年高一上学期期末考试化学试题云南省普洱市澜沧县第一中学2019-2020学年高一上学期期末考试化学试题云南省普洱市孟连县第一中学2019—2020学年高一上学期期末考试化学试题云南省昭通市绥江县二中2019-2020学年高一上学期期末考试化学试题云南省昭通市巧家县第四中学2019-2020学年高一上学期期末考试化学试题云南省玉溪市元江县一中2019-2020学年高一12月月考化学试题云南省勐腊县第二中学2019-2020学年高一上学期期末考试化学试题(已下线)专题02 氮及其化合物(核心素养卷)-【新教材精创】2019-2020学年高一化学新教材知识讲学(必修第二册)河北省衡水市桃城区第十四中学2019-2020学年高一下学期第二次综合测试化学试题(已下线)第12讲 氮及其化合物-2021年高考化学一轮复习名师精讲练(已下线)【浙江新东方】95(已下线)第17讲 氨的转化与生成-【暑假自学课】2022年新高一化学暑假精品课(鲁科版2019必修第一册)河南省安阳市第二中学2021-2022学年高一下学期第一次段考化学试题
9 . 化学反应伴随能量变化,其中能量的主要形式是热能。
I:如图所示,把试管放入盛有25℃饱和澄清石灰水的烧杯中,往试管中放入几小块镁片,再用滴管滴入5mL盐酸于试管中,试回答下列问题:
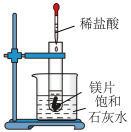
(1)实验中观察到的现象是________________________ 。
(2)产生上述现象的原因是________________________ 。
(3)写出有关反应的离子方程式__________________________ 。
(4)由实验推知,MgCl2和H2的总能量________ (填“大于”“小于”或“等于”)镁片和HCl的总能量。
II:从能量变化的角度研究反应:2H2+O2=2H2O。
(1)如图能正确表示该反应中能量变化的是_________ 。

(2)已知断开或形成1 mol化学键吸收或放出的能量,叫做该化学键的键能,单位为kJ·mol-1。一些键能数据如下表:
请回答:
断裂反应物2 mol H2和1 mol O2的化学键,需要_______ 的总能量为______ kJ;形成生成物2 mol H2 O的化学键,需要______ 的总能量为______ kJ。所以该反应能量变化值的大小 ____________ kJ(填数值)。
I:如图所示,把试管放入盛有25℃饱和澄清石灰水的烧杯中,往试管中放入几小块镁片,再用滴管滴入5mL盐酸于试管中,试回答下列问题:

(1)实验中观察到的现象是
(2)产生上述现象的原因是
(3)写出有关反应的离子方程式
(4)由实验推知,MgCl2和H2的总能量
II:从能量变化的角度研究反应:2H2+O2=2H2O。
(1)如图能正确表示该反应中能量变化的是

(2)已知断开或形成1 mol化学键吸收或放出的能量,叫做该化学键的键能,单位为kJ·mol-1。一些键能数据如下表:
| 化学键 | H—H | O=O | H—O |
| 键能(kJ·mol-1) | 436 | 496 | 463 |
断裂反应物2 mol H2和1 mol O2的化学键,需要
您最近一年使用:0次
10 . 下列实验能达到预期目的是( )
| 选项 | 实验内容 | 实验目的 |
| A | 取两支试管,分别加入4mL 0.01mol/L KMnO4酸性溶液,然后向一支试管中加入0.1mol/L H2C2O4溶液2mL,向另一支试管中加入0.1mol/L H2C2O4溶液4mL,记录褪色时间 | 证明草酸浓度越大,反应速率越快 |
| B | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
| C | 向10mL 0.2mol/L NaOH溶液中滴入2滴0.1mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol/LFeCl3溶液,又生成红褐色沉淀 | 证明在相同温度下的Ksp:Mg(OH)2>Fe(OH)3 |
| D | 室温下,用pH试纸测定浓度为0.1mol·L-1NaClO溶液和0.1mol·L-1CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2019-12-23更新
|
131次组卷
|
2卷引用:内蒙古呼和浩特市第十六中学2020-2021学年高二上学期期中考试化学试题



