1 . 二氧化硫和亚硫酸在工农业生产中具有重要的用途。某化学兴趣小组对SO2和H2SO3的一些性质进行了探究。回答下列问题:
I.探究SO2性质
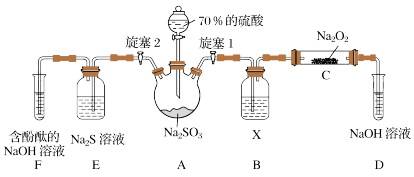
(1)装置B中试剂X是______ 。
(2)关闭旋塞1后,打开旋塞2,装置E中的Na2S溶液用于验证SO2的______ 性,F中的现象______ 。
(3)推测C中固体产物的成分,并写出固体产物中含有的阴离子的检验方法:______ 。
II.探究H2SO3的酸性强于HClO(可能所需要的装置和试剂如图所示)。
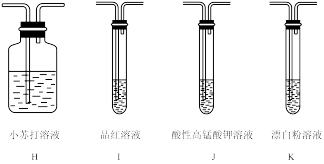
(4)所需装置的连接顺序为:纯净的SO2→______→_______→______→______,______ (填装置标号),装置K中反应的离子方程式为______ 。
(5)能证明H2SO3的酸性强于HClO的现象______ 。
I.探究SO2性质

(1)装置B中试剂X是
(2)关闭旋塞1后,打开旋塞2,装置E中的Na2S溶液用于验证SO2的
(3)推测C中固体产物的成分,并写出固体产物中含有的阴离子的检验方法:
II.探究H2SO3的酸性强于HClO(可能所需要的装置和试剂如图所示)。

(4)所需装置的连接顺序为:纯净的SO2→______→_______→______→______,
(5)能证明H2SO3的酸性强于HClO的现象
您最近一年使用:0次
解题方法
2 . 草酸及其盐在生产生活中有重要用途。某兴趣小组计划制备草酸并研究其性质。
I.草酸的制备
将一定量的催化剂加入100mL质量分数为50%的硝酸中,待溶解后,倒入三颈烧瓶,组装好的实验装置如图所示,缓慢均匀地通入用电石与水反应产生的乙炔气体,反应结束后,将反应后的产品及母液倒出,冷却结晶、过滤,干燥得 。
。
(1)装置A中选择的试剂组合最合理的是_______ (填标号);装置C除干燥外还有的作用是_______ 。
a.水、粉末状电石 b.饱和食盐水、粉末状电石
c.水、块状电石 d.饱和食盐水、块状电石
(2)实验中草酸的产量与起始硝酸的质量分数的变化关系如图所示,A点后草酸的产量下降的原因是_______ 。

(3)反应结束后,装置E得到的溶液中除含有大量的 外,还可能含有的阴离子为
外,还可能含有的阴离子为_______ 。
II.草酸纯度的测定
称取2.500g草酸( )样品,配成100mL溶液。准确量取25.00mL所配溶液于锥形瓶中,加少量硫酸酸化,用
)样品,配成100mL溶液。准确量取25.00mL所配溶液于锥形瓶中,加少量硫酸酸化,用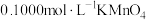 标准溶液进行滴定。
标准溶液进行滴定。
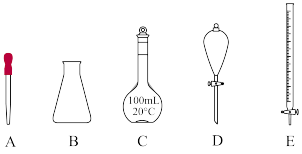
(4)下列仪器中,在配制该溶液时一定需要的是_______ (填对应仪器名称)。
(5)在滴定过程中发现,刚滴下少量 标准溶液时,溶液紫红色并没有马上褪去,将锥形瓶摇动一段时间后,紫红色才慢慢消失,再继续滴加时,紫红色又很快褪去,出现该现象的可能原因是
标准溶液时,溶液紫红色并没有马上褪去,将锥形瓶摇动一段时间后,紫红色才慢慢消失,再继续滴加时,紫红色又很快褪去,出现该现象的可能原因是_______ ;写出滴定过程中发生反应的离子方程式:_______ 。
(6)记录的实验数据如表所示。则此草酸( )样品的纯度为
)样品的纯度为_______ %。
I.草酸的制备
将一定量的催化剂加入100mL质量分数为50%的硝酸中,待溶解后,倒入三颈烧瓶,组装好的实验装置如图所示,缓慢均匀地通入用电石与水反应产生的乙炔气体,反应结束后,将反应后的产品及母液倒出,冷却结晶、过滤,干燥得
 。
。
(1)装置A中选择的试剂组合最合理的是
a.水、粉末状电石 b.饱和食盐水、粉末状电石
c.水、块状电石 d.饱和食盐水、块状电石
(2)实验中草酸的产量与起始硝酸的质量分数的变化关系如图所示,A点后草酸的产量下降的原因是

(3)反应结束后,装置E得到的溶液中除含有大量的
 外,还可能含有的阴离子为
外,还可能含有的阴离子为II.草酸纯度的测定
称取2.500g草酸(
 )样品,配成100mL溶液。准确量取25.00mL所配溶液于锥形瓶中,加少量硫酸酸化,用
)样品,配成100mL溶液。准确量取25.00mL所配溶液于锥形瓶中,加少量硫酸酸化,用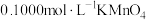 标准溶液进行滴定。
标准溶液进行滴定。(4)下列仪器中,在配制该溶液时一定需要的是

(5)在滴定过程中发现,刚滴下少量
 标准溶液时,溶液紫红色并没有马上褪去,将锥形瓶摇动一段时间后,紫红色才慢慢消失,再继续滴加时,紫红色又很快褪去,出现该现象的可能原因是
标准溶液时,溶液紫红色并没有马上褪去,将锥形瓶摇动一段时间后,紫红色才慢慢消失,再继续滴加时,紫红色又很快褪去,出现该现象的可能原因是(6)记录的实验数据如表所示。则此草酸(
 )样品的纯度为
)样品的纯度为| 序号 | 1 | 2 | 3 |
| 滴定前的刻度/mL | 0.20 | 0.80 | 1.03 |
| 滴定后的刻度/mL | 18.69 | 19.31 | 20.24 |
您最近一年使用:0次
3 . 一氧化氮、二氧化氮等氮氧化物是常见的大气污染物,然而它们在工业上有着广泛的用途。已知:①室温下, ;②酸性条件下,
;②酸性条件下, 或
或 都能与
都能与 反应生成
反应生成 。
。
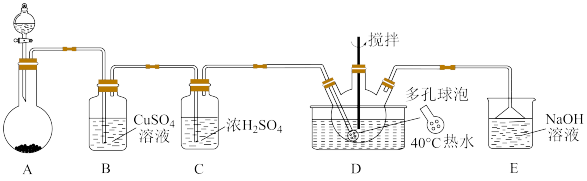
Ⅰ.以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠 的装置如下:
的装置如下:

(1)装置B中主要反应的离子方程式为_______ 。
(2)A中滴入浓硝酸之前,应先通入 一段时间,原因是
一段时间,原因是_______ 。
(3)写出D装置中NO被酸性 氧化的离子反应方程式
氧化的离子反应方程式_______ 。
(4)预测C中反应开始阶段,固体产物除 外,还可能含有的副产物有
外,还可能含有的副产物有 、
、 和
和_______ 为避免产生这些副产物,应在B、C装置间增加球形干燥管E,则E中盛放的试剂名称为_______ 。
Ⅱ.某研究性学习小组对 与Na2O2能否发生反应进行探究。
与Na2O2能否发生反应进行探究。
(5)步骤1:提出假设
假设一: 与
与 不反应;
不反应;
假设二: 能被
能被 氧化;
氧化;
假设三:_______ 。
步骤2:设计实验
实验时,将 气体通入盛有
气体通入盛有 的玻璃管中,淡黄色粉末完全变成白色,说明假设
的玻璃管中,淡黄色粉末完全变成白色,说明假设_______ 不成立。
(6)为验证假设二是否成立,该小组同学进行如下定性实验研究,请完成下表内容。
 ;②酸性条件下,
;②酸性条件下, 或
或 都能与
都能与 反应生成
反应生成 。
。Ⅰ.以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠
 的装置如下:
的装置如下:
(1)装置B中主要反应的离子方程式为
(2)A中滴入浓硝酸之前,应先通入
 一段时间,原因是
一段时间,原因是(3)写出D装置中NO被酸性
 氧化的离子反应方程式
氧化的离子反应方程式(4)预测C中反应开始阶段,固体产物除
 外,还可能含有的副产物有
外,还可能含有的副产物有 、
、 和
和Ⅱ.某研究性学习小组对
 与Na2O2能否发生反应进行探究。
与Na2O2能否发生反应进行探究。(5)步骤1:提出假设
假设一:
 与
与 不反应;
不反应;假设二:
 能被
能被 氧化;
氧化;假设三:
步骤2:设计实验
实验时,将
 气体通入盛有
气体通入盛有 的玻璃管中,淡黄色粉末完全变成白色,说明假设
的玻璃管中,淡黄色粉末完全变成白色,说明假设(6)为验证假设二是否成立,该小组同学进行如下定性实验研究,请完成下表内容。
| 实验步骤(不要求写具体操作过程,试剂、仪器任选) | 预期的实验现象及结论 |
| 取适量的白色固体置于试管中,加蒸馏水溶解, |
您最近一年使用:0次
名校
解题方法
4 . 绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关 和
和 )(设为装置A)称重,记为
)(设为装置A)称重,记为 。将样品装入石英玻璃管中,再次将装置A称重,记为
。将样品装入石英玻璃管中,再次将装置A称重,记为 。按下图连接好装置进行实验。
。按下图连接好装置进行实验。
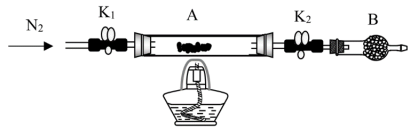
①仪器B的名称是_______ 。
②将下列实验操作步骤正确排序_______ (填标号);重复上述操作步骤,直至A质量几乎不变,记为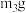 。
。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭 和
和
d.打开 和
和 ,缓缓通入
,缓缓通入 e.称量A f.冷却至室温
e.称量A f.冷却至室温
③根据实验记录,计算绿矾化学式中结晶水数目x=_______ (列式表示)。若实验时按a、d次序操作,则使x_______ (填“偏大”“偏小”或“无影响”)。
(2)为探究硫酸亚铁的分解产物,将(2)中已质量几乎不变的装置A接入下图所示的装置中,打开 和
和 ,缓缓通入
,缓缓通入 ,加热。实验后反应管中残留固体为红棕色粉末。
,加热。实验后反应管中残留固体为红棕色粉末。
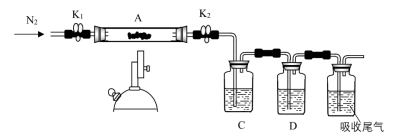
①C、D中的溶液依次为_______ (填标号)。
a.品红 b.NaOH c. d.
d. e.浓
e.浓
②写出硫酸亚铁高温分解反应的化学方程式_______ 。
(3)有同学认为本实验中生成的 和氯水都有漂白性,二者混合后的漂白性会增强,他将
和氯水都有漂白性,二者混合后的漂白性会增强,他将 和
和 按同温同压下体积比1:1同时通入到品红溶液中,结果发现品红溶液未褪色,请分析原因:
按同温同压下体积比1:1同时通入到品红溶液中,结果发现品红溶液未褪色,请分析原因:_______ (用离子方程式表示)。
(4)探究 的酸性强于HClO(可能需要的装置和试剂如图所示)。
的酸性强于HClO(可能需要的装置和试剂如图所示)。
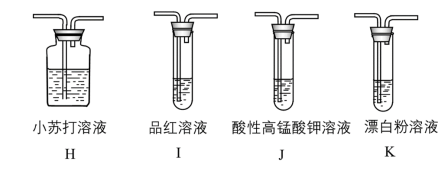
所需装置的连接顺序为:纯净的 →
→_______ (填装置字母代号)。能证明 的酸性强于HClO的实验现象是
的酸性强于HClO的实验现象是_______ 。
(1)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关
 和
和 )(设为装置A)称重,记为
)(设为装置A)称重,记为 。将样品装入石英玻璃管中,再次将装置A称重,记为
。将样品装入石英玻璃管中,再次将装置A称重,记为 。按下图连接好装置进行实验。
。按下图连接好装置进行实验。
①仪器B的名称是
②将下列实验操作步骤正确排序
 。
。a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭
 和
和
d.打开
 和
和 ,缓缓通入
,缓缓通入 e.称量A f.冷却至室温
e.称量A f.冷却至室温③根据实验记录,计算绿矾化学式中结晶水数目x=
(2)为探究硫酸亚铁的分解产物,将(2)中已质量几乎不变的装置A接入下图所示的装置中,打开
 和
和 ,缓缓通入
,缓缓通入 ,加热。实验后反应管中残留固体为红棕色粉末。
,加热。实验后反应管中残留固体为红棕色粉末。
①C、D中的溶液依次为
a.品红 b.NaOH c.
 d.
d. e.浓
e.浓
②写出硫酸亚铁高温分解反应的化学方程式
(3)有同学认为本实验中生成的
 和氯水都有漂白性,二者混合后的漂白性会增强,他将
和氯水都有漂白性,二者混合后的漂白性会增强,他将 和
和 按同温同压下体积比1:1同时通入到品红溶液中,结果发现品红溶液未褪色,请分析原因:
按同温同压下体积比1:1同时通入到品红溶液中,结果发现品红溶液未褪色,请分析原因:(4)探究
 的酸性强于HClO(可能需要的装置和试剂如图所示)。
的酸性强于HClO(可能需要的装置和试剂如图所示)。
所需装置的连接顺序为:纯净的
 →
→ 的酸性强于HClO的实验现象是
的酸性强于HClO的实验现象是
您最近一年使用:0次
2022-04-11更新
|
547次组卷
|
3卷引用:哈尔滨市第九中学校2021-2022学年高一下学期4月阶段性验收考试化学试题
名校
5 . 某化学课外活动小组为了验证元素非金属性递变规律,设计了如下图所示的两套实验方案进行实验探究:
方案一 方案二
方案二
(1)根据方案一装置回答以下问题:
Ⅰ.写出装置①发生的化学反应方程式:_________________ 。
Ⅱ.若将反应后②中的溶液倒入CCl4中,出现的现象与下图吻合的是________ 。(填代号)
Ⅲ.装置③中的现象是____________________ 。
(2)根据方案二装置回答以下问题:
Ⅰ.方案二验证元素非金属性递变的理论依据是:__________________________ 。
Ⅱ.B装置的作用是_________________ ,X是_______________________ 。
Ⅲ.能说明碳元素和硅元素非金属性强弱的实验现象是______________________ 。
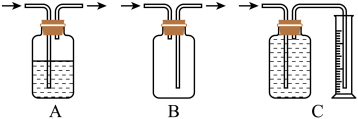
(3)方案一、二中多次用到广口瓶,在化学实验中广口瓶可以配合玻璃管和其他简单仪器组成各种功能的装置,被称为气体实验的“万能瓶”。分析下图中广口瓶组合装置的用途;
A____________ ; B_____________ ; C____________ 。
方案一
 方案二
方案二
(1)根据方案一装置回答以下问题:
Ⅰ.写出装置①发生的化学反应方程式:
Ⅱ.若将反应后②中的溶液倒入CCl4中,出现的现象与下图吻合的是
Ⅲ.装置③中的现象是

(2)根据方案二装置回答以下问题:
Ⅰ.方案二验证元素非金属性递变的理论依据是:
Ⅱ.B装置的作用是
Ⅲ.能说明碳元素和硅元素非金属性强弱的实验现象是
(3)方案一、二中多次用到广口瓶,在化学实验中广口瓶可以配合玻璃管和其他简单仪器组成各种功能的装置,被称为气体实验的“万能瓶”。分析下图中广口瓶组合装置的用途;
A

您最近一年使用:0次
名校
6 . 硫酸铜晶体(CuSO4·xH2O)是一种用途广泛的试剂。某小组拟探究硫酸铜晶体的性质。
实验I:探究硫酸铜的氧化性。
取适量硫酸铜溶液于试管中,加入(NH4)2SO3溶液,产生沉淀M。过滤、洗涤,得到固体M。为了探究M的组成,进行如下实验:
①将一定量同体M分成两份。
②在一份固体中加入稀硫酸,产生有刺激性气味的气体(X),溶液变成蓝色并有红色固体生成;将气体通入品红溶液中,品红溶液褪色。
③在另一份固体中加入浓烧碱溶液,共热,产生气体(Y),该气体能使湿润的红色石蕊试纸变蓝。回答下列问题:
(1)Y的电子式为_____________________ 。
(2)经测定M中阳离子、阴离子个数之比为2:1。M的化学式为__________ 。
实验II:探究硫酸铜晶体的热稳定性。
取少量硫酸铜晶体进行实验,装置如图所示。

已知部分实验现象为:A中蓝色晶体逐渐变成白色粉末,最后变成黑色粉末;B中产生白色沉淀;D中溶液变成红色。
(3)分析推测硫酸铜晶体的分解产物有_________________________ 。
(4)B、C装置的位置不能互换的原因是_______________________________________ 。
(5)D中的反应分两步进行,写出第一步反应的离子方程式_____________________ 。
实验I:探究硫酸铜的氧化性。
取适量硫酸铜溶液于试管中,加入(NH4)2SO3溶液,产生沉淀M。过滤、洗涤,得到固体M。为了探究M的组成,进行如下实验:
①将一定量同体M分成两份。
②在一份固体中加入稀硫酸,产生有刺激性气味的气体(X),溶液变成蓝色并有红色固体生成;将气体通入品红溶液中,品红溶液褪色。
③在另一份固体中加入浓烧碱溶液,共热,产生气体(Y),该气体能使湿润的红色石蕊试纸变蓝。回答下列问题:
(1)Y的电子式为
(2)经测定M中阳离子、阴离子个数之比为2:1。M的化学式为
实验II:探究硫酸铜晶体的热稳定性。
取少量硫酸铜晶体进行实验,装置如图所示。

已知部分实验现象为:A中蓝色晶体逐渐变成白色粉末,最后变成黑色粉末;B中产生白色沉淀;D中溶液变成红色。
(3)分析推测硫酸铜晶体的分解产物有
(4)B、C装置的位置不能互换的原因是
(5)D中的反应分两步进行,写出第一步反应的离子方程式
您最近一年使用:0次
解题方法
7 . 某学习小组同学探究FeSO4的化学性质和用途。
(一)利用下图装置探究FeSO4的稳定性和用途。(绿矾成分为FeSO4·7H2O)
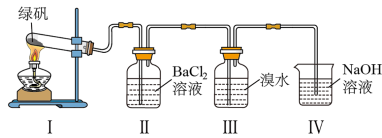
(1)II中有白色沉淀生成,说明FeSO4固体分解生成了_____________ 。
(2)III中溴水是用来检验是否有SO2气体生成,涉及的化学方程式为_________________ ,实验中,观察到溴水褪色,据此推测FeSO4分解最有可能被氧化的元素是______________ 。
(3)Ⅳ中足量NaOH溶液的作用是吸收SO2气体,防止其污染环境,请写出反应的离子方程式___________ 。
(二)探究FeSO4中Fe2+的还原性
(4)证明FeSO4有较强的还原性,完成下表步骤二及其现象。
(三)硫酸亚铁用途探究
(5)缺铁性贫血往往口服硫酸亚铁,当用硫酸亚铁制成药片时,外表包有一层特殊的糖衣,其作用是_______________________ 。
(一)利用下图装置探究FeSO4的稳定性和用途。(绿矾成分为FeSO4·7H2O)

(1)II中有白色沉淀生成,说明FeSO4固体分解生成了
(2)III中溴水是用来检验是否有SO2气体生成,涉及的化学方程式为
(3)Ⅳ中足量NaOH溶液的作用是吸收SO2气体,防止其污染环境,请写出反应的离子方程式
(二)探究FeSO4中Fe2+的还原性
(4)证明FeSO4有较强的还原性,完成下表步骤二及其现象。
| 实验步骤 | 实验预期现象和结论 |
| 步骤一:取少量的FeSO4固体于试管中,加入一定量水溶解。 |  |
| 步骤二:滴加 | 当溶液中出现 |
(5)缺铁性贫血往往口服硫酸亚铁,当用硫酸亚铁制成药片时,外表包有一层特殊的糖衣,其作用是
您最近一年使用:0次



