名校
解题方法
1 . 为探究H2O2、SO2、Br2的性质,某小组同学设计如下实验(夹持及尾气处理装置已略去,气密性已检验)。

(1)在滴入浓硫酸之前要通入N2一段时间的目的是__________________________ 。
(2)该实验可以证明SO2具有_________ 性;H2O2的氧化性_________ Br2(填“强于”“弱于”)。
(3)B中红棕色褪去的原因_______________________________ ,B中重新变成红棕色的原因____________________________________ (均用离子方程式表示)。
(4)C中产生的白色沉淀是______ 。
(5)甲同学通过C中产生白色沉淀,得出结论:SO2能与BaCl2反应产生沉淀。乙同学认为不能得出此结论,并对实验进行了改进:在B和C之间增加盛放_________ 的洗气瓶。再次进行实验时,则C中未产生沉淀。
(6)为进一步研究SO2的性质,分别用煮沸和未煮沸过的蒸馏水配制Ba(NO3)2和BaCl2溶液,进行如下实验:
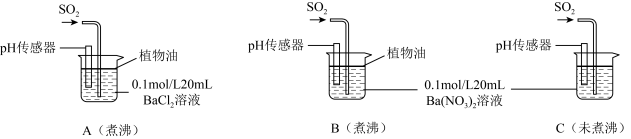
①实验A中,没有观察到白色沉淀,但pH传感器显示溶液呈酸性,原因是__________________ 。(用化学方程式表示)
②实验C中出现白色沉淀比实验B快很多。由此得出的结论是__________________ 。若实验B、C中通入足量的SO2后,溶液酸性:B_________ C(填“强于”“弱于”“等于”)。
(7)Na2SO3固体因贮放不慎发生变质。现取样品1.8克溶于水得溶液A,在A中加入足量BaCl2溶液,过滤得沉淀B,将沉淀B加入足量的稀硫酸后,沉淀不仅不消失,反而增加了0.16g(假如沉淀完全转化)。样品中Na2SO3的质量分数是___________________ 。

| 实验操作 | 实验现象 |
| i.打开弹簧夹,通入N2一段时间,关闭弹簧夹,打开A中分液漏斗活塞,滴加浓硫酸 | A中有气泡产生,B中红棕色溴水褪色,C中有白色沉淀 |
| ⅱ.取C中沉淀加入盐酸 | C中白色沉淀不溶解 |
| ⅲ.打开B中分液漏斗活塞,逐滴滴加H2O2 | 开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色 |
(2)该实验可以证明SO2具有
(3)B中红棕色褪去的原因
(4)C中产生的白色沉淀是
(5)甲同学通过C中产生白色沉淀,得出结论:SO2能与BaCl2反应产生沉淀。乙同学认为不能得出此结论,并对实验进行了改进:在B和C之间增加盛放
(6)为进一步研究SO2的性质,分别用煮沸和未煮沸过的蒸馏水配制Ba(NO3)2和BaCl2溶液,进行如下实验:

①实验A中,没有观察到白色沉淀,但pH传感器显示溶液呈酸性,原因是
②实验C中出现白色沉淀比实验B快很多。由此得出的结论是
(7)Na2SO3固体因贮放不慎发生变质。现取样品1.8克溶于水得溶液A,在A中加入足量BaCl2溶液,过滤得沉淀B,将沉淀B加入足量的稀硫酸后,沉淀不仅不消失,反而增加了0.16g(假如沉淀完全转化)。样品中Na2SO3的质量分数是
您最近一年使用:0次
2020-01-18更新
|
649次组卷
|
3卷引用:广东省汕头市金山中学2019-2020学年高一上学期期末考试化学试题
名校
2 . 下图的实验装置可用于研究SO2转化为SO3的转化率。已知:SO3的熔点是16.8℃,沸点是44.8℃。A处为SO2气体发生装置,C处为SO2与O2反应的装置。
(1).A处的化学反应方程式为__________________ ,仪器F的名称为___________________________ 。
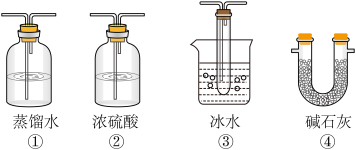
(2).根据实验需要,应该在D、E处连接合适的装置。请从下图中选择,将所选装置的序号填入相应的空格,D:________________ ,E:______________ 。_____ %(用含a、b的代数式表示)。
(4).若Na2SO3变质,会影响到SO2的转化。现欲检验某Na2SO3样品是否变质,你的方法是____________________________________________________________________________________________ 。
(5).实验结束后,如果将收集了SO3的装置敞口露置于空气中,可看到装置出口处产生大量白雾,其原因是___________________________ 。

(1).A处的化学反应方程式为
(2).根据实验需要,应该在D、E处连接合适的装置。请从下图中选择,将所选装置的序号填入相应的空格,D:
(4).若Na2SO3变质,会影响到SO2的转化。现欲检验某Na2SO3样品是否变质,你的方法是
(5).实验结束后,如果将收集了SO3的装置敞口露置于空气中,可看到装置出口处产生大量白雾,其原因是
您最近一年使用:0次
2018-03-27更新
|
651次组卷
|
4卷引用:上海市静安区七一中学2018届高考一模化学试题
解题方法
3 . 某小组探究CuCl2溶液和Na2SO3溶液反应的主要产物,开展如下活动。
[实验准备]
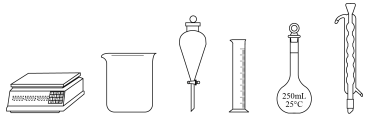
(1)用亚硫酸钠固体配制100mL0.2mol·L-1Na2SO3溶液,下列仪器中无需使用的有___________ (填名称)。
(2)检验亚硫酸钠溶液在空气中是否变质所需的试剂为___________ 。
[理论预测]
(3)预测3中反应的离子方程式为___________ 。
[实验探究]
实验1
取1mL0.2mol·L-1Na2SO3溶液和2mL0.2mol·L-1CuCl2溶液混合,立即生成橙黄色沉淀,3min后沉淀颜色变浅并伴有少量白色沉淀产生振荡1min沉淀全部变为白色。
为证明实验1产生的白色沉淀为CuCl,需鉴定沉淀中含Cl-、Cu+,其中鉴定含Cu+的实验设计如下:
实验2
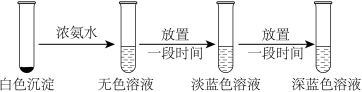
(4)已知[Cu(NH3)2]+、[Cu(NH3)4]2+在水中分别呈无色和深蓝色,实验2总反应的离子方程式为_____ 。
[进一步探究]
查阅资料获知橙黄色沉淀可能为xCuSO3·yCu2SO3·zH2O,在实验1获得橙黄色沉淀后,立即离心分离并洗涤。为探究其组成进行如下实验:
实验3

(5)离心分离的目的是加快过滤速度,防止___________ 。
(6)已知2Cu2++4I-=2CuI↓+I2,实验3___________ (选填“能”或“不能”)证明橙黄色沉淀中含有Cu2+和 。
。
为验证橙黄色沉淀转化为CuCl的原因可能是Cl-提高了Cu2+的氧化性,进行如下实验(已知装置中物质氧化性与还原性强弱差异越大,电压越大)。
实验4
(7)①表中X为___________ 。
②能证实实验结论的实验现象为___________ 。
[解释和结论]
综上所述,Cu2+与 发生复分解反应速率较快,发生氧化还原反应趋势更大。
发生复分解反应速率较快,发生氧化还原反应趋势更大。
[实验准备]
(1)用亚硫酸钠固体配制100mL0.2mol·L-1Na2SO3溶液,下列仪器中无需使用的有

(2)检验亚硫酸钠溶液在空气中是否变质所需的试剂为
[理论预测]
| 预测 | 主要产物 | 主要实验现象 |
| 1 | CuSO3 | 生成绿色沉淀 |
| 2 | Cu(OH)2、SO2 | 溶液中出现蓝色沉淀,伴有刺激性气味气体产生 |
| 3 | Cu2SO3 | 生成红色沉淀 |
| 4 | CuCl | 生成白色沉淀 |
[实验探究]
实验1
取1mL0.2mol·L-1Na2SO3溶液和2mL0.2mol·L-1CuCl2溶液混合,立即生成橙黄色沉淀,3min后沉淀颜色变浅并伴有少量白色沉淀产生振荡1min沉淀全部变为白色。
为证明实验1产生的白色沉淀为CuCl,需鉴定沉淀中含Cl-、Cu+,其中鉴定含Cu+的实验设计如下:
实验2

(4)已知[Cu(NH3)2]+、[Cu(NH3)4]2+在水中分别呈无色和深蓝色,实验2总反应的离子方程式为
[进一步探究]
查阅资料获知橙黄色沉淀可能为xCuSO3·yCu2SO3·zH2O,在实验1获得橙黄色沉淀后,立即离心分离并洗涤。为探究其组成进行如下实验:
实验3

(5)离心分离的目的是加快过滤速度,防止
(6)已知2Cu2++4I-=2CuI↓+I2,实验3
 。
。为验证橙黄色沉淀转化为CuCl的原因可能是Cl-提高了Cu2+的氧化性,进行如下实验(已知装置中物质氧化性与还原性强弱差异越大,电压越大)。
实验4
| 装置 | 试剂a | 试剂b | 电压表读数 |
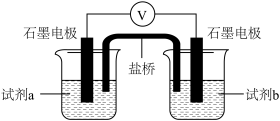 | 0.2mol·L-1Na2SO3溶液 | 0.2mol·L-1CuCl2 溶液 | V1 |
| 0.2mol·L-1Na2SO3溶液 | X | V2 |
②能证实实验结论的实验现象为
[解释和结论]
综上所述,Cu2+与
 发生复分解反应速率较快,发生氧化还原反应趋势更大。
发生复分解反应速率较快,发生氧化还原反应趋势更大。
您最近一年使用:0次
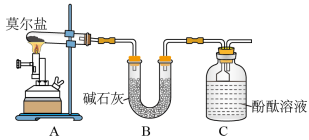
4 . “摩尔盐”[(NH4)2Fe(SO4)2·6H2O]是分析化学中的重要试剂。已知:摩尔盐隔绝空气加热至500 ℃时可完全分解。某学习小组欲探究其分解产物。
(1)【提出猜想】小组同学认为分解产物可能有以下几种情况:
A.Fe2O3SO2NH3H2O
B.FeOSO3NH3H2O
C.FeOSO2NH3H2O
D.Fe2O3SO3SO2NH3H2O
根据所学知识,可确定________ 不成立(填序号)。
(2)【药品验纯】甲同学提出可以用湿润的红色石蕊试纸、稀盐酸和________ 溶液检验出“摩尔盐”中的三种离子;取一定量的“摩尔盐”配成溶液,取少量溶液置于试管中,向其中滴加________ (填试剂名称和实验现象),则“摩尔盐”未因氧化而变质。
(3)【实验探究】为检验分解产物,甲同学设计了如下实验装置。
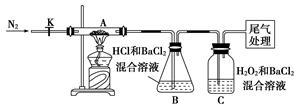
①取一定量“摩尔盐”置于加热管A中,加热至分解完全后打开K,再通入N2,目的是____________________ 。
②实验中观察到A中固体逐渐变为红棕色,B、C中均产生白色沉淀。C中发生反应的离子方程式为______________________ 。
③实验验证:取A中残留物少许加入稀硫酸溶解,再滴入KMnO4稀溶液,不褪色证明产物不含______________________ 。
(4)【实验结论与反思】通过实验现象和认真反思,上述(1)猜想中一定正确的是________ (填序号)。
(1)【提出猜想】小组同学认为分解产物可能有以下几种情况:
A.Fe2O3SO2NH3H2O
B.FeOSO3NH3H2O
C.FeOSO2NH3H2O
D.Fe2O3SO3SO2NH3H2O
根据所学知识,可确定
(2)【药品验纯】甲同学提出可以用湿润的红色石蕊试纸、稀盐酸和
(3)【实验探究】为检验分解产物,甲同学设计了如下实验装置。

①取一定量“摩尔盐”置于加热管A中,加热至分解完全后打开K,再通入N2,目的是
②实验中观察到A中固体逐渐变为红棕色,B、C中均产生白色沉淀。C中发生反应的离子方程式为
③实验验证:取A中残留物少许加入稀硫酸溶解,再滴入KMnO4稀溶液,不褪色证明产物不含
(4)【实验结论与反思】通过实验现象和认真反思,上述(1)猜想中一定正确的是
您最近一年使用:0次
名校
5 . 亚硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂。某化学兴趣小组设计实验制备NaNO2并探究其性质。
查阅资料信息:①2NO+Na2O2=2NaNO2;2NO2+Na2O2=2NaNO3。
②酸性KMnO4溶液可将低价氮的氧化物或酸根离子氧化为NO 。
。
(1)NaNO2的制备(夹持装置和加热装置均已略,已检查装置气密性)。
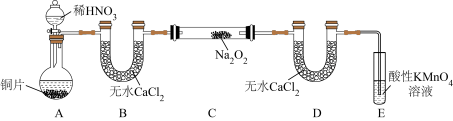
①若没有装置B,则装置C中Na2O2与水发生反应:_____ (写化学方程式)。
②制得的NaNO2固体中混有的杂质主要为NaNO3,改进措施是在装置A、B间添加_____ ,提高NaNO2的纯度。
③装置E中发生的主要反应的离子方程式为_____ 。
(2)验证亚硝酸钠与70%硫酸反应的气体产物为NO和NO2的混合气体。
已知:FeSO4溶液可吸收NO;NO2的沸点为21℃,熔点为-11℃。

①为了检验装置A中生成的气体产物,装置的连接顺序是A→_____ 。(按气流方向从左到右)
②反应前应打开弹簧夹1,先通入一段时间氮气,目的是_____ 。
(3)测定某亚硝酸钠样品的纯度。
设该样品的杂质均不与酸性KMnO4溶液反应,可用酸性KMnO4溶液测定NaNO2的含量。称取2.0g亚硝酸钠样品溶于水配成250mL溶液,取出25.00mL溶液于锥形瓶中,再用0.1000mol•L-1的酸性KMnO4标准溶液进行滴定,消耗酸性KMnO4标准溶液的体积如表:
该亚硝酸钠样品中NaNO2的质量分数为______ 。
查阅资料信息:①2NO+Na2O2=2NaNO2;2NO2+Na2O2=2NaNO3。
②酸性KMnO4溶液可将低价氮的氧化物或酸根离子氧化为NO
 。
。(1)NaNO2的制备(夹持装置和加热装置均已略,已检查装置气密性)。

①若没有装置B,则装置C中Na2O2与水发生反应:
②制得的NaNO2固体中混有的杂质主要为NaNO3,改进措施是在装置A、B间添加
③装置E中发生的主要反应的离子方程式为
(2)验证亚硝酸钠与70%硫酸反应的气体产物为NO和NO2的混合气体。
已知:FeSO4溶液可吸收NO;NO2的沸点为21℃,熔点为-11℃。

①为了检验装置A中生成的气体产物,装置的连接顺序是A→
②反应前应打开弹簧夹1,先通入一段时间氮气,目的是
(3)测定某亚硝酸钠样品的纯度。
设该样品的杂质均不与酸性KMnO4溶液反应,可用酸性KMnO4溶液测定NaNO2的含量。称取2.0g亚硝酸钠样品溶于水配成250mL溶液,取出25.00mL溶液于锥形瓶中,再用0.1000mol•L-1的酸性KMnO4标准溶液进行滴定,消耗酸性KMnO4标准溶液的体积如表:
| 实验组 | 第一组 | 第二组 | 第三组 | 第四组 |
| 消耗酸性KMnO4标准溶液的体积/mL | 9.97 | 10.02 | 12.01 | 10.01 |
您最近一年使用:0次
2023-03-29更新
|
171次组卷
|
2卷引用:云南省大理白族自治州民族中学2022-2023学年高二下学期3月月考化学试题
名校
解题方法
6 . 甲醛与新制氢氧化铜反应的产物随反应条件改变而有所不同。实验室对该反应在一定条件下所得产物成分进行探究,具体过程如下。
取一定量的 溶液、
溶液、 溶液和甲醛于锥形瓬中,控制温度为40~50℃回流
溶液和甲醛于锥形瓬中,控制温度为40~50℃回流 ,收集到大量气体
,收集到大量气体 ,并有红色沉淀生成。
,并有红色沉淀生成。
(1)①“控制温度为40~50℃”的常用加热方法是___________ 。
②气体 能燃烧且完全燃烧产物不会使澄清石床水变浑浊,说明该气体是
能燃烧且完全燃烧产物不会使澄清石床水变浑浊,说明该气体是___________ 。
(2)在探究甲醛的氧化产物时,发现未生成 。为了进一步确定甲醛是否被氧化为
。为了进一步确定甲醛是否被氧化为 ,进行如图实验(夹持装置和加热装置已省略,甲酸与浓硫酸反应能生成
,进行如图实验(夹持装置和加热装置已省略,甲酸与浓硫酸反应能生成 ,而
,而 可将银氨溶液还原成银单质)。
可将银氨溶液还原成银单质)。
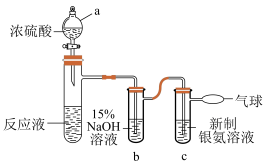
①仪器a的名称是___________ 。
②b中, 溶液的作用是
溶液的作用是___________ 。
③c中,银氨溶液中出现黑色沉淀,则氧化剂与还原剂的物质的量之比为___________ 。
(3)已知: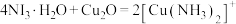 (无色)
(无色) ,
, 遇空气容易被氧化成
遇空气容易被氧化成 (蓝色);验证红色沉淀中含
(蓝色);验证红色沉淀中含 ,进行如下实验步骤和现象记录:取样品,
,进行如下实验步骤和现象记录:取样品,___________ ,说明红色固体中含 。
。
(4)若最终测得红色沉淀为 和少量的
和少量的 ,且
,且 的物质的量和气体X的相等,则该条件下甲醛与新制氢氧化铜、氢氧化钠溶液反应生成
的物质的量和气体X的相等,则该条件下甲醛与新制氢氧化铜、氢氧化钠溶液反应生成 和气体X的化学方程式
和气体X的化学方程式___________ 。
取一定量的
 溶液、
溶液、 溶液和甲醛于锥形瓬中,控制温度为40~50℃回流
溶液和甲醛于锥形瓬中,控制温度为40~50℃回流 ,收集到大量气体
,收集到大量气体 ,并有红色沉淀生成。
,并有红色沉淀生成。(1)①“控制温度为40~50℃”的常用加热方法是
②气体
 能燃烧且完全燃烧产物不会使澄清石床水变浑浊,说明该气体是
能燃烧且完全燃烧产物不会使澄清石床水变浑浊,说明该气体是(2)在探究甲醛的氧化产物时,发现未生成
 。为了进一步确定甲醛是否被氧化为
。为了进一步确定甲醛是否被氧化为 ,进行如图实验(夹持装置和加热装置已省略,甲酸与浓硫酸反应能生成
,进行如图实验(夹持装置和加热装置已省略,甲酸与浓硫酸反应能生成 ,而
,而 可将银氨溶液还原成银单质)。
可将银氨溶液还原成银单质)。
①仪器a的名称是
②b中,
 溶液的作用是
溶液的作用是③c中,银氨溶液中出现黑色沉淀,则氧化剂与还原剂的物质的量之比为
(3)已知:
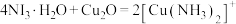 (无色)
(无色) ,
, 遇空气容易被氧化成
遇空气容易被氧化成 (蓝色);验证红色沉淀中含
(蓝色);验证红色沉淀中含 ,进行如下实验步骤和现象记录:取样品,
,进行如下实验步骤和现象记录:取样品, 。
。(4)若最终测得红色沉淀为
 和少量的
和少量的 ,且
,且 的物质的量和气体X的相等,则该条件下甲醛与新制氢氧化铜、氢氧化钠溶液反应生成
的物质的量和气体X的相等,则该条件下甲醛与新制氢氧化铜、氢氧化钠溶液反应生成 和气体X的化学方程式
和气体X的化学方程式
您最近一年使用:0次
名校
解题方法
7 . 已知硫酸亚铁铵[ ](俗称莫尔盐)可溶于水,在
](俗称莫尔盐)可溶于水,在 时分解,其探究其化学性质,甲、乙两同学设计了如下实验。
时分解,其探究其化学性质,甲、乙两同学设计了如下实验。
Ⅰ. 探究莫尔盐晶体加热时的分解产物。
(1)甲同学设计如图所示的装置进行实验。装置C中可观察到的现象是_______ ,由此可知分解产物中有_______ (填化学式)。
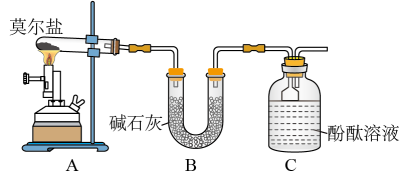
(2)乙同学认为莫尔盐晶体分解的产物中还可能含有 、
、 及
及 。为验证产物的存在,用下列装置进行实验。
。为验证产物的存在,用下列装置进行实验。
①乙同学的实验中,装置依次连按的合理顺序为:A→H→→→→G。_______
②证明含有 的实验现象是
的实验现象是_______ 。
Ⅱ. 为测定硫酸亚铁铵纯度,称取mg莫尔盐样品,配成 溶液。甲、乙两位同学设计了如下两个实验方案。
溶液。甲、乙两位同学设计了如下两个实验方案。
甲方案:取 样品溶液用
样品溶液用 的酸性
的酸性 溶液分三次进行测定。
溶液分三次进行测定。
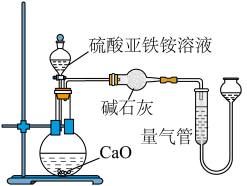
乙方案(通过 测定):实验设计装置如图所示。取
测定):实验设计装置如图所示。取 样品溶液进行该实验。
样品溶液进行该实验。
请回答:
(3)乙方案中量气管中最佳试剂是_______ 。
a. 水 b. 饱和 溶液 c.
溶液 c.  d. 饱和
d. 饱和 溶液
溶液
(4)乙方案中收集完气体并恢复至室温,为了减小实验误差,读数前应进行的操作是_______ 。
(5)若测得 为VL(已折算为标准状况下),则硫酸亚铁铵纯度为
为VL(已折算为标准状况下),则硫酸亚铁铵纯度为_______ (列出计算式)。
 ](俗称莫尔盐)可溶于水,在
](俗称莫尔盐)可溶于水,在 时分解,其探究其化学性质,甲、乙两同学设计了如下实验。
时分解,其探究其化学性质,甲、乙两同学设计了如下实验。Ⅰ. 探究莫尔盐晶体加热时的分解产物。
(1)甲同学设计如图所示的装置进行实验。装置C中可观察到的现象是

(2)乙同学认为莫尔盐晶体分解的产物中还可能含有
 、
、 及
及 。为验证产物的存在,用下列装置进行实验。
。为验证产物的存在,用下列装置进行实验。 | 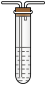 |  | 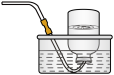 |  |
| D. 品红溶液 | E.  溶液 溶液 | F.  溶液和足量盐酸 溶液和足量盐酸 | G. 排水集气法 | H.安全瓶 |
②证明含有
 的实验现象是
的实验现象是Ⅱ. 为测定硫酸亚铁铵纯度,称取mg莫尔盐样品,配成
 溶液。甲、乙两位同学设计了如下两个实验方案。
溶液。甲、乙两位同学设计了如下两个实验方案。甲方案:取
 样品溶液用
样品溶液用 的酸性
的酸性 溶液分三次进行测定。
溶液分三次进行测定。乙方案(通过
 测定):实验设计装置如图所示。取
测定):实验设计装置如图所示。取 样品溶液进行该实验。
样品溶液进行该实验。
请回答:
(3)乙方案中量气管中最佳试剂是
a. 水 b. 饱和
 溶液 c.
溶液 c.  d. 饱和
d. 饱和 溶液
溶液(4)乙方案中收集完气体并恢复至室温,为了减小实验误差,读数前应进行的操作是
(5)若测得
 为VL(已折算为标准状况下),则硫酸亚铁铵纯度为
为VL(已折算为标准状况下),则硫酸亚铁铵纯度为
您最近一年使用:0次
2023-01-21更新
|
764次组卷
|
3卷引用:山东省青岛第五十八中学2022-2023学年高一上学期期末考试化学试题
解题方法
8 . 以Fe2O3/CeO2作催化剂,可用乙烯脱除烟气中SO2并回收单质硫。某兴趣小组同学设计实验验证该反应并检验产物中的CO2,实验装置(夹持装置已略)如图所示:
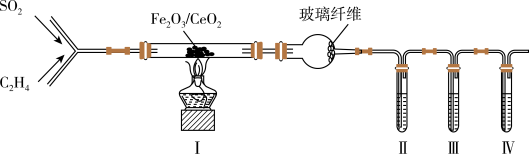
已知:反应原理为:CH2=CH2+3SO2 3S+2CO2+2H2O。装置Ⅰ生成的S、CO2、H2O均为气体。
3S+2CO2+2H2O。装置Ⅰ生成的S、CO2、H2O均为气体。
(1)装置中玻璃纤维的作用是___ 。
(2)为检验CO2,则装置Ⅱ、Ⅲ、Ⅳ中盛放的试剂依次是___ (填序号)。
①酸性KMnO4溶液②澄清石灰水③Br2的CCl4溶液
(3)为制作反应的催化剂,实验小组制备了一定质量的Fe2O3(含FeO杂质)样品,为测定其中Fe2O3的质量分数,现进行如下实验:
步骤1:称取0.20g样品,向样品中加入足量的盐酸使其完全溶解。
步骤2:向溶液中加入足量的KI溶液,充分反应。
步骤3:向溶液中加入0.10mol·L-1Na2S2O3溶液,恰好完全反应时消耗Na2S2O3溶液体积为20.00mL生成Na2S4O6。
计算样品中所含Fe2O3的质量分数___ 。(写出计算过程)

已知:反应原理为:CH2=CH2+3SO2
 3S+2CO2+2H2O。装置Ⅰ生成的S、CO2、H2O均为气体。
3S+2CO2+2H2O。装置Ⅰ生成的S、CO2、H2O均为气体。(1)装置中玻璃纤维的作用是
(2)为检验CO2,则装置Ⅱ、Ⅲ、Ⅳ中盛放的试剂依次是
①酸性KMnO4溶液②澄清石灰水③Br2的CCl4溶液
(3)为制作反应的催化剂,实验小组制备了一定质量的Fe2O3(含FeO杂质)样品,为测定其中Fe2O3的质量分数,现进行如下实验:
步骤1:称取0.20g样品,向样品中加入足量的盐酸使其完全溶解。
步骤2:向溶液中加入足量的KI溶液,充分反应。
步骤3:向溶液中加入0.10mol·L-1Na2S2O3溶液,恰好完全反应时消耗Na2S2O3溶液体积为20.00mL生成Na2S4O6。
计算样品中所含Fe2O3的质量分数
您最近一年使用:0次
2021-06-23更新
|
580次组卷
|
2卷引用:江苏省南京市六校联考2020-2021学年高一下学期期末考试化学试题
解题方法
9 . 已知硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O](俗称莫尔盐)可溶于水,在100℃~110℃时分解,其探究其化学性质,甲、乙两同学设计了如下实验。
I.探究莫尔盐晶体加热时的分解产物。
(1)甲同学设计如图所示的装置进行实验。装置C中可观察到的现象是_________ ,由此可知分解产物中有________ (填化学式)。
(2)乙同学认为莫尔盐晶体分解的产物中还可能含有SO3(g)、SO2(g)及N2(g)。为验证产物的存在,用下列装置进行实验。
D. 品红溶液 E.NaOH溶液
E.NaOH溶液  F.BaCl2溶液和足量盐酸
F.BaCl2溶液和足量盐酸  G.排水集气法
G.排水集气法  H. 安全瓶
H. 安全瓶
①乙同学的实验中,装置依次连按的合理顺序为:A→H→( ) →( ) →( ) →G。
②证明含有SO3的实验现象是__________ ;安全瓶H的作用是___________ 。
II.为测定硫酸亚铁铵纯度,称取mg莫尔盐样品,配成500mL溶液。甲、乙两位同学设计了如下两个实验方案。
甲方案:取25.00mL样品溶液用0.1000mol/L的酸性K2Cr2O7溶液分三次进行滴定。
乙方案(通过NH4+测定):实验设计装置如图所示。取25.00mL样品溶液进行该实验。
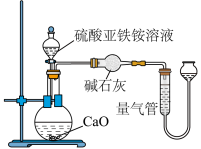
请回答:
(1)甲方案中的离子方程式为___________ 。
(2)乙方案中量气管中最佳试剂是__________ 。
a.水 b.饱和NaHCO3溶液 c.CCl4 d.饱和NaCl溶液
(3)乙方案中收集完气体并恢复至室温,为了减小实验误差,读数前应进行的操作是_________ 。
(4)若测得NH3为VL(已折算为标准状况下),则硫酸亚铁铵纯度为____ (列出计算式)
I.探究莫尔盐晶体加热时的分解产物。
(1)甲同学设计如图所示的装置进行实验。装置C中可观察到的现象是

(2)乙同学认为莫尔盐晶体分解的产物中还可能含有SO3(g)、SO2(g)及N2(g)。为验证产物的存在,用下列装置进行实验。
D. 品红溶液
 E.NaOH溶液
E.NaOH溶液  F.BaCl2溶液和足量盐酸
F.BaCl2溶液和足量盐酸  G.排水集气法
G.排水集气法  H. 安全瓶
H. 安全瓶
①乙同学的实验中,装置依次连按的合理顺序为:A→H→
②证明含有SO3的实验现象是
II.为测定硫酸亚铁铵纯度,称取mg莫尔盐样品,配成500mL溶液。甲、乙两位同学设计了如下两个实验方案。
甲方案:取25.00mL样品溶液用0.1000mol/L的酸性K2Cr2O7溶液分三次进行滴定。
乙方案(通过NH4+测定):实验设计装置如图所示。取25.00mL样品溶液进行该实验。

请回答:
(1)甲方案中的离子方程式为
(2)乙方案中量气管中最佳试剂是
a.水 b.饱和NaHCO3溶液 c.CCl4 d.饱和NaCl溶液
(3)乙方案中收集完气体并恢复至室温,为了减小实验误差,读数前应进行的操作是
(4)若测得NH3为VL(已折算为标准状况下),则硫酸亚铁铵纯度为
您最近一年使用:0次
10 . 为了探究Cu(NO3)2 的氧化性和热稳定性,某化学兴趣小组设计了如下实验。
Ⅰ.Cu(NO3)2的氧化性
将光亮的铁丝伸入Cu(NO3)2溶液中,一段时间后将铁丝取出。为检验溶液中Fe 的氧化产物,将溶液中的Cu2+除尽后,进行了如下实验。可选用的试剂KSCN 溶液、K3[Fe(CN)6]溶液、氯水。
请完成下表:
Ⅱ.Cu(NO3)2 的热稳定性
在如图所示的实验装置A 中,用酒精喷灯对Cu(NO3)2固体加强热,产生红棕色气体,在装置C中收集到无色气体,经验证为O2。当反应结束以后,试管中残留固体为红色。
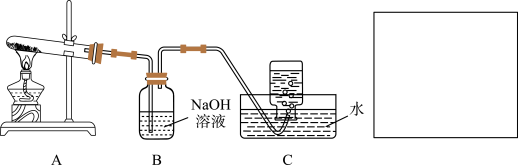
(1)装置B 的作用是_______ 。
(2)从实验安全角度考虑,需要在A、B 间加入装置M,请在方框中画出M 装置。_________
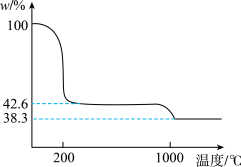
(3)下图为Cu(NO3)2样品高温过程的热重曲线(样品质量分数w%随温度变化的曲线)。Cu(NO3)2加热到200℃的化学方程式为___________ ,继续高温至1000℃生成_______ (填化学式)固体。
 。
。
Ⅰ.Cu(NO3)2的氧化性
将光亮的铁丝伸入Cu(NO3)2溶液中,一段时间后将铁丝取出。为检验溶液中Fe 的氧化产物,将溶液中的Cu2+除尽后,进行了如下实验。可选用的试剂KSCN 溶液、K3[Fe(CN)6]溶液、氯水。
请完成下表:
| 操作 | 反应或现象 | 结论 |
| (1)取少量除尽 Cu2+后的溶液于试管中,加入 | 现象 | 存在 Fe3+ |
| (2)取少量除尽 Cu2+后的溶液于试管中,加入 K3[Fe(CN)6]溶液,振荡 | 离子方程式 | 存在 Fe2+ |
Ⅱ.Cu(NO3)2 的热稳定性
在如图所示的实验装置A 中,用酒精喷灯对Cu(NO3)2固体加强热,产生红棕色气体,在装置C中收集到无色气体,经验证为O2。当反应结束以后,试管中残留固体为红色。

(1)装置B 的作用是
(2)从实验安全角度考虑,需要在A、B 间加入装置M,请在方框中画出M 装置。
(3)下图为Cu(NO3)2样品高温过程的热重曲线(样品质量分数w%随温度变化的曲线)。Cu(NO3)2加热到200℃的化学方程式为
 。
。
您最近一年使用:0次
2019-09-17更新
|
372次组卷
|
3卷引用:2016届湖北省部分重点中学高三上学期起点考试化学试卷



